Рациональный выбор гепатопротекторов в терапии хронических заболеваний печени
- Аннотация
- Статья
- Ссылки
- English






Эпидемиология хронических заболеваний печени
Распространенность хронических заболеваний печени (ХЗП) составляет не менее 1,5 млрд человек во всем мире. Наиболее частыми причинами ХЗП являются неалкогольная жировая болезнь печени (НЖБП, 59%), распространенность которой достигает 25% населения [1], затем следуют хронические вирусные гепатиты В (ВГВ, 29%) и С (ВГС, 9%), а также алкогольная болезнь печени (АБП, 2%). На другие патологии, в том числе первичный билиарный холангит, первичный склерозирующий холангит, дефицит альфа-1-антитрипсина, болезнь Вильсона – Коновалова, аутоиммунный гепатит и другие, приходится до 1% случаев [2].
ХЗП послужили причиной 1,3 млн смертей в 2017 г., а цирроз печени (ЦП) занимает 11-е место среди возможных причин смерти. В табл. 1 представлена структура смертности при ЦП в зависимости от его этиологии. Согласно этим данным, лидирующие позиции в структуре смертности занимают хронические вирусные гепатиты и АБП [2]. Тем не менее повышение эффективности лечения и профилактики ВГВ и ВГС, а также увеличение распространенности ожирения и метаболических нарушений приводят к тому, что ведущим этиологическим фактором ЦП в мире становится НЖБП [3].
В России патология печени занимает центральное место в структуре гастроэнтерологической смертности [3], при этом до 68% смертей от ЦП связаны с приемом алкоголя [4]. Так, в 2016 г. Россия занимала первое место по уровню потребления алкоголя (12 литров в год на душу населения) [2]. Кроме того, Россия опережает мировую статистику и по распространенности НЖБП, которая, по данным 2015 г., составила 37,3% [5]. Эпидемиология вирусных гепатитов на территории нашей страны также несколько отличается от мировой: заболеваемость ВГС превосходит таковую ВГВ в 3,5 раза, составляя 77,4% от всех вирусных гепатитов [6], в то же время рост применения внутривенных ЛС может приводить к увеличению числа новых случаев инфекции ВГВ [2].
Согласно результатам крупного международного исследования, общее число смертей от ЦП в России в 1990 г. составило 17 451, что соответствует смертности 9,6 человек на 100 тыс. населения. В 2017 г. эти показатели возросли на 152%: общее число смертей достигло 50 910 человек, а смертность – 24,3 на 100 тыс. населения. Смертность от ЦП в 2017 г. в России распределилась между нозологиями следующим образом: ВГВ – 18,1%, ВГС – 24,7%, АБП – 36,7%, НЖБП – 11,2%, другие – 9,4%. Распространенность ЦП также возросла за указанный период. Число пациентов с компенсированным ЦП увеличилось с 2,5 млн человек (1521 человек на 100 тыс. населения) в 1990 г. до 3,9 млн (2252 человек на 100 тыс. населения) в 2017 г.; а количество декомпенсированных пациентов с ЦП – 219 тыс. больных (129,8 человек на 100 тыс. населения) в 1990 г. возросло до 452 тыс. (238 человек на 100 тыс. населения) в 2017 г. (табл. 2) [7].
Особенности патогенеза ХЗП и поиск мишеней для гепатопротективной терапии
Как известно, ведущими в клинической картине поражения печени являются основные морфо-лабораторные синдромы, а именно [8]:
- синдром цитолиза (цитолитический синдром, синдром нарушения целостности гепатоцитов);
- синдром холестаза (холестатический синдром, нарушение экскреторной функции печени и целостности холангиоцитов);
- иммуновоспалительный (мезенхимально-воспалительный) синдром;
- синдром печеночно-клеточной недостаточности (ПКН).
Синдром цитолиза подразумевает нарушение проницаемости и/или распад цитоплазматических мембран, в том числе вследствие воспаления и некроза гепатоцитов, с выходом в плазму крови печеночных ферментов (аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), лактатдегидрогеназы (ЛДГ) и др.). АЛТ и АСТ присутствуют во многих клетках в организме человека, однако АЛТ содержится преимущественно в цитоплазме гепатоцитов, что позволяет рассматривать ее как маркер гепатоцеллюлярного повреждения. АСТ, в свою очередь, преимущественно содержится в митохондриях гепатоцитов, а кроме того, выявляется в мышечных тканях (скелетной и сердечной), почках, поджелудочной железе, легких, лейкоцитах и эритроцитах. При этом АЛТ на 100% представлена цитоплазматической фракцией, в то время как лишь 20% АСТ находится в цитоплазме, остальные 80% приходятся на митохондриальную фракцию гепатоцитов. По этой причине при поражении клеток печени в первую очередь повышается активность АЛТ [9].
Большинство заболеваний печени, протекающих с цитолитическим синдромом, сопровождаются повреждением мезенхимы и стромы органа, лежащих в основе мезенхимально-воспалительного синдрома. Этот синдром включает комплекс клинических (лихорадка, артралгии, миалгии, кожные проявления, системные внепеченочные проявления) и лабораторных (высокая СОЭ (скорость оседания эритроцитов), гипергаммаглобулинемия, увеличение циркулирующих иммунных комплексов, иммуноглобулинов А, M и G, С-реактивного белка, выявление специфических антител, LE-клеток, ревматоидного фактора, ложноположительная реакция Вассермана) признаков, свидетельствующих о сенсибилизации иммунокомпетентных клеток и активации ретикулогистиолимфоцитарной (мезенхимальной) системы печени. При этом показатели иммуновоспалительной реакции используются для диагностики и оценки активности процесса [8, 10]. Хроническая гибель гепатоцитов и воспаление в печени в конечном итоге запускают процессы фиброгенеза [11].
Под холестазом понимают нарушение формирования, секреции и оттока желчи. По месту и механизму возникновения холестаз можно разделить на внепеченочный и внутрипеченочный, а последний – на паренхиматозно-каналикулярный и дуктулярный. В основе паренхиматозно-каналикулярного холестаза лежат снижение текучести базолатеральной и/или каналикулярной мембраны гепатоцитов, ингибирование Na+/K+-АТФазы и других мембранных переносчиков, нарушение целостности каналикул, что лабораторно характеризуется повышением уровня гамма-глутамилтранспептидазы (ГГТП), умеренным (до 2 и более норм) повышением щелочной фосфатазы (ЩФ) и реже – повышением общего и конъюгированного билирубина. При этом типе холестаза кожный зуд, как правило, не выражен. В основе развития дуктулярного холестаза лежит нарушение целостности эпителия протоков и их проходимости, нарушение формирования мицелл желчи и изменение состава желчных кислот, приводящие к выраженному кожному зуду, существенному повышению ЩФ (> 3 норм) и ГГТП (> 4 норм) [12, 13]. Важно, что холестаз сам по себе, независимо от выраженности воспалительного процесса, способен индуцировать развитие процессов фиброгенеза в печени [14]. Более того, являясь независимым фактором фиброза и ЦП, холестатический синдром меняет прогноз таких пациентов [15, 16]. Именно поэтому разработанные коэффициенты прогноза пациентов с ХЗП (Maddrey Score, MELD, Глазго) включают показатели холестаза.
Синдром ПКН может проявляться несколько по-разному в зависимости от причины заболевания, однако в целом его клиническая картина типична и не зависит от этиологии. В основе развития ПКН лежит утрата функций клеток печени, что проявляется как клиническими симптомами (слабость, быстрая утомляемость, похудание, желтуха, отеки, геморрагический синдром, гинекомастия, дисменорея, энцефалопатия, инверсия сна), так и изменением лабораторных показателей (гипоальбуминемия, гипопротеинемия, гипохолестеринемия, гипербилирубинемия, снижение активности холинэстеразы и др.). Отдельного внимания заслуживает острая фульминантная (быстропрогрессирующая) печеночная недостаточность, лечение которой необходимо проводить в условиях реанимации и интенсивной терапии [10, 17].
Кроме вышеперечисленных, как отдельный вид поражения печени можно рассматривать ее стеатоз, который сам по себе через стимуляцию перекисного окисления липидов (ПОЛ) и развитие оксидативного стресса способен приводить к воспалению (стеатогепатиту с проявлениями цитолитического синдрома) и активации процессов фиброгенеза [18].
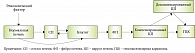
При всем разнообразии патогенетических синдромов большинство ХЗП прогрессируют по «универсальным» стадиям, проходя вначале этап повреждения, с или без синдрома холестаза, вызванного воздействием этиологического фактора, с последующим прогрессированием мезенхимально-воспалительной стадии и стадией фиброзных изменений с исходом в ЦП с последующей ПКН (рис. 1) [19].
Если не брать в расчет острую ПКН, то долгосрочный прогноз и выживаемость пациентов с ХЗП определены выраженностью фиброза в этом органе. По данным систематического обзора и метаанализа пяти когортных исследований, включавших 1495 пациентов с НЖБП с максимальным сроком наблюдения до 28,5 года, наличие продвинутого фиброза (третьей стадии) увеличивает риск смерти от заболевания печени в 16,7 раза, а риск смерти от любых причин – в 3,5 раза (рис. 2) [20].
Исходя из универсальности этапных изменений в печени, которые независимо от этиологического фактора или действия основного патогенетического синдрома характеризуются прогрессированием фиброза органа, подразумевается вывод, что стадия заболевания определена стадией фиброза органа. Поэтому основой базисной терапии при любом ХЗП независимо от этиологии является воздействие на стадию фиброзных изменений в печени.
Вариант модифицированного подхода к терапии холестаза при заболеваниях печени
В соответствии с описанным выше подходом новый принцип терапии холестаза при ХЗП можно разделить на три этапа: первый (инициальный) – воздействие на причины и механизмы развития холестаза, второй (базисный) – лечение и профилактика развития фиброза печени и третий (поддерживающий) – восстановление функций гепатоцитов при их повреждении желчными кислотами. Причины развития внутрипеченочного холестаза были подробно изложены в клинических рекомендациях EASL (European Association for the Study of the Liver) в 2009 г. (табл. 3). Однако в выборе антихолестатического препарата следует руководствоваться не столько нозологией ХЗП, сколько точкой приложения ЛС, а именно его воздействием на паренхиматозно-каналикулярный или дуктулярный холестаз [21].
Модифицированный подход к терапии хронических вирусных гепатитов
Исходя из предложенного инновационного подхода, лечение хронических вирусных гепатитов В и С также можно разделить на аналогичные этапы терапии. На первом (инициальном) осуществляется подготовка к противовирусной терапии в виде купирования синдромов цитолиза, холестаза, ПКН с последующим проведением этиотропной, элиминационной терапии. После чего (или вместо нее при невозможности элиминации этиологического фактора) осуществляется базисный этап (лечение и профилактика прогрессирования фиброза печени). Завершающим моментом лечения является поддерживающая терапия, направленная на преодоление побочных эффектов противовирусной терапии и купирование имеющихся синдромов повреждения печени.
Модифицированный подход к терапии НЖБП и АБП
Лечение жировой болезни печени (как алкогольной, так и неалкогольной) в свою очередь также подразумевает применение указанных этапов, а именно подготовительного (синдромального), базисного (антифибротического) и поддерживающего. На заключительном этапе лечение направлено на коррекцию ассоциированных клинических состояний (например, нарушений углеводного обмена и дислипидемии).
Роль гепатопротекторов в терапии ХЗП
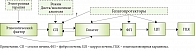
В связи с вышеизложенным точкой приложения гепатопротекторов в терапии ХЗП может являться воздействие на морфо-лабораторные синдромы: цитолитический, холестатический, мезенхимально-воспалительный и другие и, соответственно, на стадию заболевания – печеночный фиброз (рис. 3) [8–10, 12, 13, 19, 22].
При этом используемые гепатопротекторы обладают, как правило, разной эффективностью в отношении повреждения печени, имея различные преимущества в рамках того или иного механизма действия (табл. 4). В реальной клинической практике в России для коррекции холестатического синдрома доступны к применению и наиболее эффективны препараты УДХК (урсодезоксихолевая кислота) и адеметионина, для цитолитического синдрома – ГК (глицирризиновая кислота) и ЭФЛ (эссенциальные фосфолипиды). Наиболее значимым доказанным антифибротическим эффектом из доступных в России ЛС обладает ГК.
Принцип выбора гепатопротектора для коррекции холестатического синдрома
УДХК – это единственное ЛС, способное воздействовать на оба вида внутрипеченочного холестаза: паренхиматозно-каналикулярный и дуктулярный. Антихолестатический эффект реализуется путем активации кальций-зависимой альфа-протеинкиназы и стимуляции экзоцитоза в гепатоцитах, что приводит к уменьшению концентрации токсичных для клетки печени желчных кислот, а также вследствие индукции богатого бикарбонатами холереза, приводящего к увеличению пассажа желчи и выведению желчных кислот через кишечник. В отношении пациентов с первичным билиарным холангитом УДХК продемонстрировала не только антихолестатический, но и значимый антифибротический эффект, способствующий замедлению прогрессирования заболевания до тяжелого фиброза и цирроза и увеличению выживаемости и, соответственно, снижению потребности в трансплантации печени [23].
Адеметионин участвует в трех наиболее важных метаболических процессах: трансметилировании, транссульфировании и аминопропилировании. В этих реакциях адеметионин выступает либо как донатор метильной группы, либо как индуктор ферментов. Основной точкой его приложения является внутрипеченочный, а точнее – паренхиматозно-каналикулярный холестаз, который разрешается благодаря повышению подвижности и поляризации мембран гепатоцитов и, как следствие, улучшению функции ассоциированных с мембранами гепатоцитов транспортных систем желчных кислот, что в конечном счете приводит к увеличению выделения токсичных желчных кислот в желчевыводящую систему. Тем не менее в некоторых исследованиях сообщается о меньшей антихолестатической активности адеметионина в сравнении с УДХК, а также меньшей его эффективности при ЦП [24–26].
Принцип выбора гепатопротектора для коррекции цитолитического и мезенхимально-воспалительного синдромов
Помимо антихолестатического, и УДХК, и адеметионин в ряде работ продемонстрировали цитопротективное действие, при этом в исследовании на беременных женщинах УДХК оказалась более эффективной. Стоит отметить, что антицитолитический эффект УДХК и адеметионина следует рассматривать в большей мере как вторичный по отношению к коррекции обмена желчных кислот [25–29].
ЭФЛ. Применение ЭФЛ в ряде исследований способствовало статистически значимому снижению показателей трансаминаз, а также улучшению ультразвуковой картины (уменьшению выраженности стеатоза и жесткости печени). Тем не менее при отмене приема препарата в большинстве случаев наблюдался рецидив лабораторно-инструментальных проявлений заболевания [30–32].
ЭФЛ + ГК. Оценка эффективности различных ЛС на экспериментальной модели токсического гепатита показала увеличение выживаемости крыс при введении смертельной дозы четыреххлористого углерода в 1,6 раза (с 50 до 80%) для ЭФЛ, в 1,4 раза (с 50 до 70%) для ГК и в 1,8 раза (с 50 до 90%) для комбинации ЭФЛ + ГК. По результатам биохимического анализа крови ЭФЛ также продемонстрировали выраженное гепатопротективное действие, особенно в комбинации с ГК – наилучший результат среди исследуемых соединений. По итогам работы был сделан вывод, что комбинация ЭФЛ и ГК (Фосфоглив) обладает существенно более значимой гепатопротективной активностью в сравнении с эффективностью компонентов этой комбинации, примененных по отдельности [33].
УДХК + ГК. Рациональность комбинации УДХК и ГК в одной лекарственной форме связана с механизмом действия последней, предполагаемым синергизмом двух действующих веществ и возможным дополнительным влиянием на моторику желчевыводящих путей [34]. Наличие синергетического потенциала у данной комбинации обусловлено тем, что оба действующих вещества являются индукторами CYP3A4. Также результаты экспериментальных работ продемонстрировали способность ГК участвовать в регуляции транспорта желчных кислот и оттока желчи через сиртуин – Sirt1-зависимые сигнальные пути, способствуя таким образом усилению эффектов УДХК [34].
Отдельное место занимают инфузионные препараты, такие как Ремаксол и метадоксин. Оба препарата демонстрируют антицитолитическое и антихолестатическое действие: Ремаксол – в исследованиях на пациентах с ВГС, лекарственными поражениями печени и АБП, а метадоксин – преимущественно у пациентов с АБП в комбинации с пероральным применением [19].
Принцип выбора гепатопротектора для базисной антифибротической терапии
В исследовании о применении УДХК у пациентов с первичным билиарным холангитом было показано, что она способна задерживать прогрессирование фиброза, стабилизирует портальное давление и таким образом замедляет развитие варикозного расширения вен и клинической декомпенсации. Эффекты УДХК на фиброз и ЦП при других холестатических ХЗП показали гетерогенные результаты, а при нехолестатических – лишь ограниченные клинические преимущества [35]. Опубликованы работы, описывающие способность УДХК подавлять активность звездчатых клеток печени, уменьшая выработку ими коллагена [36], и ингибировать каспазы и собственно сам апоптоз, что в совокупности приводит к угнетению процессов формирования фиброзной ткани [37]. Тем не менее прямой механизм, участвующий в ингибировании фиброгенеза, до конца не ясен и данные о нем крайне ограничены. В настоящее время нет достаточных доказательств в поддержку использования УДХК при нехолестатических ХЗП, что обуславливает необходимость дальнейших исследований с длительным применением УДХК у таких пациентов [35].
ЭФЛ продемонстрировали умеренный антифибротический эффект в экспериментах на животных или in vitro [38, 39], тем не менее благодаря антиоксидантному и антифибротическому действию они включены в клинические рекомендации некоторых стран по лечению НЖБП [40].
Препараты силимарина (смесь алкалоидов биофлавоноидов семян пятнистой расторопши, наиболее активным компонентом которой является силибинин) в исследованиях in vitro и in vivo на животных продемонстрировали способность не только предотвращать возникновение и прогрессирование фиброза, но и содействовать обратному его развитию. Результатом применения силимарина у пациентов с ЦП в исходе АБП стало достоверное увеличение четырехлетней выживаемости в сравнении с группой плацебо. В исследовании, включавшем практически тысячу пациентов с различными ХЗП, 12-недельный курс силимарина приводил к нормализации N-терминального пептида проколлагена третьего типа (один из маркеров, отражающих активность фиброгенеза) у 47% пациентов со стеатозом печени, у 41% – со стеатогепатитом и у 26% – с ЦП через три месяца лечения. Наиболее эффективной с антифибротической точки зрения оказалась парентеральная форма силимарина, которая не зарегистрирована в Российской Федерации [41, 42].
Наиболее достоверная доказательная база антифибротического действия на настоящий момент имеется у ГК. Систематический обзор и метаанализ 2022 г. показал, что ГК способна вызывать регрессию печеночного фиброза путем подавления активации звездчатых клеток и ингибирования сигнального пути TGF-β1 (transforming growth factor beta 1 – трансформирующий фактор роста бета 1). В одной из работ, включенных в обзор, было описано положительное влияние экстракта корней солодки (в состав которого входит в том числе и ГК) на клетки ГЦК в виде индукции их апоптоза и остановки клеточного цикла [43].
Так же как и УДХК, ГК способна блокировать некроз и апоптоз гепатоцитов вследствие супрессии фактора некроза опухоли альфа и каспазы-3, обладая при этом мембраностабилизирующим, противовоспалительным и иммуномодулирующим свойствами, что косвенным образом воздействует и на фиброз печени [34].
В России в настоящее время ГК в лечении ХЗП применяется только в виде комбинированных препаратов: ЭФЛ + ГК (препараты Фосфоглив и Фосфоглив Форте), УДХК + ГК (Фосфоглив УРСО). Ниже представлена доказательная база по применению данных комбинаций в клинической практике.
Комбинированные препараты с ГК в терапии ХЗП
В двойном слепом рандомизированном плацебо-контролируемом многоцентровом клиническом исследовании «Гепард» оценивали эффективность и безопасность препарата Фосфоглив в терапии пациентов с жировой дегенерацией печени неалкогольной этиологии. В исследование вошли 180 пациентов с НЖБП: 120 из них получали Фосфоглив лиофилизат по 20 мл внутривенно три раза в неделю в течение двух недель, затем по две капсулы Фосфоглив три раза в сутки в течение еще 10 недель (суммарно 12-недельный курс). Контрольная группа из 60 человек получала плацебо в аналогичном режиме. По результатам исследования среднее значение индекса фиброза NAFLD fibrosis score в основной группе, получавшей Фосфоглив, осталось практически без изменений, между тем в контрольной группе отмечалась его статистически значимая отрицательная динамика. Также через 12 недель у пациентов с более выраженным цитолизом (активность АЛТ – три нормы и выше) частота положительной динамики уровня адипонектина на фоне приема Фосфоглива составила 57,9%, в то время как на фоне терапии плацебо – только 10,0%, что рассматривалось косвенным свидетельством положительного влияния препарата Фосфоглив на активность стеатогепатита. Кроме того, после завершения полного курса лечения пациенты основной группы отмечали более выраженное улучшение общего самочувствия, а статистически значимых различий в частоте возникновения нежелательных явлений между группами зафиксировано не было. Таким образом, в результате исследования авторы пришли к выводу, что препарат Фосфоглив в терапии НЖБП приводит к уменьшению активности стеатогепатита, замедляет прогрессирование фиброза, улучшает прогноз заболевания, а также способен обеспечить высокую удовлетворенность пациентов лечением при благоприятном профиле безопасности препарата [44].
В исследовании «Ягуар» (двойное слепое, рандомизированное, плацебо-контролируемое, многоцентровое пострегистрационное клиническое исследование) оценивали эффективность препарата Фосфоглив у лиц с АБП. Всего в исследовании приняли участие 120 пациентов, по 60 человек в основной и контрольной группах. Режим дозирования препарата соответствовал таковому в исследовании «Гепард» за тем исключением, что обеим группам было проведено два цикла терапии (суммарно 24-недельный курс). Через 24 недели в группе, получавшей Фосфоглив, наблюдалось достоверное улучшение динамики АЛТ, АСТ, ГГТП, шкал ActiTest и ФиброТест, в сравнении с группой, получавшей плацебо. Профиль безопасности в двух группах был сопоставим, а данные опросника SF-36 показали достоверно более выраженную положительную динамику по шкалам, характеризующим жизненную активность и социальное функционирование. Таким образом, в качестве ожидаемых эффектов препарата Фосфоглив в терапии АБП следует рассматривать уменьшение активности воспаления в печени, холестаза, а при более длительных сроках наблюдения – уменьшение выраженности фиброза, улучшение качества жизни и снижение тяги к алкоголю [45].
В этой связи целесообразно предположить, что комбинация ГК и УДХК вследствие дополнительного антихолестатического эффекта способна оказывать большую гепатопротективную эффективность, воздействуя на все патогенетические пути прогрессирования ХЗП. Данные об эффективности комбинации УДХК с ГК представлены в табл. 5. Важно отметить, что комбинация ГК и УДХК (Фосфоглив УРСО) по результатам клинического исследования первой фазы продемонстрировала свою биоэквивалентность по УДХК референтному препарату [46].
Заключение
Таким образом, вне зависимости от этиологии заболевания и доминирующего в клинической картине морфо-лабораторного синдрома, терапию ХЗП принципиально можно разделить на три этапа. Первый – инициальный или синдромальный, подразумевает подготовку к базисной терапии. На данном этапе лечение направлено на этиологический фактор и имеющиеся синдромы поражения печени. Поскольку холестаз оказывает наибольшее влияние на прогноз ХЗП через прогрессирование фиброза, синдромальное лечение следует начинать именно с коррекции холестатических изменений при их наличии. Второй этап – базисный. Его основной целью является предотвращение прогрессирования фиброза и развития ЦП и, как следствие, снижение рисков возникновения гепатоцеллюлярной карциномы (ГЦК). Третий этап – поддерживающий – нацелен на терапию ассоциированных клинических состояний и/или коррекцию имеющихся синдромов повреждения печени [19].
Комбинация и ЭФЛ, и УДХК с ГК приводит к взаимному потенциированию их цитопротективного и антихолестатического действия, дополняя их существенным антифибротическим эффектом, что позволяет рассматривать данные комбинации в качестве универсальных гепатопротекторов, применимых на всех этапах лечения ХЗП. Курсовой прием препаратов Фосфоглив, Фосфоглив Форте длительностью три – шесть месяцев позволяет достичь необходимого терапевтического эффекта в терапии самых распространенных ХЗП (НЖБП, ВГС, АБП), что подтверждено данными рандомизированных клинических исследований. Доказано, что комбинации ЭФЛ + ГК (Фосфоглив и Фосфоглив Форте) и УДХК + ГК (Фосфоглив УРСО) обладают благоприятным профилем безопасности, сопоставимым с плацебо.
При наличии холестатического синдрома, определяющего дальнейший прогноз пациента, в качестве препарата выбора следует рассматривать Фосфоглив УРСО, поскольку УДХК, входящая в его состав, обладает максимальной активностью в отношении холестаза. Очевидным преимуществом комбинации ЭФЛ с ГК (Фосфоглив) является наличие парентеральной формы препарата, которую можно использовать на инициальном этапе терапии с последующим переходом на пероральную форму Фосфоглива или Фосфоглива УРСО.
S.N. Mekhtiev, PhD, Prof., O.A. Mekhtieva, PhD, O.M. Berko
Pavlov University, St. Petersburg
Gastroenterological Center "Expert", St. Petersburg
Contact person: Sabir N. Mehdiyev, sabirm@mail.ru
The modern pharmacological industry provides healthcare professionals and patients with the widest choice of medicines (drugs) and biologically active additives. At the same time, the choice of the drug, in addition to the instructions for use and clinical recommendations, is influenced by personal experience of use (both the doctor and the patient), the cost of the drug, advertising and other factors. The Register of Medicines of Russia contains about 30 hepatoprotectors and their combinations, represented by more than 130 original drugs and their generics. This article presents data on the epidemiology of liver diseases in the world and in Russia, the general stages of the pathogenesis of liver lesions and the key points of application of drugs, as well as the role of a new hepatoprotector (a combination of ursodeoxycholic acid with glycyrrhizic acid) in the treatment of liver diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.