Лекарственные поражения печени как осложнение терапии гестагенами при невынашивании беременности
- Аннотация
- Статья
- Ссылки
- English
Введение
Отклонения печеночных проб регистрируются у 3–5% беременных женщин [1]. Одни практические врачи, редко контактирующие с беременными, считают это физиологическими вариациями при нормальной беременности, другие – проявлениями дискинезии желчевыводящих путей (ДЖВП). Ряд клиницистов относят увеличение активности трансаминаз к бессимптомному проявлению внутрипеченочного холестаза беременных (ВХБ) или неалкогольной жировой болезни печени [2]. Однако при росте показателей функции печени редко учитывается гепатотоксический эффект лекарственных средств (ЛС). Между тем повышение уровня трансаминаз часто является признаком гепатоцеллюлярного повреждения печени [3].
Наш клинический опыт показывает, что в настоящее время лекарственные поражения печени (ЛПП) следуют по частоте за ВХБ как причина кожного зуда и ухудшения печеночных проб. Многие ЛС, рутинно применяемые у беременных, могут вызвать ЛПП, начиная с редкого подъема активности трансаминаз и заканчивая тяжелым аутоиммунным процессом с летальным исходом. Это, например, метилдопа, метопролол, амоксициллина клавуланат, джозамицин, нитрофурантоин, гестагены, гепарины, ацетилсалициловая кислота, ацетаминофен, антимикотики, противоэпилептические и антиретровирусные препараты. Беременность является фактором риска развития ЛПП, так как метаболизм ЛС в печени при гестации изменяется. Потенциально гепатотоксичные препараты применяются в акушерстве согласно оценке «польза/риск». Полипрагмазия способствует росту лекарственно-индуцированных гепатитов, но их диагностируют неоправданно мало [3, 4]. Не разработаны клинические рекомендации по ведению беременных с ЛПП.
Накоплению данных по ЛПП препятствует их редкая регистрация в разделе «Мониторинг эффективности и безопасности лекарственных препаратов» сайта Росздравнадзора. При развитии осложнений фармакотерапии необходимо заполнить «Извещение о нежелательной реакции или отсутствии терапевтического эффекта лекарственного препарата» и отправить онлайн на сайт npr.roszdravnadzor.ru. Рост ЛПП во многом связан с массовым применением гестагенов при невынашивании и использованием вспомогательных репродуктивных технологий [5, 6]. Их потенциальная гепатотоксичность маркирована в официальных инструкциях, а применение прогестерона при беременности рекомендуется только при установленной недостаточности гормонов желтого тела [7]. Тем не менее гестагены часто назначают при неопределенных болях в животе, воспринимаемых некоторыми акушерами-гинекологами a priori как угроза выкидыша.
Клиническое наблюдение
Пациентка М., 29 лет, поступила в Перинатальный центр ОГБУЗ «Клиническая больница № 1» г. Смоленска 11.11.2019 с диагнозом: «беременность 27–28 недель. Угрожающие преждевременные роды. Осложненный акушерско-гинекологический анамнез (привычное невынашивание: две замершие беременности, два самопроизвольных выкидыша). Осложненный соматический анамнез (ДЖВП)». Предъявляла жалобы на умеренный зуд кожи ладоней, живота, нижних конечностей в течение месяца, горечь во рту, периодические тупые боли в эпигастрии после еды, снижение аппетита, утомляемость.
Анамнез
В связи с невынашиванием женщина прошла иммунологическое и генетическое тестирование, в заключении от 17.10.2017 указано: «Исключены тромбофилия, первичный и вторичный АФС, с вероятностью 80% – аутоиммунные поражения печени, первичный билиарный холангит». При госпитализации в 7–8 недель по поводу угрозы выкидыша назначен дидрогестерон по 20 мг/сут per os. При второй госпитализации в 10–11 недель с тем же диагнозом зафиксирован подъем АЛТ и АСТ (таблица). УЗИ органов брюшной полости от 11.07.2019: желчный пузырь с тенденцией к увеличению – 94 × 28 мм, в полости билиарный сладж. Заключение: косвенные признаки ДЖВП по гипотоническому типу. Терапевт диагностировала ДЖВП и назначила экстракт артишока. С 13.10.2019 дидрогестерон заменен на микронизированный прогестерон 400 мг/сут интравагинально.
Результаты обследования
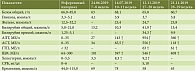
В общеклиническом анализе крови от 11.11.2019 выявлено снижение количества эритроцитов – 2,89 × 1012/л, гемоглобина – 100 г/л и двукратный рост СОЭ с 31 до 62 мм/ч по сравнению с уровнем в 10–11 недель, что не исключало его патологического происхождения. Повышение СОЭ достоверно в третьем триместре только при значении 70 мм/ч и более, так как относительно увеличивается концентрация глобулинов в крови [1]. Как видно из таблицы, через три недели после начала приема дидрогестерона выросли печеночные пробы, а после перевода на прогестерон произошел резкий скачок активности трансаминаз, трехкратное повышение уровня холестерина и умеренное – щелочной фосфатазы (ЩФ) и билирубина за счет конъюгированного. Зафиксирована также высокая активность ГТП.
Повышение активности ЩФ характерно для беременности, она увеличивается до двух раз, достигая максимума в третьем триместре, за счет продукции плацентарной фракции [1, 2]. Гиперхолестеринемия постепенно развивается в гестационном периоде в связи с интенсификацией липидного обмена и утилизацией холестерина и необходима для синтеза стероидных гормонов и кальцитриола [1]. Однако их быстрый рост, соизмеримый с подъемом АЛТ и АСТ, свидетельствовал о наличии изменений со стороны печени, так как произошел в течение трех недель первого триместра, что невозможно в физиологических условиях. В общем анализе мочи обнаружен билирубин (1 мг/дл). Маркеры вирусных гепатитов были отрицательны, показатель МНО был в пределах нормы: 0,94–1,0 (норма 0,84–1,26). Уровень желчных кислот в крови был повышен – 22,6 мкмоль/л (норма менее 10). Таким образом, у пациентки имелись признаки острого, прогрессирующего поражения печени.
УЗИ органов брюшной полости: желчный пузырь увеличен – длинник 98 мм, поперечник 29 мм, в полости подвижные сгустки повышенной эхогенности – замазкообразная желчь. Заключение: признаки ДЖВП по гипотоническому типу. Желчный сладж. Скрининговое УЗИ: беременность 27–28 недель, головное предлежание. Кровоток не нарушен. Предполагаемая масса плода – 1080 г. Шейка матки – 40 мм, зев закрыт.
При госпитализации назначены дексаметазон 8 мг № 3 в/м в течение суток, магнезиальная терапия, продолжала получать микронизированный прогестерон 400 мг/сут.
В результате осмотра терапевта поставлен диагноз: «дискинезия желчевыводящих путей. Внутрипеченочный холестаз беременных (?). Анемия I степени. Хронический гастрит, ремиссия». Назначены экстракт артишока, железа сульфат.
Еще на амбулаторном этапе терапевтом была допущена типичная ошибка – установлен ложный диагноз ДЖВП, основанный на низкопрофессиональном уровне абдоминальной сонографии, неквалифицированной интерпретации УЗИ и отклонений печеночных проб [8, 9], который был продублирован при последующих госпитализациях. Мы присоединяемся к существующей точке зрения о том, что врач ультразвуковой диагностики не должен указывать заболевание в заключении, навязывая клиницисту свое мнение. Наличие желчного сладжа и повышение уровня АЛТ и АСТ, напротив, исключает диагноз функциональной ДЖВП [8, 9]. Увеличение размеров желчного пузыря, выявляемое у большой части беременных, – физиологическая норма. Желчный сладж у беременных нестоек и чаще всего исчезает после родов. Его формированию способствуют гипотонус желчного пузыря и изменение химизма желчи при гестации. В описанном случае желчный сладж был также следствием холестаза, гиперхолестеринемии и мог привести к раннему развитию желчнокаменной болезни (ЖКБ). Экстракт артишока – желчегонное ЛС, которое не эффективно и даже противопоказано при острых поражениях печени [7]. Он не относится к препаратам доказательной медицины, отсутствует в клинических протоколах по заболеваниям печени. Как показывает наш опыт, экстракт артишока часто неправомочно назначается беременным при физиологической гипотонии желчного пузыря, подъеме трансаминаз и даже клинически выраженном синдроме холестаза с кожным зудом.
В результате консультации доцента объективно: склеры иктеричны. Живот при пальпации мягкий, чувствительный в эпигастрии. Заключение: острый лекарственный гепатит, индуцированный гестагенами, средней тяжести. Диагноз поставлен на основании наличия факторов риска ЛПП (женский пол, беременность, потенциальная гепатотоксичность гестагенов), анамнеза (повышение уровня трансаминаз через три недели от начала приема дидрогестерона, появление кожного зуда, диспепсического и астенического синдромов с отрицательной лабораторной динамикой на фоне терапии прогестероном). Рекомендовано: диета, уменьшение лекарственной нагрузки на печень – отменить микронизированный прогестерон, экстракт артишока, поливитамины. Назначить урсодезоксихолевую кислоту (УДХК) 1500 мг/сут.
Пренатальный консилиум отменил прогестерон с учетом развития ЛПП, срока 27–28 недель, данных скринингового УЗИ. Через 7–9 дней у больной улучшился аппетит, исчезла горечь во рту, купировался кожный зуд. Выписана 22.11.2019 с положительной лабораторной динамикой. Рекомендовано: наблюдение терапевта, диета, прием УДХК с постепенным снижением дозы под контролем печеночных проб. УДХК отменена в 32–33 недели при нормализации печеночных проб. Далее беременность и роды протекали без особенностей.
Анализ ЛПП по шкале RUCAM, 2016 и критериям EASL, 2019
Причинно-следственные связи, подтверждающие достоверность ЛПП, оценивали у пациентки согласно диагностическому алгоритму RUCAM, 2016 г. [10]. Вероятность ЛПП по шкале RUCAM составила семь баллов (вероятно, при шести-восьми). Гепатоцеллюлярный тип повреждения определен у нее по кратностям максимальных уровней АЛТ и ЩФ к верхним пределам их норм (см. в таблице верхние пределы референсных интервалов): АЛТ/ВПН = 27,2 (954/35) – более пяти норм; ЩФ/ВПН = 1,82 (546/300) – менее двух норм. ЛПП расценено как острое, так как срок его развития был менее чем через три месяца от начала приема дидрогестерона. Вычислен показатель R – соотношение активности ферментов, то есть кратностей АЛТ/ВПН к ЩФ/ВПН, который составил 14,9 (27,2/1,82). Показатель R был значительно выше пяти, что подтверждало гепатоцеллюлярный тип поражения печени даже при умеренном росте ЩФ за счет плацентарной фракции [3, 4]. По нашему мнению, для определения типа ЛПП у беременных более корректно опираться на отношение АЛТ/ВПН и значение R, нежели на кратность ЩФ/ВПН, так как последний показатель не совсем достоверен с учетом физиологического увеличения активности ЩФ при гестации [1]. Умеренная степень тяжести обоснована появлением у пациентки симптоматики, превышением уровней АЛТ и билирубина в два и более раз от верхних пределов норм [3, 4].
Обсуждение
В гестационном периоде различают две группы поражений печени. Первая – связанные с беременностью и генетической предрасположенностью: при неукротимой рвоте беременной, ВХБ, HELLP-синдроме, острой жировой дистрофии печени (ОЖДП) [11, 12]. Вторая – не связанные с беременностью заболевания различного генеза: вирусные гепатиты, алкогольный и неалкогольный стеатогепатит и цирроз, аутоиммунные (аутоиммунный гепатит, первичный склерозирующий холангит, первичный билиарный холангит), билиарная обструкция и прочие болезни, редкие при гестации [4, 11–13]. Поражение, развившееся во второй половине беременности, предварительно трактуется как обусловленное ею. Дифференциальный диагноз ЛПП проводится с ВХБ и иными болезнями, протекающими с синдромом холестаза. При HELLP-синдроме и ОЖДП он отсутствует. Отличиями ЛПП от ВХБ в данном случае являются лекарственный анамнез, раннее повышение активности трансаминаз, развитие у пациентки диспепсического и астенического синдромов, отсутствие рецидива после отмены УДХК. Возможно спонтанное купирование легкого поражения при отмене гепатотоксического ЛС. Для ВХБ типично низкое качество жизни за счет мучительного зуда при удовлетворительном состоянии, исчезновение клинико-лабораторных признаков после родов в течение трех-четырех недель без лечения [11–13].
Помимо проведенных у больной исследований для дифференциальной диагностики могут быть необходимы также анализ белковых фракций, развернутая коагулограмма. МРТ без введения контраста и ФГДС назначают со второго триместра при спорных результатах абдоминального УЗИ, тяжелом холестазе и прогрессирующей желтухе, которые могут скрывать за собой редкие у беременных заболевания: опухоли печени и поджелудочной железы, печеночные метастазы, холангиокарциному, цирроз и саркоидоз печени, псевдотуморозный панкреатит, синдром Бадда – Киари [13]. В неясных случаях возможна низкодозовая КТ [13], в послеродовом периоде – поиск генетических мутаций для исключения наследственных поражений печени [14, 15].
С современных позиций, основанных на изучении генома человека, предполагается, что значительная часть случаев ЛПП и ВХБ относится к внутрипеченочному семейному холестазу (ВСХ). ВСХ – группа заболеваний с аутосомно-рецессивным наследованием, приводящих к гиперпродукции желчных кислот. Установлено три генетических типа ВСХ: I, II, III, вызванных, соответственно, мутациями в генах ATP8B1, ABCB11, ABCB4. Тяжелые формы ВСХ приводят к формированию цирроза печени в раннем детстве, создают высокий риск развития гепатоцеллюлярной карциномы. Мутация гена ABCB4 в хромосоме 7, кодирующего белок MDR3, ведет к дефектам транспортных белков печени, синтеза билиарных фосфолипидов, метаболизма прогестерона и гиперпродукции желчных кислот. В результате развивается синдром гепатоцеллюлярного холестаза или наследственная ЖКБ с ранним дебютом. ВХБ и лекарственный холестаз являются поздними вариантами ВСХ III типа [13–15]. Мы полагаем, что гестаген-индуцированное ЛПП представляет собой самую мягкую разновидность ВСХ III типа – вторичный, спровоцированный ВХБ, проявляющийся только при воздействии гепатотоксичного ЛС.
Факторами риска развития острого ЛПП у пациентки явились женский пол, беременность, невынашивание, гепатотоксичный потенциал гестагенов и, вероятно, генетические особенности печеночного метаболизма [3, 4, 13]. Повышенная активность ГТП косвенно свидетельствовала о ВСХ III с мутацией гена ABCB4 [13, 14]. К сожалению, возможности и запаса времени на поиск мутации ABCB4 не было. Виновником реализации вероятного генетического дефекта явился дидрогестерон, на что указывает короткий латентный период от его назначения до подъема уровня трансаминаз. Дидрогестерон (категория действия на плод В по FDA) редко вызывает холестатический гепатит. Назначение прогестерона (категория D по Food and Drug Administration, FDA), обладающего прогнозируемой гепатотоксичностью [7], ускорило прогрессирование ЛПП и привело к появлению кожного зуда. На начальном этапе заболевания в ведении больной были допущены лечебно-диагностические ошибки. В результате отмены прогестерона и терапии УДХК были быстро купированы симптомы ЛПП.
Тактика ведения беременных с лекарственно-индуцированным гепатитом заключается, прежде всего, в отмене подозреваемого агента. При легком течении рекомендуется снижение дозы гестагена, если невозможно прекратить прием. В более тяжелых случаях следует рассмотреть вопрос о применении немедикаментозных методов лечения невынашивания.
Лечение
Терапия ЛПП опирается на патогенетическое обоснование в связи с отсутствием серьезной доказательной базы по применению гепатопротекторов при гестации. Типичными ошибками в лечении при жалобах на зуд у беременных являются назначение эссенциальных фосфолипидов, экстракта артишока, антигистаминных препаратов, наружных дерматологических средств. Они неэффективны при холестазе и создают дополнительную лекарственную нагрузку на печень и плод [16]. К гепатопротекторам, регламентированным к применению у беременных клиническими протоколами, относятся УДХК, адеметионин, эссенциальные фосфолипиды, разрешенные со второго триместра в стандартных дозах. УДХК (категория В по классификации FDA) – препарат выбора при синдроме холестаза с множественными лечебными эффектами [17] и наибольшей доказательной базой по эффективности и безопасности [3, 4, 12, 13]. Препаратом резерва является адеметионин (категория A по FDA). Он снижает интенсивность зуда, но меньше влияет на печеночные пробы, применяется при непереносимости УДХК и в комбинации с ней [3, 4, 12, 13]. Адеметионин вначале вводится инфузионно с переходом на прием per os. Эссенциальные фосфолипиды патогенетически обоснованы только при ЛПП с синдромом цитолиза [4]. N-ацетилцистеин (категория В по FDA) имеет доказательную базу при поражении, вызванном ацетаминофеном, и применяется при отдельных типах ЛПП [3, 4, 11, 13]. Для ослабления мучительного зуда кратковременно используется симптоматическая терапия. К ее препаратам с доказанной эффективностью относится колестирамин [3, 4, 7, 16]. В его отсутствие и при проявлениях интоксикации могут назначаться полиметилсилоксана полигидрат [18] и активированный уголь (категория А по FDA) [7, 16]. Энтерсорбенты связывают желчные кислоты в тонкой кишке, но выводят жирорастворимые витамины. При их приеме свыше двух недель и гипопротромбинемии необходимо введение витамина K [7, 16].
Заключение
Гестагениндуцированное ЛПП представляет собой наиболее мягкий вариант ВСХ III типа, который проявляется только при воздействии ЛС и имеет генетическое родство с ВХБ. С учетом возрастающей частоты применения гестагенов данный вариант поражения целесообразно ввести в классификацию болезней печени, связанных с беременностью, как вторичный вариант ВХБ. Характеристики ЛПП необходимо анализировать по критериям EASL и шкале RUCAM, принимая во внимание физиологический рост активности ЩФ при гестации. Из-за потенциальной гепатотоксичности следует назначать беременным гестагены строго по показаниям. При повышении активности трансаминаз нужно рассмотреть вопрос о применении альтернативных методов лечения невынашивания. В связи с ростом частоты лекарственно индуцированных гепатитов при гестации, представляющих собой междисциплинарную проблему, назрела необходимость создания клинических рекомендаций по ЛПП у беременных.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Информация о финансовой поддержке. Исследование не имело финансовой поддержки.
I.A. Argunova, PhD
Smolensk State Medical University
Perinatal Center of the Clinical Hospital № 1, Smolensk
Center of IVF, Smolensk
Contact person: Irina A. Argunova, argunova.irina@mail.ru
An increase of liver function scores may be related to rarely diagnosed drug-induced liver injuries. Their frequency of pregnant women is increasing against the background of therapy of miscarriage with gestagens, which have potential heptotoxicity. The clinical case with the progression of acute hepatitis caused by the use of dydrogesterone and micronized progesterone was analyzed according to the criteria of the European Association for the Study of the Liver and the RUCAM scale, taking into account the physiological growth of alkaline phosphatase activity during gestation. The probability of drug damage to the liver, risk factors, variant, severity were determined. Typical mistakes in diagnosis and treatment are shown, recommendations are given on the use of hepatoprotectors in women with this pathology. An opinion about the genetic relationship of gestagen-induced liver damage and intrahepatic cholestasis of pregnancy and the need to create clinical guidelines for the management of pregnant women with drug-induced liver injuries was expressed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.