Анализ безопасности применения глицирризиновой кислоты у человека
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить безопасность применения отечественных препаратов глицирризиновой кислоты у человека в различных лекарственных формах, при разных путях введения и схемах назначения.
Материал и методы. Проведен обобщенный анализ результатов 21 клинического исследования с целью изучения безопасности применения, в том числе в пострегистрационный период наблюдения (2015–2019), отечественных препаратов глицирризиновой кислоты в пероральной и парентеральной лекарственных формах при различных схемах назначения. Всего в анализ было включено 1 385 316 случаев назначения препаратов. Оцениваемые параметры включали частоту нежелательных явлений и случаи лекарственных взаимодействий, полученные результаты подвергнуты критической оценке с учетом доклинических и клинических данных научной литературы.
Результаты. Установлено, что глицирризиновая кислота является практически безопасным веществом, не обладает острой токсичностью, мутагенным, канцерогенным и тератогенным действием, а также потенциалом для развития лекарственной зависимости. Общая частота нежелательных явлений, включая случаи псевдоальдостеронизма, существенно ниже, чем для зарубежных аналогов, что связано с подобранными дозировкой и схемами назначения, а также широким применением пероральных лекарственных форм.
Заключение. Отечественные препараты с глицирризиновой кислотой характеризуются благоприятным профилем безопасности и соотношением «риск – польза».
Цель – изучить безопасность применения отечественных препаратов глицирризиновой кислоты у человека в различных лекарственных формах, при разных путях введения и схемах назначения.
Материал и методы. Проведен обобщенный анализ результатов 21 клинического исследования с целью изучения безопасности применения, в том числе в пострегистрационный период наблюдения (2015–2019), отечественных препаратов глицирризиновой кислоты в пероральной и парентеральной лекарственных формах при различных схемах назначения. Всего в анализ было включено 1 385 316 случаев назначения препаратов. Оцениваемые параметры включали частоту нежелательных явлений и случаи лекарственных взаимодействий, полученные результаты подвергнуты критической оценке с учетом доклинических и клинических данных научной литературы.
Результаты. Установлено, что глицирризиновая кислота является практически безопасным веществом, не обладает острой токсичностью, мутагенным, канцерогенным и тератогенным действием, а также потенциалом для развития лекарственной зависимости. Общая частота нежелательных явлений, включая случаи псевдоальдостеронизма, существенно ниже, чем для зарубежных аналогов, что связано с подобранными дозировкой и схемами назначения, а также широким применением пероральных лекарственных форм.
Заключение. Отечественные препараты с глицирризиновой кислотой характеризуются благоприятным профилем безопасности и соотношением «риск – польза».



Введение
Обеспечение безопасности лекарственных препаратов для медицинского применения является одной из основных целевых задач Государственной программы Российской Федерации «Развитие медицинской и фармацевтической промышленности», утвержденной постановлением правительства Российской Федерации от 15.04.2014 № 305 (с изм. от 31.03.2021) [1], а также Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года, утвержденной приказом Минздрава России от 13.02.2013 № 66 (ред. от 13.07.2021) «Об утверждении Стратегии лекарственного обеспечения населения Российской Федерации на период до 2025 года и плана ее реализации» [2].
Ввиду того что распространенность хронических заболеваний печени в РФ, особенно неалкогольной жировой болезни печени (НАЖБП), продолжает неуклонно расти [3], а гепатопротекторы назначаются таким пациентам в 93,5% случаев [4], проблема безопасности препаратов этой фармакотерапевтической группы представляется особенно актуальной.
Гепатопротекторы – это чрезвычайно широкая и разнообразная группа лекарственных препаратов, способствующих восстановлению гомеостаза в гепатоцитах, повышению устойчивости печени к влиянию патогенных факторов, нормализации функциональной активности и стимуляции репаративно-регенераторных процессов [5]. Однако, несмотря на достаточно богатую историю медицинского применения, данных по безопасности этих лекарственных средств недостаточно. Предметом дискуссий и многочисленных научных публикаций являются, прежде всего, вопросы их эффективности, оставляя в тени другой, не менее важный аспект рациональной фармакотерапии.
Несомненный интерес представляет безопасность глицирризиновой кислоты (ГК), которая широко применяется в нашей стране с начала 2000-х гг. в комбинации с другими известными гепатопротекторами – эссенциальными фосфолипидами (ЭФ), а с недавнего времени и урсодезоксихолевой кислотой (УДХК) в лекарственных формах для перорального и внутривенного введения.
Цель исследования – изучение безопасности применения отечественных препаратов ГК у человека в различных лекарственных формах, при разных путях введения и схемах назначения.
Материал и методы
Исследование проводили с использованием контент-анализа и аналитического метода. Источниками информации о безопасности фиксированных комбинаций ГК послужили научные публикации, посвященные результатам клинических исследований соответствующих лекарственных препаратов. Обязательным критерием отбора являлось наличие результатов исследования безопасности. Поиск осуществляли в базах elibrary и Cyberleninka по ключевым словам: «глицирризиновая кислота», «безопасность», «побочные действия», которые могли фигурировать в названиях, аннотациях, ключевых словах и полных текстах публикаций. Глубина поиска не была ограничена и в итоге составила 18 лет. Всего было найдено 610 научных публикаций. Результаты клинических исследований фиксированных комбинаций ГК и ЭФ (далее – ГК + ЭФ) или ГК и УДХК (далее – ГК + УДХК) были представлены в 43 статьях, из которых в 21 статье были опубликованы результаты изучения безопасности, что позволило включить их в анализ.
На основании имеющихся данных была проведена оценка безопасности ГК + ЭФ в пероральной лекарственной форме, парентеральной лекарственной форме, комплексной терапии двумя лекарственными формами, а также оценка безопасности ГК + УДХК в пероральной лекарственной форме. Были проанализированы лекарственные взаимодействия ГК + ЭФ. Оценку безопасности осуществляли на основании анализа частот отдельных нежелательных явлений (НЯ) и всей их совокупности в абсолютных и относительных значениях. При этом учитывали показания для назначения; величину выборки пациентов, принимавших исследуемый препарат; средний возраст пациентов; суточную дозу ГК и продолжительность курса терапии. Данные по каждой лекарственной форме, комплексной терапии и по фиксированной комбинации в целом были подвергнуты обобщенному анализу. В рамках оценки лекарственных взаимодействий анализировали характер взаимодействия с другими лекарственными препаратами, с учетом показаний, размера выборки и возраста пациентов, получавших препарат, суточной дозы и пути введения ГК.
Полученные результаты были критически оценены на основании сопоставления с данными по безопасности ГК в пострегистрационном периоде наблюдения, а также представленными в научной литературе. Источником информации о безопасности в пострегистрационном периоде наблюдения послужил периодический отчет по безопасности, сформированный на основании обращений потребителей, медицинских и фармацевтических работников, предоставленный владельцем регистрационного удостоверения. Данные отчета охватывали период времени с 2015 по 2019 г. и основывались на 1 378 486 случаях назначения в реальной клинической практике. Поиск научных статей по теме исследования осуществлялся в базах PubMED и Google Scolair. Всего для анализа было отобрано 42 статьи, содержащие сведения о доклиническом или клиническом изучении безопасности ГК.
Результаты
Из отобранной в соответствии с заданными критериями 21 публикации ГК + ЭФ были посвящены 19, ГК + УДХК – две.
Безопасность ГК + ЭФ в пероральной лекарственной форме
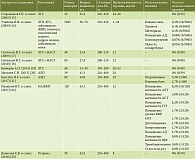
Безопасность ГК + ЭФ (35 мг + 65 мг) была изучена в семи клинических исследованиях, включая одно рандомизированное, при назначении по таким показаниям, как псориаз (три исследования), неалкогольный стеатогепатит (НАСГ) (два исследования), хронические гепатиты В (ХГВ) и С (ХГС) (одно исследование) и хронический гепатит D (ХГD) (одно исследование) (табл. 1). Всего исследуемый препарат получили 267 пациентов. В пяти исследованиях принимали участие взрослые пациенты старше 18 лет, в двух – дети 3–15 лет. В пяти исследованиях суточная доза ГК составила 210 мг, в одном исследовании – 52,5–210 мг, в одном исследовании – 70–105 мг. Общая продолжительность терапии варьировала от 4 до 24 недель. Общая частота НЯ составила 4,1% (11/267). Были зарегистрированы такие НЯ, как тошнота (в одном исследовании), диарея (в одном исследовании) и диспепсия (в одном исследовании). В пяти исследованиях НЯ отмечено не было. Обобщенный анализ показал, что частота диареи на фоне назначения препарата составила 2,2% (6/267), диспепсии – 1,9% (5/267), тошноты – 0,4% (1/267).
Безопасность ГК + ЭФ в парентеральной лекарственной форме
Безопасность ГК + ЭФ (200 мг + 500 мг) в парентеральной лекарственной форме для внутривенного введения была изучена в трех клинических исследованиях, включая одно рандомизированное. Препарат назначали при алкогольной болезни печени (АБП), НАСГ и лекарственном поражении печени (ЛПП), ассоциированном с назначением химиотерапии (табл. 2). Всего препарат был назначен 113 взрослым пациентам старше 18 лет. Суточная доза ГК составила 200 или 400 мг. Максимальная общая продолжительность лечения достигала 52 недель, при этом в ежедневном режиме препарат вводили от 10 до 14 дней. Общая частота нежелательных явлений составила 6,2% (7/113). К числу зарегистрированных НЯ относились повышение артериального давления (АД) (два исследования) и кожные реакции (одно исследование). В одном исследовании НЯ зафиксированы не были. Обобщенный анализ показал, что частота повышения АД на фоне введения препарата составила 3,5% (4/113), а кожных реакций – 2,6% (3/113).
Безопасность комплексной терапии ГК + ЭФ в двух лекарственных формах
Безопасность комплексной терапии ГК + ЭФ в парентеральной лекарственной форме для внутривенного введения (200 мг + 500 мг) и пероральной лекарственной форме (35 мг + 65 мг или 65 мг + 300 мг) была изучена в девяти клинических исследованиях, включая четыре рандомизированных, по показаниям: ХГС (пять исследований, в том числе два – в сочетании с НАСГ); АБП (два исследования); НАЖБП (два исследования); псориаз (два исследования); ХГВ, заболевания желчевыводящих путей (ЖВП), токсический гепатит, цирроз печени (одно исследование) (табл. 3). Всего препарат был назначен 6403 взрослым пациентам старше 18 лет. Суточная доза ГК в целом варьировала от 195 до 610 мг; при парентеральном введении – от 200 до 400 мг; при пероральном – от 195 до 210 мг. Продолжительность терапии находилась в диапазоне от одной до 52 недель, где этап внутривенного введения составлял от одной до 24 недель, а перорального – от одной до 44 недель. При этом внутривенное введение подразумевало несколько режимов: ежедневно, два раза в неделю или пять раз в неделю. Были зарегистрированы следующие НЯ: повышение АД (два исследования), гипергликемия (два исследования), кожная сыпь (одно исследование), тошнота (одно исследование), метеоризм (одно исследование), головокружение (одно исследование), тяжесть в подреберье (одно исследование), головная боль (одно исследование), повышение активности аланинаминотрансферазы (АЛТ) (одно исследование), повышение активности аспартатаминотрансферазы (АСТ) (одно исследование), повышение активности гамма-глутамилтранспептидазы (ГГТ) (одно исследование), повышение уровня креатинфосфокиназы (КФК) (одно исследование), острое респираторное заболевание (одно исследование), дислипидемия (одно исследование), повышение активности щелочной фосфатазы (ЩФ) (одно исследование), тромбоцитопения (одно исследование), сухость во рту (одно исследование). В шести исследованиях НЯ зафиксировано не было. Обобщенный анализ показал, что общая частота НЯ составила 1,3% (81/6403). Частота кожной сыпи достигала 0,2% (16/6403), тошноты – 0,1% (8/6403), метеоризма – 0,1% (8/6403), повышения АД – 0,1% (7/6403), головокружения – 0,1% (8/6403), гипергликемии – 0,06% (4/6403), тяжести в подреберье – 0,05% (3/6403), головной боли – 0,01% (1/6403), повышения активности АЛТ – 0,01% (1/6403), повышения активности АСТ – 0,01% (1/6403), повышения активности ГГТ – 0,01% (1/6403), повышения уровня КФК – 0,01% (1/6403), острых респираторных заболеваний (ОРЗ) – 0,01% (1/6403), дислипидемии – 0,01% (1/6403), повышения активности ЩФ – 0,01% (1/6403), тромбоцитопении – 0,01% (1/6403), сухости во рту – 0,01% (1/6403).
Обобщенный анализ безопасности ГК + ЭФ
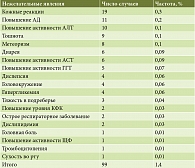
Результаты обобщенного анализа всех НЯ, зарегистрированных на фоне применения ГК + ЭФ, независимо от лекарственной формы и схемы назначения, представлены в табл. 4. В 19 клинических исследованиях фиксированная комбинация была назначена 6783 пациентам. Всего было зарегистрировано 99 НЯ, что составило 1,4% от всех случаев назначения препарата. Основной удельный вес в структуре всех НЯ принадлежал проявлениям диспепсии (30,3%), кожным реакциям (19,2%) и повышению АД (11,1%). Частота некоторых НЯ не превышала 0,3%.
Лекарственные взаимодействия ГК + ЭФ
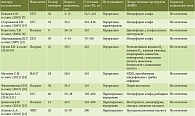
В 10 клинических исследованиях ГК + ЭФ назначали в комбинации с другими лекарственными препаратами (табл. 5). В четырех исследованиях – с интерфероном альфа; в двух – с УДХК, метотрексатом и кальция глюконатом; в одном исследовании – с диклофенаком, сульфасалазином, реополиглюкином, витамином В6, витамином В12, хлоропирамином, клемастином, мебгидролином, салициловой кислотой, мометазоном, фиксированной комбинацией бетаметазона и салициловой кислоты, лактобактериями ацидофильными в комбинации с грибками кефирными, пиритионом цинка, аминофурином, гемодезом. Неблагоприятных лекарственных взаимодействий для представленных схем комплексной терапии описано не было.
Безопасность ГК + УДХК
Безопасность ГК + УДХК (35 мг + 250 мг) в пероральной лекарственной форме была изучена в двух клинических исследованиях при сочетании НАЖБП с функциональными расстройствами желчного пузыря (ФРЖП) и при функциональном билиарном расстройстве сфинктера Одди (ФБРСО) (табл. 6). Всего препарат был назначен 47 взрослым пациентам старше 18 лет. Суточная доза ГК составила 105 мг. Продолжительность терапии варьировала от восьми до 12 недель. Общая частота НЯ составила 10,6%, в структуре которых явления диспепсии имели удельный вес 80,0%, а влияние на сердечно-сосудистую систему – 20,0%. Были зарегистрированы такие НЯ, как горечь во рту (одно исследование), диспепсия (одно исследование), диарея (одно исследование) и повышение АД (одно исследование). Обобщенный анализ показал, что частота диспепсии составила 4,2% (2/47), горечи во рту – 2,1% (1/47), диареи – 2,1% (1/47), повышения АД – 2,1% (1/47).
Обсуждение
ГК является основным активным компонентом корня солодки и обнаружена более чем в 10 видах данного лекарственного растения. По своему химическому строению молекула ГК является водорастворимым тритерпеновым гликозидом, образованным одной молекулой глицирретовой кислоты (ГТ) и двумя молекулами глюкуроновой кислоты [27]. При пероральном введении под влиянием ферментов кишечной микрофлоры ГК гидролизуется до ГТ, которая полностью всасывается. После парентерального введения системный гидролиз ГК до ГТ отсутствует. В крови ГК и ГТ связываются с альбумином плазмы и распределяются в ткани организма. Объем распределения ГК в равновесном состоянии составляет 38–64 мл/кг. Tmax после перорального введения ГК достигает 8–12 часов. В лизосомах печени ГК подвергается гидролизу до моноглюкуронида 18-глицирретиновой кислоты и 18α-глицирретовой кислоты. ГТ, в свою очередь, гидролизуется до глюкуронида и моноглюкуронида 18-глицирретиновой кислоты. Следует отметить, что после поступления в кишечник с желчью часть ГТ и ее метаболитов подвергается обратному всасыванию и включается в процесс энтерогепатической циркуляции. ГТ выводится из организма преимущественно с желчью и только 1% – с мочой. Плазменный клиренс ГК составляет 25 мл/ч/кг. При повторном введении она способна к кумуляции [28].
В настоящее время препараты для лечения заболеваний печени, включающие ГК, находятся в обращении в Японии и Китае в виде лекарственных форм для парентерального введения (изоглицирризинат магния (Китай), диаммония глицирризинат (Китай), ГК в комбинации с глицином и L-цистеина гидрохлоридом (Япония)) и перорального приема (диаммония глицирризинат (Китай), ГК в комбинации с глицином и L-цистеина гидрохлоридом (Япония)) [29]. При этом более распространено использование лекарственных форм для парентерального введения.
Общая оценка безопасности
В соответствии с результатами доклинических исследований, ГК относится к практически безопасным веществам, так LD50 находится в диапазоне 800–6500 мг/кг [34], что существенно превосходит рекомендованные терапевтические дозы для человека, составляющие при массе тела 70 кг не более 0,175 мг/кг. Доклинические исследования показали низкую острую токсичность ГК и отсутствие у нее канцерогенного действия. Доза для ГК, не оказывающая явного нежелательного действия, была определена на уровне 217 мг в день. Также у ГК отсутствует потенциал для формирования лекарственной зависимости [28].
По совокупности данных, полученных в клинических исследованиях ГК + ЭФ и ГК + УДХК и в ходе пострегистрационного наблюдения, безопасность отечественных препаратов ГК была изучена в общей сложности на основании анализа 1 385 316 случаев назначения.
По результатам проведенных клинических исследований, в которых изучали безопасность фиксированных комбинаций ГК, зарегистрированных в РФ, общая частота НЯ оказалась низкой, составив 1,4% для комбинации с ЭФ и 10,6% – для комбинации с УДХК при суточной дозе ГК от 52,5 мг до 210 мг при пероральном введении и от 200 до 400 мг – при внутривенном введении. Эту разницу между двумя комбинациями можно объяснить статистической погрешностью, обусловленной малым размером выборки во втором случае (менее 50 человек). Низкая общая частота НЯ на фоне применения препаратов ГК + ЭФ находит подтверждение в результатах пострегистрационного изучения безопасности, согласно которым она находилась на уровне 0,01% [30]. Ввиду того что ГК + УДХК зарегистрированы недавно, результаты пострегистрационного изучения ее безопасности еще не получены. В настоящее время проводятся исследования, направленные в том числе на изучение этого параметра. Все это в ближайшее время позволит получить более полную и точную информацию по данной комбинации.
Несмотря на то что литературные данные свидетельствуют о более высокой частоте НЯ на фоне применения ГК [31], это имеет объяснение. Нельзя забывать о том, что индивидуальная чувствительность к ГК крайне вариабельна. В то время как у некоторых пациентов можно ожидать развития НЯ начиная с суточной дозы в 100 мг, а у большинства людей для развития НЯ необходимо регулярное потребление в суточной дозе, превышающей 400 мг [32], в ряде опубликованных работ, где изучали профиль безопасности данного вещества, ГК применяли в дозе от 400 до 9600 мг в сутки [28, 33–35]. В свою очередь, если следовать предписанию инструкций по медицинскому применению лекарственных препаратов ГК, зарегистрированных в РФ, доза вещества, получаемого в сутки, не превышает 400 мг, а зачастую является существенно ниже. Кроме того, нельзя не учитывать тот факт, что за рубежом, в отличие от РФ, препараты ГК назначаются преимущественно парентерально, что не может не отражаться на частоте развития НЯ, ввиду более выраженного системного действия.
Влияние на желудочно-кишечный тракт
Результаты клинических исследований отечественных препаратов ГК продемонстрировали, что основной удельный вес НЯ был связан с нарушениями со стороны желудочно-кишечного тракта – 30,3% от числа всех выявленных побочных эффектов при назначении ГК + ЭФ и 80,0% – ГК + УДХК. Все они носили единичный нетяжелый характер и включали в себя главным образом тошноту, горечь во рту, диарею, метеоризм, тяжесть в подреберье и другие проявления диспепсии. Это соответствует результатам пострегистрационного изучения безопасности ГК + ЭФ, согласно которым 28,3% случаев обращений потребителей по поводу любых побочных эффектов были обусловлены нарушениями со стороны желудочно-кишечного тракта. Спектр зарегистрированных НЯ также был сопоставимым – преимущественно болезненные ощущения в абдоминальной области, горечь во рту, отрыжка, тошнота, рвота, метеоризм [30]. Соответствующая информация отражена в разделе «Побочные действия» инструкций по медицинскому применению российских лекарственных препаратов, включающих ГК в комбинациях [36].
Данные литературы в отношении влияния ГК на желудочно-кишечный тракт в целом соответствуют результатам изучения безопасности, представленным в работах, включенных в анализ. К описанным НЯ относятся снижение аппетита, абдоминальная боль, тяжесть в подреберье, тошнота, метеоризм, диарея [34, 37–40]. Однако необходимо отметить, что зарегистрированы эти НЯ были в отдельных исследованиях и их удельный вес в структуре всех НЯ, очевидно, значительно ниже, чем для комбинированных препаратов ГК, зарегистрированных в РФ. Хотя точный механизм развития диспепсии на фоне применения ГК не описан, это может быть объяснено тем, что ее влияние на желудочно-кишечный тракт, скорее всего, связано не столько с системным действием, сколько с прямым влиянием на слизистую оболочку. В пользу этой гипотезы свидетельствует то, что за рубежом используются препараты ГК преимущественно в парентеральной лекарственной форме. При этом нельзя не отметить, что это влияние носит умеренный характер, так как ни одного случая эрозивно-язвенных поражений или желудочно-кишечного кровотечения зарегистрировано не было.
Влияние на кожу
Второе место в структуре всех НЯ, описанных в клинических исследованиях отечественных препаратов ГК, заняли нарушения со стороны кожи. Их удельный вес на фоне применения ГК + ЭФ составил 19,2% от всех зарегистрированных побочных эффектов. Это была преимущественно кожная сыпь. В клинических исследованиях ГК + УДХК кожные реакции отмечены не были. По данным изучения безопасности ГК + ЭФ в пострегистрационном периоде, поступление сообщений о НЯ со стороны кожи имело сопоставимый характер (18,9% всех случаев) – высыпания, зуд, сухость, шелушение кожи [30]. Информация о возможности развития кожных реакций отражена в инструкциях по медицинскому применению комбинированных препаратов ГК, зарегистрированных в РФ [36].
По данным литературы, применение ГК редко сопровождалось НЯ со стороны кожи – случаи сыпи были отмечены только в двух работах [41, 42]. Различие с результатами клинических исследований отечественных препаратов ГК можно объяснить, в частности, наличием в их составе ЭФ, которые сами по себе могут вызвать подобные НЯ. Что касается механизма развития этих реакций, они до конца не изучены. Но наиболее вероятна их связь с индивидуальной гиперчувствительностью к компонентам препарата.
Влияние на сердечно-сосудистую систему
Нарушения со стороны сердечно-сосудистой системы в клинических исследованиях ГК + ЭФ составили 11,1%; ГК + УДХК – 20,0% и были представлены только повышением АД. Результаты пострегистрационного изучения безопасности ГК + ЭФ свидетельствуют о том, что сообщения о НЯ со стороны этой системы органов составили 20,5% [30], что в целом соответствует данным, полученным в клинических исследованиях. При этом среди них преобладали случаи повышения АД и периферических отеков. Эта информация нашла полное отражение в соответствующих разделах инструкций по медицинскому применению комбинированных лекарственных препаратов ГК, зарегистрированных в РФ [36].
Однако необходимо отметить тот факт, что именно НЯ ГК со стороны сердечно-сосудистой системы уделено особое внимание. Так, опубликованы работы, где сообщается не только о повышении АД и развитии периферических отеков на фоне введения ГК, но и о нарушениях ритма сердца, изменениях на ЭКГ [28, 31, 39–41, 43–52]. Однако справедливо отметить, что в большинстве исследований были отмечены только периферические отеки и повышение АД, в то время как остальные НЯ носили единичный характер. Несмотря на то что в основном характер НЯ соответствовал отечественным данным, их частота была значительно выше, что может быть связано с рядом факторов. В первую очередь это преимущественно внутривенный способ введения ГК, принятый за рубежом. Так, в восьми из 17 публикаций, где описывали НЯ со стороны сердечно-сосудистой системы, ГК вводили внутривенно [39–42, 47, 48, 53, 54].
Также имеет значение доза ГК. В литературе отмечено, что для повышения АД, нарушений сердечного ритма и развития периферических отеков, как правило, требуется длительный прием ГК в высоких дозах. В частности, указан срок более двух недель в суточной дозе 1500 мг или несколько месяцев в суточной дозе 700 мг [27, 28, 55, 56]. Это значительно выше, чем суточные дозы отечественных препаратов ГК, независимо от лекарственной формы (максимальная суточная доза не превышает 400 мг). Что касается внутривенного введения этих препаратов, когда пациент получает ГК в самой высокой дозе, продолжительность лечения не превышает 10 дней. В свою очередь, в трех из 13 опубликованных работ применение ГК было перорально совместно с внутривенным введением в суточной дозе более 400 мг [28]; в восьми из девяти – вводили внутривенно в течение срока, превышающего 10 дней [39–42, 47, 48, 53, 54].
Необходимо отметить, что НЯ со стороны сердечно-сосудистой системы чаще развиваются у восприимчивых категорий пациентов. К ним относятся лица пожилого возраста; пациенты, имеющие сопутствующие заболевания сердца, почек; женщины в предменструальном периоде; пациенты с нервной анорексией [28, 55–60]. Что касается того, является ли имеющаяся у пациента артериальная гипертензия (АГ) фактором риска повышения АД на фоне терапии ГК, данный вопрос остается открытым. Так, в одном из исследований после введения ГК соотношение «кортизол – кортизон» в моче у двух групп пациентов – с АГ и без – статистически значимых различий не имело [49]. Но даже при повышении АД на фоне введения ГК оно самостоятельно возвращается к норме в течение трех-четырех недель после ее отмены [28, 32, 55]. Также есть сообщения о возможности контроля АД на фоне приема ГК обычными гипотензивными средствами [47].
Механизм нарушений со стороны сердечно-сосудистой системы на фоне введения ГК обусловлен псевдоальдостеронизмом. ГК ингибирует 11β-гидроксистероиддегидрогеназу, локализующуюся преимущественно в почках и обеспечивающую превращение кортизола в кортизон. В результате кортизол накапливается в организме. Обладая сопоставимым с альдостероном сродством к минералокортикоидным рецепторам, он взаимодействует с последними, вызывая развитие минералокортикоидных эффектов. Происходит задержка натрия и воды в организме, снижается продукция мочи, увеличивается объем внеклеточной жидкости, снижаются активность ренина и уровень альдостерона плазмы, начинается интенсивное выведение калия. Электролитный дисбаланс становится причиной повышения АД, отеков, нарушения ритма сердца и изменений на ЭКГ [28, 31, 32, 61]. При этом симптомы псевдоальдостеронизма могут быть эффективно купированы назначением невысоких доз спиронолактона по 50–100 мг/сут [5, 31]. Пациентам с гипокалиемией препараты ГК следует назначать с осторожностью и проводить лечение под контролем уровня калия в плазме крови [29].
Влияние на другие системы органов
В литературе описаны НЯ со стороны других систем органов на фоне применения ГК. Однако следует заметить, что нередко они регистрировались не в клинических исследованиях препаратов ГК, а носили характер ретроспективно описанных случаев самостоятельного бесконтрольного применения ГК пациентами в составе средств народной медицины, пищевых добавок или табака. Это заставляет относиться к ним критически, ввиду отсутствия доказанной надлежащим образом связи и невозможности исключить влияние многих внутренних и внешних факторов. При этом в ходе изучения безопасности ГК + ЭФ и ГК + УДХК в клинических исследованиях и пострегистрационном периоде эти НЯ или не были отмечены, или носили характер единичных.
Так, в нескольких работах были описаны мышечная слабость, мышечные судороги, миопатия и рабдомиолиз, причинами которых послужили электролитные нарушения [28, 31, 41, 45, 62]. Чаще всего подобные НЯ развивались не на фоне монотерапии ГК, а при ее совместном назначении с другими препаратами, в частности с диуретиками [63]. В клинических исследованиях ГК + ЭФ и ГК + УДХК таких НЯ зарегистрировано не было; в пострегистрационном периоде описан только один случай мышечных судорог на фоне внутривенного введения ГК + ЭФ.
В ряде публикаций было высказано предположение о связи нарушений со стороны мочевыделительной системы – появления скрытой крови в моче, развития острой почечной недостаточности – с приемом ГК [28, 41, 45]. В клинических исследованиях и в ходе пострегистрационного изучения безопасности отечественных препаратов ГК эти НЯ не наблюдались.
Некоторые авторы предполагают влияние ГК на состояние нервной системы и ее возможность стать причиной головной боли, головокружения, парестезий, паралича, преходящего снижения остроты зрения [31, 38, 40, 41, 45, 54]. Редкие случаи головной боли и головокружения отмечались и в клинических исследованиях, и при пострегистрационном изучении безопасности отечественных препаратов ГК. Другие, более серьезные НЯ со стороны нервной системы отмечены не были.
Есть несколько работ, где после внутривенного введения ГК были описаны гриппоподобные симптомы или повышенная утомляемость [38, 39, 54]. Несколько таких случаев было зафиксировано и для ГК + ЭФ. Однако сложно утверждать, является ли это следствием иммуномодулирующего действия ГК, индивидуальной гиперчувствительности или других факторов.
Иногда отмечались боль или образование гематомы в месте введения препарата ГК в парентеральной лекарственной форме [38, 39, 54]. Для отечественных препаратов это не было характерным, в связи с более оптимальным составом вспомогательных веществ и высоким качеством выполнения манипуляции медицинским персоналом.
Рядом авторов была выдвинута гипотеза, что из-за структурного сходства со стероидными гормонами ГК может угнетать синтез тестостерона [31]. В подтверждение были приведены результаты одного неконтролируемого исследования на малой выборке пациентов (25 здоровых добровольцев), где соответствующий эффект был продемонстрирован на фоне ежедневного приема ГК в дозе 500 мг [35]. Однако в более крупном исследовании, в котором пациенты принимали препарат в меньшей дозе, сопоставимой с российскими препаратами ГК в пероральной лекарственной форме, влияния на уровень тестостерона не было [64]. Это позволяет оценить способность ГК снижать концентрацию тестостерона по крайней мере как спорную, а соответствующие данные как противоречивые. Сомнения в правомочности таких опасений подтверждает и то, что, несмотря на химическую структуру, ГК обладает минимальной связывающей способностью с рецепторами андрогенов и эстрогенов [28]. А тот факт, что ни в одном клиническом исследовании ГК + ЭФ и ГК + УДХК, а также в ходе пострегистрационного изучения безопасности влияния на либидо и уровень тестостерона не отмечалось, позволяет говорить о неприменимости к ним этих рисков.
Еще одним сомнительным предположением представляется возможность развития или усугубления у пациентов с заболеваниями печени на фоне применения ГК портальной гипертензии, обусловленной наличием у ГК псевдоминералокортикоидного действия [65, 66]. Важно заметить, что псевдоальдостеронизм – это не результат любого назначения ГК, а, как правило, следствие ее длительного применения в больших дозах. Ни в одном клиническом исследовании с участием пациентов с заболеваниями печени на разных стадиях, включая цирроз, проведенных в России и за рубежом, а также в ходе пострегистрационного изучения безопасности отечественных препаратов ГК случаев портальной гипертензии зафиксировано не было.
В связи с регистрацией препарата, включающего комбинацию ГК + УДХК, показанного в том числе при заболеваниях желчевыводящих путей, встал вопрос о влиянии ГК на реологию желчи. Вопрос положительного влияния не лишен основания, но требует дальнейшего изучения. Вместе с тем ухудшения реологических свойств желчи не было отмечено ни в одном клиническом исследовании ГК + ЭФ и ГК + УДХК, включая исследования с участием пациентов с заболеваниями желчевыводящих путей. Не было их зарегистрировано и в ходе пострегистрационного изучения безопасности ГК + ЭФ.
Применение при беременности
Так как на фоне ГК возможны развитие псевдоальдостеронизма и задержка жидкости в организме, ее противопоказано назначать при беременности [44]. Что касается данных о влиянии ГК на репродуктивную систему, то они противоречивы. С одной стороны, есть мнение, что ГК может обладать абортивной активностью [44, 45], с другой – допускается возможность применения ГК и в период беременности, и во время грудного вскармливания на основании того, что негативное влияние на плод и ребенка возможно только при приеме очень больших доз [28, 31]. В свою очередь, в исследованиях FDA ни тератогенного действия ГК [31], ни мутагенного [28] отмечено не было. В любом случае назначение препаратов ГК, зарегистрированных в РФ, при беременности, а также у детей до 12 лет противопоказано, хотя в литературе и описан небольшой опыт их безопасного применения в детской популяции.
Лекарственные взаимодействия
В экспериментальных работах была продемонстрирована способность ГК вызывать индукцию CYP3A, в меньшей степени – CYP2B1 и CYP1A2. Высказано предположение, что потенциально она может ускорять метаболизм совместно назначаемых препаратов – варфарина, парацетамола, глюкокортикоидов, оральных контрацептивов [28, 29, 31, 44, 45]. Обсуждается возможность усиления на фоне ГК побочных действий пероральных контрацептивов, дигоксина, петлевых и тиазидных диуретиков, метотрексата [28, 29, 31]. Однако стоит заметить, что данные о ее влиянии на активность ферментов системы цитохрома Р450 неоднозначны и наиболее вероятно, что оно возможно только при длительном приеме крайне высоких доз [31].
В литературе имеются отдельные сообщения о развитии псевдоальдостеронизма при совместном назначении ГК с цилостазолом [29, 67] и гидрохлоротиазидом [50]; гипокалиемии – при совместном назначении с инсулином [68]; миалгии и рабдомиолиза – с симвастатином и ловастатином; АГ – с блокаторами кальциевых каналов [69]. Есть данные, что слабительные средства, а также метронидазол в комбинации с амоксициллином или кларитромицином могут угнетать всасывание ГК. Циметидин и аналогичные ему блокаторы цитохромов Р450 способны уменьшать площадь под фармакокинетической кривой ГК [31]. Указано, что ГК может снижать эффективность антигипертензивных препаратов, в частности ингибиторов ангиотензинпревращающего фермента и антагонистов рецепторов ангиотензина II [31, 70]. Однако все эти риски носят несистемный характер, подтверждения их возникновения в отношении ГК + ЭФ и ГК + УДХК нет, а исследований на эту тему не было найдено. Поэтому данную информацию на текущем этапе можно оценивать в качестве предмета для изучения и дальнейшего наблюдения. Конкретные рекомендации в отношении предупредительных мер, касающихся применения препаратов ГК совместно с другими лекарственными средствами, пока давать преждевременно.
Заключение
Проведена комплексная оценка безопасности фиксированных комбинаций ГК + ЭФ в пероральной и парентеральной лекарственных формах, а также ГК + УДХК в пероральной лекарственной форме, зарегистрированных в РФ. Проведен критический анализ совокупности данных клинических исследований и пострегистрационного изучения безопасности, включивших в общей сложности более 1,3 млн случаев назначений, а также научной литературы по теме исследования. Было установлено, что ГК является практически безопасным веществом, не обладает острой токсичностью, мутагенным, канцерогенным и тератогенным действиями, а также потенциалом для развития лекарственной зависимости. Развитие псевдоальдостеронизма возможно при субхроническом и хроническом воздействии. По результатам проведенных клинических исследований, где изучали безопасность фиксированных комбинаций ГК, зарегистрированных в РФ, общая частота НЯ оказалась низкой, составив 1,4% для комбинации с ЭФ и 10,6% – для комбинации с УДХК при суточной дозе ГК от 52,5 до 210 мг при пероральном введении и от 200 до 400 мг – при внутривенном введении. Преобладающими являются НЯ со стороны желудочно-кишечного тракта и кожи, реже отмечаются НЯ со стороны сердечно-сосудистой системы. Клинически значимые лекарственные взаимодействия описаны не были. Отечественные препараты с ГК продемонстрировали лучшую безопасность по сравнению с зарубежными аналогами, в частности в отношении возможности развития псевдоальдостеронизма, что связано в первую очередь с дозировкой, рекомендуемой схемой назначения, а также наличием лекарственной формы для перорального введения. В целом их профиль безопасности и соотношение «риск – польза» можно оценить как благоприятные.
S.V. Okovity, PhD, Prof., I.G. Nikitin, PhD, Prof.
Saint Petersburg State Chemical and Pharmaceutical University
Pirogov Russian National Research Medical University, Moscow
Contact person: Igor G. Nikitin, igor.nikitin.64@mail.ru
The target objectives of the State Program "Development of the Medical and Pharmaceutical Industry" and the Strategy for Drug Supply for the Population of the Russian Federation, as well as the epidemiologically determined need
for a wide range of hepatoprotectors, require a study of their safety.
Objective. To study the safety of using domestic preparations of glycyrrhizic acid in humans in various dosage forms, with different routes of administration and administration regimens.
Material and methods. A generalized analysis of the results of 21 clinical studies was carried out, the tasks of which included the study of safety, as well as the results of safety studies in the post-registration period of observation (2015–2019) of domestic preparations of glycyrrhizic acid in oral and parenteral dosage forms for various prescription regimens. A total of 1,385,316 drug prescriptions were included in the analysis. Parameters evaluated included the incidence of adverse events and the incidence of drug interactions. The results obtained were critically assessed taking into account the preclinical and clinical data of the scientific literature.
Results. It was found that glycyrrhizic acid is practically safe substance, does not have acute toxicity, mutagenic, carcinogenic and teratogenic effects, as well as the potential for the development of drug dependence. Adverse events from the cardiovascular system are less common. No drug interactions have been reported. The overall frequency of adverse events, including cases of pseudoaldosteronism, is significantly lower than for foreign counterparts, which is associated with the selected dosage and prescription regimens, as well as the widespread use of oral dosage forms.
Conclusion. Domestic preparations of glycyrrhizic acid are characterized by a favorable safety profile and a risk-benefit ratio.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.