Результаты применения ишемического посткондиционирования у пациентов с острым каротидным ишемическим инсультом
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Были сформированы три группы больных. Первую группу составили 35 пациентов, которые во время стационарного лечения по поводу ИИ получили десять процедур ИПоК. ИПоК вызывалось компрессией плечевой артерии манжеткой тонометра на уровне, на 20–25 мм рт. ст. превышающем максимальное зарегистрированное у пациента при проведении процедуры систолическое артериальное давление (длительность компрессии – 120 секунд, всего три эпизода через 10 минут один раз в сутки). Во вторую группу вошли 35 больных, которые получили два курса ИПоК: один во время лечения в стационаре по поводу ИИ, другой – через месяц от начала развития ИИ. Третью группу представляли 38 больных, не прошедших процедуру ИПоК.
Результаты. ИПоК сопровождалось статистически значимым уменьшением выраженности пареза мышц кисти и предплечья. В меньшей степени улучшение отмечалось в мышцах нижних конечностей, а также в восстановлении мышечного тонуса. Эффект носил дозозависимый характер. Более выраженное улучшение имело место у пациентов, прошедших повторные курсы ИПоК. Зафиксирована хорошая переносимость ИПоК.
Материал и методы. Были сформированы три группы больных. Первую группу составили 35 пациентов, которые во время стационарного лечения по поводу ИИ получили десять процедур ИПоК. ИПоК вызывалось компрессией плечевой артерии манжеткой тонометра на уровне, на 20–25 мм рт. ст. превышающем максимальное зарегистрированное у пациента при проведении процедуры систолическое артериальное давление (длительность компрессии – 120 секунд, всего три эпизода через 10 минут один раз в сутки). Во вторую группу вошли 35 больных, которые получили два курса ИПоК: один во время лечения в стационаре по поводу ИИ, другой – через месяц от начала развития ИИ. Третью группу представляли 38 больных, не прошедших процедуру ИПоК.
Результаты. ИПоК сопровождалось статистически значимым уменьшением выраженности пареза мышц кисти и предплечья. В меньшей степени улучшение отмечалось в мышцах нижних конечностей, а также в восстановлении мышечного тонуса. Эффект носил дозозависимый характер. Более выраженное улучшение имело место у пациентов, прошедших повторные курсы ИПоК. Зафиксирована хорошая переносимость ИПоК.
![Таблица 2. Динамика показателей по шкале ARAT, балл, Me [Q1; Q3]](/upload/resize_cache/iblock/2e1/195_350_1/Abusueva2.jpg)
![Таблица 3. Динамика показателей функциональной активности верхней конечности по разделам A–D шкалы FMA, балл, Me [Q1; Q3]](/upload/resize_cache/iblock/fa9/195_350_1/Abusueva3.jpg)
![Таблица 4. Динамика показателей двигательной активности нижней конечности по разделам E–F шкалы FMA, балл, Me [Q1; Q3]](/upload/resize_cache/iblock/789/195_350_1/Abusueva4.jpg)
![Таблица 5. Динамика показателей по шкале Эшворта, балл, Me [Q1; Q3]](/upload/resize_cache/iblock/d2f/195_350_1/Abusueva5.jpg)
Клинические наблюдения и результаты экспериментальных исследований свидетельствуют о том, что ткань, перенесшая эпизод обратимой ишемии, не приведший к клеточной гибели, приобретает устойчивость к воздействию последующей ишемии, даже более тяжелой [1, 2]. Данный феномен, рассматриваемый как приобретенная толерантность ткани к гипоксии/ишемии, получил название ишемического прекондиционирования (ИПК) [3]. Согласно данным экспериментальных исследований, пятиминутная двусторонняя каротидная окклюзия у монгольских песчанок приводит к массивной гибели нейронов гиппокампа. Однако, если животных за 24–48 часов подвергнуть обратимому пережатию сонных артерий в течение двух минут, тяжесть поражения нейронов значительно уменьшается [4].
Дозированная ишемия, не приводящая к возникновению морфологических изменений ткани головного мозга, оказывает значительное протективное воздействие при последующей глубокой ишемии. Положительный эффект ИПК получил подтверждение в результате применения биохимических и гистологических методов исследования в условиях эксперимента, проведенного на различных тканях млекопитающих [5, 6].
Клинические наблюдения также подтверждают наличие феномена ИПК. Так, установлено, что у пациентов, ранее перенесших транзиторные ишемические атаки (ТИА), развитие ишемического инсульта (ИИ) характеризуется относительно умеренной выраженностью очагового неврологического дефицита. При этом исход заболевания носит более благоприятный характер [7].
В клиническом исследовании M.C. Weih и соавт. у 37 из 148 пациентов с острым ИИ, ранее перенесших ТИА в той же сосудистой системе, функциональный исход ИИ был более благоприятным, чем у пациентов без ТИА (состояние больных оценивали по шкале исходов Глазго и модифицированной шкале Рэнкина через один и три месяца от начала развития ИИ) [8].
Последующие исследования продемонстрировали влияние на исход ИИ не только самого факта перенесенной ранее ТИА, но и ее длительности (менее 10 минут, 10–20 минут и более 20 минут). Так, относительно более благоприятный исход ИИ (меньшая выраженность неврологического дефицита и более высокий уровень независимости в повседневной жизни) статистически значимо чаще наблюдался у больных, ранее переносивших ТИА продолжительностью от 10 до 20 минут, по сравнению с пациентами с менее длительными ТИА [9].
Результаты указанных наблюдений послужили основанием для изучения возможности применения ИПК в целях уменьшения выраженности ишемического повреждения миокарда и головного мозга. При этом применялась методика удаленной обратимой ишемии, в частности обусловленной компрессией артерий, кровоснабжающих нижние или верхние конечности [10]. Дальнейшие исследования были посвящены оценке возможности клинического применения не только ИПК, но и ишемического посткондиционирования (ИПоК), при котором обратимая ишемия конечности вызывалась у больных, уже перенесших ИИ, или у пациентов с хроническими расстройствами мозгового кровообращения [11, 12]. Результаты проведенных исследований продемонстрировали не только клиническое улучшение у пациентов, прошедших процедуру ИПоК, но и большую сохранность области пенумбры, а также отсутствие увеличения очага инфаркта на протяжении 30-дневного периода наблюдения по данным магнитно-резонансной томографии (МРТ) [13].
R. Meng и соавт. применяли ИПоК у больных со стенозирующим поражением вне- и внутричерепных артерий, не приводящим к развитию ИИ [14]. Показано, что у больных, у которых использовалась ИПоК, количество асимптомных ИИ через 90 и 300 дней лечения составило 5 и 7,9% соответственно, тогда как в группе сравнения – 23,3 и 26,7% (отличия между группами носили достоверный характер; p < 0,01). Кроме того, выраженность очагового неврологического дефицита у пациентов, прошедших процедуру ИПоК и перенесших инсульт, оказалась достоверно меньше, чем в группе сравнения (различия достоверны; p < 0,01).
Цель – оценить эффективность ИПоК у пациентов с острым каротидным ИИ.
Материал и методы
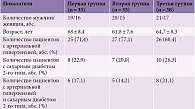
Для оценки эффективности и переносимости ИПоК были сформированы три группы больных. В первую вошли 35 пациентов, которые во время стационарного лечения по поводу ИИ получили десять процедур ИПоК. ИПоК вызывалось компрессией плечевой артерии манжеткой тонометра на уровне, на 20–25 мм рт. ст. превышающем максимальное зарегистрированное у пациента при проведении процедуры систолическое артериальное давление. Длительность компрессии – 120 секунд, всего три эпизода через 10 минут один раз в сутки. Процедуры проводились ежедневно на протяжении десяти дней. Вторую группу составили 35 больных, получивших два курса ИПоК: один во время лечения в стационаре по поводу ИИ, другой – через месяц после развития ИИ. 38 больных третьей группы не получали ИПоК. Группы были сопоставимы по основным клинико-демографическим характеристикам (табл. 1). Всем больным были проведены унифицированная терапия и лабораторно-инструментальное обследование в полном соответствии со стандартами оказания медицинской помощи при остром нарушении мозгового кровообращения. Протокол исследования получил одобрение этического комитета ФГБОУ ВО «Дагестанская государственная медицинская академия» Минздрава России.
Критериями включения в исследование были:
- возраст от 18 до 75 лет;
- острый ИИ в каротидной системе, подтвержденный результатами компьютерной томографии (КТ)/МРТ;
- госпитализация в отделение для лечения больных с острым нарушением мозгового кровообращения в первые 4,5 часа от начала заболевания;
- готовность пациента участвовать в исследовании;
- ясное сознание на момент госпитализации (значение по шкале комы Глазго 15 баллов);
- подписанное пациентом или его законным представителем информированное согласие.
Критерии невключения в исследование:
- возраст моложе 18 или старше 75 лет;
- геморрагический инсульт любой локализации (включая вторичное геморрагическое пропитывание) или смешанный инсульт;
- ишемический инсульт в вертебрально-базилярной системе;
- лакунарный инфаркт любой локализации;
- повторный инсульт любой локализации;
- острый инфаркт миокарда/острый коронарный синдром;
- локальные воспалительные, травматические или тромботические изменения в месте наложения манжеты;
- нестабильное артериальное давление (неконтролируемые артериальная гипо- или гипертензия);
- отсутствие готовности участвовать в исследовании.
Все больные прошли клинический и неврологический осмотр. Выраженность функциональных нарушений в верхней конечности оценивали по шкале Фугл-Мейера (FAM) и ARAT, нижней конечности – по шкале FAM. Для оценки состояния мышечного тонуса использовали шкалу Эшворта. Наличие, характер и локализация ИИ подтверждались методами нейровизуализации – мультиспиральной КТ и/или МРТ головного мозга.
Статистическую обработку полученных данных выполняли с помощью программы SPSS 20. Показатели описательной статистики качественных признаков представлены в виде абсолютных и относительных частот (процентов), непараметрические данные – в виде медианы и 25%-ного и 75%-ного квартилей (Me [Q1; Q3]). Для сравнения двух независимых выборок по одному признаку использовали U-критерий Манна – Уитни. Статистически значимыми считались отличия при р < 0,05.
Результаты
Статистически значимые различия в исходных показателях состояния двигательной функции по шкале ARAT (проявления пареза мускулатуры пальцев кисти) между группами не установлены. На фоне проводимой терапии у пациентов первой группы на 3–5-е сутки существенных отличий по сравнению с исходными уровнями не наблюдалось. Начиная с первого месяца лечения отмечалось значимое увеличение показателей по сравнению с исходными (~15%; p < 0,05). Через шесть и 12 месяцев показатели практически не изменились и в среднем превышали исходные уровни на 20% (p < 0,05) (табл. 2).
У пациентов второй группы значения по шкале ARAT на первые, третьи и пятые сутки не отличались, на 11-е сутки зафиксированы достоверные отличия по сравнению с исходными уровнями (~15%; p < 0,05). В дальнейшем сохранялась статистически значимая положительная динамика: через месяц значения были на ~20% выше исходных и достоверно превышали соответствующие показатели в первой и третьей группах. Через шесть и 12 месяцев статистически значимая динамика показателей по шкале ARAT отсутствовала. При этом значения достоверно превышали показатели в первой и третьей группах (p < 0,05 для обоих сравнений).
У пациентов третьей группы динамика значений по шкале ARAT была наименее выраженной. Несмотря на увеличение показателей спустя месяц, достоверные отличия по сравнению с исходными уровнями отсутствовали. Статистически значимое увеличение показателей (на 18%; p < 0,05) отмечалось при обследовании через шесть месяцев. Через 12 месяцев показатели незначительно увеличились и превысили исходные на 18% (p < 0,05).
Таким образом, наиболее значимая динамика, характеризующая расширение функциональных возможностей кисти, наблюдалась у больных второй группы. При обследовании через месяц значения по шкале ARAT у них были выше, чем у пациентов первой и третьей групп (p < 0,05). В дальнейшем сохранялась некоторая положительная динамика. Однако через шесть и 12 месяцев наблюдения различия между группами оказались незначительными. Независимо от характера лечения улучшение прежде всего заключалось в расширении силы и объема активных движений пальцев кисти (сгибание фаланговых суставов). Значимых отличий в зависимости локализации очага инсульта, возраста пациентов, других факторов не выявлено.
Результаты оценки эффективности лечения по шкале ARAT подтверждены результатами оценки состояния пациентов по разделам A–D шкалы FMA (табл. 3), которая позволяет проанализировать функциональные возможности различных мышечных групп верхней конечности в целом. Исходные показатели в трех группах статистически значимо не отличались. У больных первой группы на пятые сутки достоверные отличия показателей от исходных уровней отсутствовали. На 11-е сутки значения возросли на 19% (p < 0,05), а через месяц – на 22% (p < 0,05). Максимального уровня они достигли к шестому месяцу наблюдения (32%; p < 0,05). Через 12 месяцев дальнейший прирост по сути отсутствовал.
У пациентов второй группы значения по разделам A–D шкалы FMA при обследовании на первые, третьи и пятые сутки статистически значимо не отличались от исходных. На 11-е сутки имел место прирост на 19% (p < 0,05), который оказался выше, чем в первой и третьей группах. При обследовании через месяц (после повторного курса ИПоК) значения по указанной шкале у пациентов второй группы на 24% превосходили исходные и статистически значимо превышали показатели в первой (p < 0,05) и третьей (p < 0,05) группах. При обследовании через шесть и 12 месяцев значения были достоверно выше исходных (p < 0,05), хотя и не отличались статистически значимо от результатов, полученных при обследовании через месяц терапии. Через шесть и 12 месяцев показатели по шкале FMA у больных второй группы статистически значимо превышали аналогичные значения у пациентов первой и третьей групп.
Наименее выраженная динамика показателей по шкале FMA (разделы A–D) отмечалась у больных третьей группы. При обследовании на третьи, пятые и 11-е сутки показатели существенно не отличались от исходных. Статистически значимое увеличение значений (на 12%) наблюдалось через месяц (p < 0,05). При этом значения были статистически значимо ниже, чем у больных первой и второй групп (p < 0,05). Через шесть месяцев наблюдалось дальнейшее увеличение показателей (на 20% по сравнению с исходными значениями). Рост продолжился и впоследствии (до 20% по сравнению с исходными уровнями). Значения по разделам A–D шкалы FMA через 12 месяцев оказались существенно ниже, чем в первой и второй группах.
Полученные результаты свидетельствуют о том, что наиболее значимое улучшение имело место у больных второй группы по завершении второго курса ИПоК. К этому периоду был зарегистрирован наибольший прирост мышечной силы в пальцах кисти и сгибателях предплечья. Менее выраженная положительная динамика зафиксирована у пациентов первой группы. Максимальный прирост силы и объема движений у них наблюдался к концу первого месяца после одного курса ИПоК. При этом выраженность положительного эффекта была меньше, чем у больных второй группы. Наименее выраженное улучшение через шесть месяцев после перенесенного инсульта наблюдалось у пациентов третьей группы. Вместе с тем к окончанию периода наблюдения (через 12 месяцев) значения по указанным шкалам в трех группах были близки, но несколько ниже у больных третьей группы. Как и при обследовании с применением шкалы ARAT, у всех пациентов не зафиксировано значимых отличий по разделам A–D шкалы FMA в зависимости от половой принадлежности, возраста, расположения очага ишемического инсульта в сосудистом бассейне, исходной выраженности неврологического дефицита, тяжести и характера соматической патологии.
При оценке выраженности проявлений пареза в нижних конечностях (разделы E–F шкалы FMA) у больных первой группы к пятым суткам исследования наметилась незначительная положительная динамика (табл. 4). Более выраженный прирост показателя наблюдался при обследовании на 11-е сутки (на 12% по сравнению с исходным уровнем), хотя подобная динамика не носила статистически значимого характера. При обследовании через шесть и 12 месяцев зафиксировано улучшение, которое достигло статистически значимого уровня по сравнению с исходными значениями (на 15 и 18% соответственно; p < 0,05). При этом статистически значимых отличий по сравнению с показателями, полученными через месяц наблюдения, не установлено.
У больных второй группы признаки значимого уменьшения выраженности пареза при обследовании на третьи, пятые и 11-е сутки по сравнению с исходными уровнями также отсутствовали. Незначительное нарастание мышечной силы в паретичной конечности наблюдалось через месяц лечения. При этом отличия носили достоверный характер по сравнению с исходными показателями (на 14%; p < 0,05). Умеренно выраженное улучшение отмечалось и при обследовании через шесть и 12 месяцев, хотя отличия не носили статистически значимого характера по сравнению с результатами, полученными при обследовании через месяц (на 5 и 9%; p > 0,05).
Аналогичная динамика прослеживалась и у больных третьей группы: на третьи, пятые и 11-е сутки показатели статистически значимо не отличались от исходных. Достоверное улучшение в виде уменьшения выраженности пареза имело место через месяц (на 20%; p < 0,05). Впоследствии указанные показатели практически не отличались, хотя и превышали исходные на 13–16% (p < 0,05).
Исходя из полученных данных, выраженность регресса неврологического дефицита не зависела от объема проведенных процедур ИПоК и существенно не отличалась в группах. Наиболее выраженное улучшение выражалось в нарастании мышечной силы разгибателей коленного и голеностопного суставов. Выраженность положительной динамики не зависела от локализации очага поражения, исходной тяжести неврологического дефицита, характера соматических заболеваний, проводимой лекарственной терапии.
При исследовании состояния мышечного тонуса установлено, что исходные значения статистически значимо не различались в трех группах (табл. 5). При исследовании на третьи и пятые сутки у больных первой группы отсутствовали существенные изменения данного показателя. На 11-е сутки отмечалась положительная динамика, что свидетельствовало о нормализации мышечного тонуса. Однако отличия показателя не носили достоверного характера по сравнению с исходным уровнем во всех трех группах (p > 0,05). Спустя шесть и 12 месяцев от начала исследования показатель состояния мышечного тонуса на 15% превысил исходный (p < 0,05). При исследовании через шесть и 12 месяцев статистически значимые отличия данного показателя по сравнению с исходным отсутствовали.
У больных второй группы, равно как и у пациентов первой группы, показатели по шкале Эшворта на третьи, пятые и 11-е сутки значимо не отличались от исходных. Статистически значимое улучшение наблюдалось спустя месяц от начала развития заболевания (на 14%; p < 0,05). При исследовании через шесть и 12 месяцев имели место достовернее отличия по сравнению с исходными показателями (на 15 и 18% соответственно; p < 0,05). Однако достоверные отличия по сравнению с результатами, полученными при обследовании через месяц, отсутствовали.
Выраженность изменений показателей по шкале Эшворта у больных третьей группы существенно не отличалась от таковой в первой и второй группах. С первых по 11-е сутки значения оставались стабильными и не отличались от исходных. Статистически значимое увеличение отмечалось начиная с первого месяца наблюдения. Через шесть месяцев значения достоверно превысили исходные (на 13%; p < 0,05), хотя и не отличались от уровней, зарегистрированных при исследовании через месяц. Через 12 месяцев значения уменьшались, что свидетельствовало о нормализации мышечного тонуса в паретичных конечностях.
Таким образом, результаты оценки изменений состояния мышечного тонуса в отличие от динамики показателей, характеризующих силу и объем движений в паретичных конечностях, не продемонстрировали существенных изменений. Зафиксирована лишь незначительная динамика показателя мышечного тонуса на протяжении всего периода наблюдения. Независимо от проводимого лечения данный показатель приблизился к нормальному значению через месяц и показал незначительную положительную динамику в дальнейшем. Во всех трех группах умеренное повышение мышечного тонуса зарегистрировано после первого месяца перенесенного заболевания. Впоследствии наблюдалось его снижение.
Лечение хорошо переносилось всеми пациентами. Не зафиксировано ни одного случая отмены ИПоК или изменения режима проведения процедуры. Наиболее частыми нежелательными явлениями были дискомфорт, боль, образование кровоподтеков в области наложения манжеты.
Обсуждение
Возможность применения ИПоК у пациентов как с острыми, так и хроническими расстройствами мозгового кровообращения вызывает особый интерес. Новый метод ИПоК ассоциируется с повышением эффективности лечения и может быть интегрирован в алгоритмы комплексного лечения таких больных. Терапевтический эффект ИПоК может быть обусловлен активацией факторов, индуцируемых ишемией и повышающих последующую устойчивость тканей к гипоксии и ишемии, уменьшением выраженности воспалительной реакции и окислительного стресса, активацией синтеза нейротрофических факторов [6, 15–17].
Полученные результаты свидетельствуют о положительном эффекте ИПоК (уменьшение выраженности пареза мышц кисти и предплечья) у пациентов с первичным каротидным ИИ. Эффект носил дозозависимый характер и в большей степени был выражен при повторном курсе ИПоК. По истечении года от момента развития ИИ и начала проведения ИПоК различия между группами больных в отношении выраженности неврологического дефицита уменьшались, что позволяет обсуждать вопрос о целесообразности проведения повторных курсов ИПоК [18, 19]. В меньшей степени эффект наблюдался в отношении пареза мышц нижних конечностей, а также нарушений мышечного тонуса. Последнее может быть обусловлено умеренно выраженной спастичностью у данной когорты больных из-за невысокой тяжести заболевания.
Заключение
Дальнейшие исследования должны быть направлены на уточнение длительности и кратности проведения ИПоК, режимов дозирования, длительности компрессии, а также на поиск оптимальных комбинаций ИПоК с лекарственными препаратами.
B.A. Abusueva, PhD, E.N. Ismail-Zade, L.I. Pyshkina, PhD, Prof., A.V. Chugunov, PhD, P.R. Kamchatnov, PhD, Prof.
Dagestan State Medical University
N.I. Pirogov Russian National Medical University
Contact person: Pavel R. Kamchatnov, pavkam7@gmail.com
Purpose of the study – to study the efficacy of ischemic postconditioning (IPoC) in patients with acute carotid IS.
Material and methods. Three groups of patients were formed. The 1st group consisted of 35 patients who, during the period of inpatient treatment for IS, received 10 IPоС procedures (caused by compression of the brachial artery with a tonometer cuff by 20–25 mm Hg exceeding the maximum recorded in the patient during the procedure, the duration of compression – 120 seconds, only 3 episodes every 10 minutes 1 time per day), the 2nd group consisted of 35 patients who received two courses of IPoC: the first – during treatment in a hospital for IS, the second – 1 month after the development of IS, 3rd group – 38 patients who did not receive an IPоC.
Results. The IPoC was accompanied by a statistically significant decrease in the paresis of the muscles of the hand and forearm, to a lesser extent improvement was observed in the muscles of the lower extremities, as well as the restoration of muscle tone. The effect was dose-dependent, with a more pronounced improvement in patients with repeated courses of IPoC. Good tolerability of IPoC was noted.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.