Роль фитотерапии в метафилактике мочекаменной болезни
- Аннотация
- Статья
- Ссылки
- English
Мочекаменная болезнь – полиэтиологическое заболевание, характеризующееся наличием камня или нескольких камней в почках и/или мочевых путях. Несмотря на очевидный прогресс в изучении мочекаменной болезни, заболеваемость уролитиазом неуклонно растет как в мире в целом, так и в Российской Федерации в частности [1, 2]. В России за период с 2002 по 2014 г. отмечается прирост числа пациентов на 34,5% с 629 453 до 846 570 человек [1]. В среднем в 2014 г. показатель числа пациентов с мочекаменной болезнью на 100 тыс. населения составил 578,8, тогда как в 2002 г. он равнялся 440,5 (+31,4%) [1]. По данным различных авторов, рецидив камнеобразования встречается в 50% случаев в течение пяти лет после проведенного лечения [3].
Причины уролитиаза до конца не изучены. Тем не менее известно, что к камнеобразованию могут приводить сопутствующие заболевания: первичный гиперпаратиреоз, почечный канальцевый ацидоз, подагра, метаболический синдром [3–5], а также мутации определенных генов [6], регулярный прием кальцийсодержащих препаратов, витамина D [7, 8], инфекция мочевых путей [9]. Вместе с тем продолжаются исследования влияния макромолекул мочи на процессы литогенеза [10–14], анализируются физико-химические свойства мочи у пациентов с уролитиазом [15], изучается метаболизм камнеобразующих веществ в организме человека [16–19], проводится поиск генов, полиморфизм которых является фактором риска мочекаменной болезни [20, 21]. Одновременно совершенствуется оборудование для хирургического лечения, появляются новые подходы к оперативному удалению конкрементов из верхних мочевых путей.
Очень важно акцентировать внимание как врача, так и пациента на проведении профилактики и метафилактики уролитиаза. Метафилактика мочекаменной болезни – профилактика рецидива заболевания. Соблюдение всех рекомендаций по противорецидивному лечению мочекаменной болезни может снизить частоту повторного камнеобразования на 41% [22]. Одна из главных составляющих метафилактики мочекаменной болезни – индивидуальная специфическая диетотерапия [23, 24]. При составлении рекомендаций необходимо оценить химический состав конкремента, концентрацию камнеобразующих веществ в крови и суточной моче, стереотип питания пациента. Если диетотерапия неэффективна, следует назначить медикаментозное лечение в зависимости от выявленных метаболических литогенных нарушений [25].
При лекарственной терапии применяют тиазидные диуретики, цитратные смеси, аллопуринол, метионин, магнийсодержащие препараты. В то же время многие специалисты обращают внимание на фитопрепараты и биологически активные добавки растительного происхождения. Данный метод лечения известен давно и с успехом применяется практикующими врачами-урологами. Эффективность трав доказана и проверена многими специалистами. Одной из таких биодобавок является комплекс НефраДоз, в состав которого входят восемь компонентов. Среди них давно изученные, хорошо известные и с успехом применяемые экстракты корней марены красильной, листьев ортосифона тычиночного, травы эпимедиума, корней родиолы розовой, корней солодки голой, листьев гинкго билоба, а также соединение органической природы, получаемое из растений, – ресвератрол.
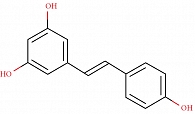
Ресвератрол. Это природное биологически активное вещество из группы фенолов (рисунок). Имеются данные о том, что ресвератрол может препятствовать образованию камней в почках. S.H. Hong и соавт. изучили влияние ресвератрола на процесс образования почечных камней in vitro и in vivo [26]. Исследование с раневым заживлением показало, что ресвератрол значительно ингибирует оксалат-опосредованную миграцию клеток почечного эпителия человека, которая расценивается как важный фактор образования кальций-оксалатных камней в почках.
Марена красильная (Rubia tinctorum L.). Растение ингибирует процессы камнеобразования. Марена красильная обладает диуретическим эффектом и оказывает бактерицидное действие [27, 28]. F. Kalyoncu и соавт. изучали противомикробное действие марены низкодиффузионным методом и обнаружили, что водные и спиртовые экстракты растения проявляют активность в отношении некоторых грамположительных и грамотрицательных бактерий, дрожжевых грибов, нитчатых грибов и актиномицет [29]. Применение марены красильной оправданно при кальцийфосфатном (витлокит, апатит, гидроксиапатит, карбонатапатит) и струвитном уролитиазе [28].
Горянка стрелолистная (эпимедиум, Epimedium). Особого внимания заслуживает широко применяемый в традиционной китайской медицине эпимедиум. Основными компонентами травы являются флавоноиды – сильные природные антиоксиданты. Наибольшей фармакологической активностью среди флавоноидов горянки характеризуется икариин [30], который обладает нефропротективным действием. В экспериментах икариин уменьшал выраженность диабетической нефропатии у крыс с диабетом, индуцированным стрептозотоцином, что, предположительно, связано с модулированием экспрессии коллагена IV типа и трансформирующего фактора роста бета-1 [31].
Кроме того, флавоноиды травы эпимедиума подавляют повышенную экскрецию кальция с мочой (гиперкальциурию), индуцированную отсутствием яичников, и потерю костной массы. В исследовании флавоноиды предупреждали нарушение микроархитектуры трабекулярной кости, индуцированное овариэктомией. Было выявлено, что флавоноиды эпимедиума могут повышать реабсорбцию кальция в почках, стимулировать процесс образования остеобластов, а также подавлять процесс остеокластогенеза у овариэктомированных мышей [32]. Таким образом, применение эпимедиума оправданно у пациентов с гиперкальциурией и уролитиазом.
Родиола розовая (Rhodiola rosea). Широко применяется в народной медицине при переутомлении, для снятия усталости, улучшения работоспособности и выносливости. Препараты родиолы розовой обладают также антиоксидантным, антимикробным, иммуномодулирующим, противовоспалительным свойством, повышают эффективность лечения воспалительных заболеваний. В настоящее время доказано и изучено нефропротективное действие экстракта Rhodiola rosea. По данным U. Uyeturk и соавт., экстракт Rhodiola rosea уменьшает выраженность поражения почек у крыс при односторонней обструкции мочеточника [33]. В исследовании, проведенном Z.S. Wang и соавт., был продемонстрирован защитный эффект экстракта Rhodiola rosea на ранних стадиях нефропатии у крыс со стрептозотоцин-индуцированным диабетом. Через восемь недель уровни глюкозы крови натощак, общего холестерина, триглицеридов, креатинина, суточное выделение альбуминов с мочой, отношение «масса почек – масса тела» и площадь клубочкового аппарата были значительно ниже в группе животных, получавших экстракт Rhodiola rosea, по сравнению с контрольной группой [34].
Ортосифон тычиночный, или почечный чай (Orthosiphon stamineus). По данным O.Z. Ameer и соавт., изучавших фармакологическую активность ортосифона тычиночного, растение оказывает диуретическое, гипоурикемическое, ренопротективное, антимикробное, противовоспалительное и ненаркотическое анальгетическое действие [35]. Мочегонный эффект при приеме почечного чая сопровождается усиленным выделением из организма хлоридов. Диурез увеличивается вдвое, выделение хлоридов – на 39%. J. Casadebeig-Lafon и соавт. отмечали статистически значимое увеличение объема мочи у самцов крыс, которым перорально вводили водный (18 и 180 мг/кг) или водно-спиртовой (70%, 13,5 и 135 мг/кг) экстракт листьев Orthosiphon stamineus. При введении водного экстракта одновременно с увеличением диуреза наблюдалось увеличение экскреции натрия [36].
Противовоспалительная и анальгетическая активность стандартизованного экстракта листьев Orthosiphon stamineus оценивалась в нескольких моделях на животных. В народной медицине растение давно использовалось для купирования боли и воспаления, теперь эти свойства почечного чая получили научное подтверждение [37].
При исследовании антибактериальной активности ортосифона было обнаружено, что экстракты растений, традиционно применяющихся при лечении неосложненных инфекций мочевыводящих путей, обладают антиадгезивным эффектом in vitro в отношении прикрепления уропатогенного штамма Escherichia coli к поверхности клеток мочевого пузыря [38].
N. Kannappan и соавт. выявили нефропротективный эффект метанольного экстракта Orthosiphon stamineus на модели гентамицин-индуцированного поражения почек у крыс. Введение экстракта в дозах 100 и 200 мг/кг массы тела в течение десяти дней приводило к значительному снижению концентрации креатинина в сыворотке, мочевины крови и белка в моче [39].
Таким образом, ортосифон тычиночный имеет большой медицинский потенциал [40]. Почечный чай применяется во многих странах мира при острых и хронических заболеваниях почек, сопровождающихся отеками, альбуминурией, азотемией и образованием почечных камней, при циститах и уретритах, подагре. Диурез увеличивается в первый день приема ортосифона тычиночного, но наиболее отчетливо – через два-три дня. Почечный чай можно употреблять одновременно с сердечными гликозидами, у больных с декомпенсацией кровообращения второй-третьей степени. Его назначают также больным гипертонией с нарушением функции почек. Ортосифон тычиночный эффективен в условиях длительного приема в течение шести – восьми месяцев с перерывами ежемесячно на пять-шесть дней. Побочного действия обычно не отмечается, симптомов отрицательного влияния на почки (белок в моче и проч.) не выявлено [28, 41]. Благодаря гипоурикемическому действию и повышению экскреции цитрата (мощный ингибитор камнеобразования) ортосифон способствует предупреждению образования мочевых камней.
Солодка голая (Glycyrrhiza glabra). Экстракт корней солодки также получил широкое распространение в клинической медицине. Наиболее важное фармакологическое свойство корней солодки – выраженное противовоспалительное действие, заключающееся в своеобразном купировании воспалительных реакций, вызываемых гистамином, серотонином и брадикинином. Спазмолитический эффект препаратов корня солодки был показан in vivo на разных моделях животных (морские свинки, кролики, собаки) [42]. Этот эффект, по-видимому, объясняется действием флавоноидных гликозидов ликвиритигенина и изоликвиритигенина [43]. По данным K. Wojcikowski и соавт., солодка – сильный антиоксидант [44]. Надо отметить, что особое значение при патологии почек имеет применение лекарственных растений – сильных антиоксидантов, поскольку окислительное повреждение считается основным механизмом, вовлекающим почти все хронические заболевания почек.
Включение фитопрепаратов в метафилактику уролитиаза не только желательно, но и необходимо. Фитопрепараты имеют меньше, чем химические лекарственные препараты, противопоказаний к применению. Прием фитопрепаратов, как правило, приветствуется пациентами, и многие больные, которым показаны травы, согласны принимать их длительно и регулярно в отличие от химических препаратов.
Об успешном использовании биологически активной добавки растительного происхождения НефраДоз свидетельствуют результаты многоцентрового исследования, в котором приняли участие многие российские ученые из различных урологических учреждений страны. Была доказана не только безопасность, но и эффективность биодобавки как литокинетического средства после дистанционной ударно-волновой литотрипсии у пациентов с уролитиазом и наличием сопутствующих заболеваний. Полное отхождение фрагментов конкрементов после дистанционной ударно-волновой литотрипсии наблюдалось чаще (в 90% наблюдений) и в более ранние сроки у пациентов, принимавших НефраДоз, по сравнению с больными, получавшими стандартное лечение (эффективность терапии 75,9%). Кроме того, был отмечен диуретический эффект: у пациентов, которые принимали НефраДоз, объем суточной мочи увеличился на 12–15%, также снизилась частота кристаллурии [45].
Об увеличении частоты отхождения фрагментов камней после дистанционной ударно-волновой литотрипсии с 80 до 93,3% и мелких камней с локализацией в нижней трети мочеточников с 46,7 до 66,7%, снижении частоты болевого синдрома и дизурических явлений на фоне комплексной терапии, дополненной комплексом НефраДоз, сообщают исследователи из Алтайского государственного медицинского университета [46].
Ю.Г. Аляев и В.И. Руденко в обзорной статье по современным аспектам медикаментозного лечения пациентов с мочекаменной болезнью подчеркивают, что НефраДоз статистически достоверно уменьшает бактериурию и лейкоцитурию, снижает концентрацию уратов, оксалатов и фосфатов в моче [47].
Обнаруженные эффекты НефраДоза позволяют говорить и о возможности его применения в противорецидивном лечении больных уролитиазом.
Таким образом, учитывая многокомпонентность НефраДоза, его сочетанное воздействие на организм, вероятность положительного влияния на мочевыводящую систему при урологических заболеваниях, доказанную литокинетическую эффективность при мочекаменной болезни, представляется целесообразным проведение дальнейших клинических исследований для определения роли биодобавки в метафилактике уролитиаза.
M.Yu. Prosiannikov, O.V. Konstantinova, N.V. Anokhin
N.A. Lopatkin Scientific Research Institute of Urology and Interventional Radiology – Branch of National Medical Research Radiological Center of the Ministry of Healthcare of the Russian Federation, Moscow
Contact person: Mikhail Yuryevich Prosiannikov, prosyannikov@gmail.com
The possibility of using herbal remedies in metaphylactic urolithiasis. Discusses the therapeutic properties of the components members Pradosa. The results of studies showing the combined effect of herbal remedies on the organism, its positive impact on the urinary system urological diseases, as well as proven cytokinetics efficiency in urolithiasis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.