Роль интравитреальной химиотерапии с мелфаланом в комбинированном лечении ретинобластомы с эндофитным характером роста
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. За период 2013–2018 гг. на базе отдела офтальмоонкологии и радиологии ФГБУ «Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации проведено комбинированное лечение с включением ИВХТ с мелфаланом 19 детям (28 глаз). Средний возраст пациентов составил 27 ± 12 месяцев. Количество инъекций (от одной до пяти) ИВХТ зависело от реакции на лечение. Процедуру проводили на фоне системной химиотерапии, в двух случаях одновременно с брахитерапией, в одном – в сочетании с транспупиллярной термотерапией, в четырех – после брахитерапии.
Результаты. У всех пациентов отмечалась положительная динамика в виде частичной или полной регрессии опухолевых отсевов в стекловидное тело, уменьшения объема диссеминации опухолевых очагов по сетчатке. На фоне системной полихимиотерапии наблюдался стойкий эффект. При невозможности проведения системной химиотерапии положительный эффект носил временный характер, что потребовало назначения повторной ИВХТ или применения локальных методов лечения. По завершении процедуры у двух пациентов зафиксировано кратковременное снижение зрения, обусловленное отеком сетчатки и диска зрительного нерва и тромбозом центральной вены сетчатки, которые были купированы после инстилляций противовоспалительных препаратов и дегидратационной терапии. В двух случаях увеличилось преретинальное кровоизлияние. У всех пациентов на глазном дне выявлены хориоретинальные дистрофические изменения.
Выводы. Несмотря на побочные явления, ИВХТ в схеме комбинированного лечения ретинобластомы групп C, D и E считается эффективным методом при запущенных формах ретинобластомы с эндофитным характером роста и массивной диссеминацией опухолевых клеток по сетчатке.
Материал и методы. За период 2013–2018 гг. на базе отдела офтальмоонкологии и радиологии ФГБУ «Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации проведено комбинированное лечение с включением ИВХТ с мелфаланом 19 детям (28 глаз). Средний возраст пациентов составил 27 ± 12 месяцев. Количество инъекций (от одной до пяти) ИВХТ зависело от реакции на лечение. Процедуру проводили на фоне системной химиотерапии, в двух случаях одновременно с брахитерапией, в одном – в сочетании с транспупиллярной термотерапией, в четырех – после брахитерапии.
Результаты. У всех пациентов отмечалась положительная динамика в виде частичной или полной регрессии опухолевых отсевов в стекловидное тело, уменьшения объема диссеминации опухолевых очагов по сетчатке. На фоне системной полихимиотерапии наблюдался стойкий эффект. При невозможности проведения системной химиотерапии положительный эффект носил временный характер, что потребовало назначения повторной ИВХТ или применения локальных методов лечения. По завершении процедуры у двух пациентов зафиксировано кратковременное снижение зрения, обусловленное отеком сетчатки и диска зрительного нерва и тромбозом центральной вены сетчатки, которые были купированы после инстилляций противовоспалительных препаратов и дегидратационной терапии. В двух случаях увеличилось преретинальное кровоизлияние. У всех пациентов на глазном дне выявлены хориоретинальные дистрофические изменения.
Выводы. Несмотря на побочные явления, ИВХТ в схеме комбинированного лечения ретинобластомы групп C, D и E считается эффективным методом при запущенных формах ретинобластомы с эндофитным характером роста и массивной диссеминацией опухолевых клеток по сетчатке.
Введение
Ретинобластома (РБ) – нейроэктодермальная злокачественная опухоль сетчатки, относящаяся к одним из наиболее тяжелых заболеваний глаз у пациентов младшего возраста. По последним данным, частота РБ составляет 1 : 15 000 живых новорожденных [1].
Алгоритм комбинированного лечения РБ включает в себя лекарственные, лазерные, лучевые и хирургические методы. При РБ применяются хирургическое ликвидационное (энуклеация) и локальное (разрушающая лазеркоагуляция, транспупиллярная термотерапия, криодеструкция, брахитерапия) органосохраняющее лечение. Одним из компонентов лечения РБ является системная (адъювантная и неоадъювантная) и локальная (суперселективная интраартериальная (СИАХТ), интравитреальная (ИВХТ), периокулярная) химиотерапия [2–16].
Впервые ИВХТ применили L. Ericson и B. Rosengren. В 1961 г. они ввели тиотеп в стекловидное тело при РБ с опухолевыми клонами [8]. Преимущество данного метода заключается в обеспечении максимальной концентрации химиопрепарата (мелфалана) внутри глаза без системного воздействия на организм [13]. В начале 2000-х гг. метод стал широко применяться при эндофитных формах РБ c преретинальными и диффузными отсевами в стекловидное тело [9–16].
Цель данной работы – оценить эффективность ИВХТ с мелфаланом в комбинированном лечении ретинобластомы с эндофитным характером роста.
Материал и методы
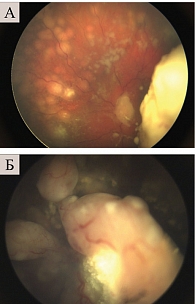
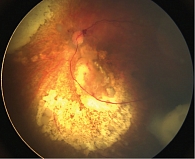
За период 2013–2019 гг. на базе отдела офтальмоонкологии и радиологии ФГБУ «Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца» Минздрава России проведено комбинированное лечение с включением ИВХТ с мелфаланом 19 детям (28 глаз). Средний возраст пациентов составил 27 ± 12 месяцев. У всех больных имела место эндофитная форма РБ с преретинальными и диффузными отсевами в стекловидное тело групп C, D и E (рис. 1).
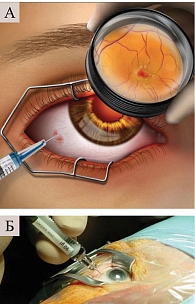
Для проведения ИВХТ использовали тонкие иглы (30 или 32 G). Мелфалан вводили через плоскую часть цилиарного тела (рис. 2) [17]. Доза препарата составила от 16 до 25 мкг на один курс. В зависимости от реакции на лечение проводили от одной до пяти инъекций мелфалана один раз в три-четыре недели (всего 33 процедуры). Процедуры ИВХТ выполняли на фоне системной химиотерапии, в двух случаях одномоментно с брахитерапией, в одном – одновременно с транспупиллярной термотерапией, в четырех – после брахитерапии. Срок наблюдения составил 36 ± 1,2 месяца.
Результаты и обсуждение
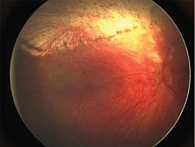
Во всех случаях отмечалась положительная динамика в виде частичной или полной регрессии опухолевых отсевов в стекловидное тело, уменьшения объема диссеминации опухолевых очагов по сетчатке (рис. 3).
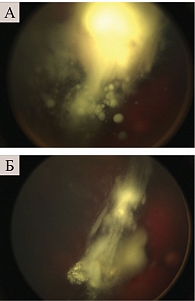
На фоне системной полихимиотерапии регистрировался стойкий эффект. При невозможности проведения системной химиотерапии положительный эффект носил временный характер, что потребовало назначения повторной ИВХТ или использования локальных методов лечения (рис. 4).
После проведения процедуры в двух случаях зарегистрировано кратковременное снижение зрения, обусловленное отеком сетчатки и диска зрительного нерва (рис. 5) и тромбозом центральной вены сетчатки, которые были купированы после инстилляций противовоспалительных препаратов и дегидратационной терапии.
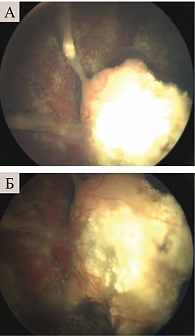
В двух случаях увеличилось преретинальное кровоизлияние. У всех пациентов на глазном дне выявлены хориоретинальные дистрофические изменения (рис. 6). Экстраокулярного роста опухоли по раневым каналам не зафиксировано.
Противоопухолевая химиотерапия предполагает применение лекарственных средств, способных тормозить пролиферацию опухолевых клеток или необратимо их повреждать. Первое сообщение об использовании химиотерапии при РБ появилось в 1953 г. [18], но в практику лечения пациентов с РБ она была внедрена чуть менее 50 лет назад [1–16, 18].
В последние годы часто используется системная полихимиотерапия на основе препарата платины – карбоплатина в комбинации с цитостатиком винкристином и полусинтетическим производным подофилотоксина – этопозидом. Комбинированное воздействие этих препаратов направлено на разрушение ДНК опухолевой клетки, нарушение процесса ее репликации, снижение биологической и ферментативной активности ядер опухолевых клеток, торможение пролиферации клеток и подавление нуклеотидного транспорта, уменьшение параметров первичной опухоли, увеличение резектабельности, повышение абластики, предотвращение развития метастазов [1–4, 13].
Широкое применение системной химиотерапии обусловлено ее эффективностью в разрушении опухоли и предотвращении метастатической болезни. Тем не менее на фоне такой терапии неизбежно возникают побочные эффекты. Как следствие – ухудшается соматический статус пациентов, нарушается режим проведения терапии, снижается ее эффективность [19]. Кроме того, со временем возрастает частота запущенных форм и развиваются рефрактерные формы РБ.
В целях усовершенствования видов химиотерапии, облегчения переносимости системной химиотерапии, уменьшения количества и тяжести ее осложнений были разработаны методы доставки химиопрепаратов непосредственно к опухолевому очагу. В связи с этим особую значимость приобрели методы локальной химиотерапии (СИАХТ, ИВХТ) [5, 9–16].
В начале 2000-х гг. был возрожден и усовершенствован метод селективного интраартериального введения препарата, предложенный в 1987 г. японскими врачами [20]. Однако он не нашел широкого распространения в мире [21]. Развитие высоких технологий в XXI в. позволило усовершенствовать методику и снизить риск возможных осложнений. Первые публикации с анализом результатов применения суперселективной химиотерапии у детей с запущенными формами РБ появились в 2006 г. [22].
Опубликованные результаты лечения методом СИАХТ подтверждают его эффективность при бинокулярных формах РБ со смешанным характером роста [22].
Данные исследований, проведенных в отделе офтальмоонкологии и радиологии Национального медицинского исследовательского центра глазных болезней им. Гельмгольца, также подтвердили эффективность ИАХТ с мелфаланом при резистентных опухолях с экзофитным характером роста, локализующихся в постэкваториальной зоне [5]. Эффект цитостатика алкилирующего типа действия из группы производных бис-бета-хлорэтиламина – мелфалана обусловлено образованием иона этиленимония, алкилирующего связи многих внутриклеточных молекул, в том числе нуклеиновых кислот (посредством связывания с гуанином в 7-й позиции), с блокированием их полимеризации и редупликации, формированием дефектных форм ДНК и блокадой митоза быстро делящихся опухолевых клеток. Препарат активен в отношении находящихся в покое и активно делящихся опухолевых клеток. Его действие фазонеспецифично, но наиболее чувствительны клетки, находящиеся в конце фазы G2 и переходе G2-1, при применении в более высоких дозах – в переходе S-G2 и фазе синтеза ДНК [23].
M. Ueda и cоавт. изучали влияние мелфалана на эритроциты кролика и человека in vitro для определения его токсичной концентрации при РБ путем проведения электроретинографии (ЭРГ). Мелфалан не оказывал существенного влияния на альфа- и бета-волну или колебательный потенциал, что позволило говорить о применении препарата in vivo [24].
Попытки интравитреального введения цитостатиков предпринимались давно, однако показания к этому методу были сформулированы в 2010–2012 гг. В Российской Федерации ИВХТ применяют в соответствии с Федеральными клиническими рекомендациями по диагностике, мониторингу и лечению детей с ретинобластомой, утвержденными Ассоциацией врачей-офтальмологов [25]. Появление новых цитостатиков сделало возможным разрушение опухолевых клонов в стекловидном теле при эндофитной РБ путем интравитреального введения химиопрепаратов [9–16, 26], что резко расширило показания для органосохраняющего лечения.
Заключение
Интравитреальная химиотерапия с мелфаланом в составе комбинированной терапии считается методом выбора при далеко зашедших формах РБ групп C и D с эндофитным характером роста и массивной диссеминацией опухолевых клеток по сетчатке и в стекловидное тело. Несмотря на побочные эффекты, подобная терапия обеспечивает частичную или полную резорбцию либо кальцификацию узлов РБ в сетчатке и опухолевых клонов в стекловидном теле. Метод исключает развитие системных осложнений и позволяет сохранить зрение.
S.V. Saakyan, MD, PhD, Prof., M.P. Kharlampidi, PhD, O.A. Ivanova, PhD, R.A. Tatkov, Ye.B. Myakoshina, PhD
Helmholtz National Medical Research Center of Eye Diseases
Contact person: Yelena B. Myakoshina, myakoshina@mail.ru
The Purpose – to evaluate the effesiency of intravitreal chemotherapy (IVHT) in the combined treatment of retinoblastoma with endophytic growth.
Material and methods. For the period 2013–2018 on the basis of the department of ophthalmic oncology and radiology of the Helmholtz Moscow Research Institute conducted a combined treatment with the inclusion of IVHT with melphalan to 12 children (12 eyes). The average age was 27 months ± 12 months. IVHT was performed for children from 1 to 3 injections, depending on the response to the treatment. The procedure was performed on the background of systemic chemotherapy, in 2 cases with brachytherapy, in 1 case in combination with transpupillary thermotherapy, in 4 cases after brachytherapy.
Results. In all cases, positive dynamics was observed in the form of partial or complete regression of tumor screenings in the vitreous, a decrease in the dissemination rate of tumor foci on the retina was revealed.
With systemic polychemotherapy, the effect remained stable, when it was impossible to carry out systemic chemotherapy, the positive effect was temporary, which necessitated repeated IVHT or local treatment methods. After the procedure, in 2 cases, a short-term decrease in vision was observed, associated with retinal edema and optic disc, and central vein thrombosis, which takes place after the instillation of anti-inflammatory drugs and dehydration therapy. In 2 cases, the existing preretinal hemorrhage increased. In all cases in the fundus revealed chorioretinal dystrophic changes.
Conclusions. Despite the identified side effects, IVHT is a valuable method of treating advanced forms of retinoblastoma with an endophytic growth pattern and massive dissemination of tumor cells in the retina, as part of the combined treatment of retinoblastoma groups D and E.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.