Роль химиоперфузии конечности при метастатической меланоме кожи
- Аннотация
- Статья
- Ссылки
- English




Меланома кожи не относится к числу наиболее распространенных злокачественных новообразований. Так, в 2014 г. в России зарегистрировано 9493 новых случая меланомы кожи и 3558 смертей от нее [1]. Однако прирост стандартизованного показателя заболеваемости меланомой с 2004 по 2014 г. составил 17,27%. У 5–8% больных меланомой по мере прогрессирования опухолевого процесса развиваются транзитные метастазы [2]. Они являются результатом попадания опухолевых эмболов в кожные и подкожные лимфатические узлы и развиваются в области между очагом первичной опухоли и дренирующим бассейном регионарных лимфатических узлов. Время от момента диагностирования первичной опухоли до появления транзитных метастазов составляет в среднем от 13 до 16 месяцев.
К факторам риска развития транзитных метастазов меланомы кожи относят большую толщину первичной меланомы (более 1 мм), изъязвление опухоли, лимфососудистую инвазию, вовлечение регионарных лимфатических узлов, локализацию опухоли на нижней конечности [3–5]. Наличие транзитных метастазов коррелирует с III стадией меланомы, которая в зависимости от наличия изъязвления первичной опухоли и одновременного вовлечения регионарных лимфатических узлов подразделяется на IIIB и IIIC стадии. Прогноз при данных стадиях неблагоприятный – общая пятилетняя выживаемость пациентов достигает 20–60% [4, 6, 7].
Золотым стандартом лечения транзитных метастазов меланомы считается хирургическая резекция. Подобная операция технически выполнима, если метастазы представлены одним или единичными поражениями, что делает возможным резекцию с последующим закрытием раны. Однако когда транзитные метастазы представляют собой множественные обширные поражения конечности, хирургическая резекция может быть ассоциирована с серьезными осложнениями или значительной деформацией пораженной конечности, что нередко приводит к отказу от данного метода лечения [8].
Возможности системной химио- (дакарбазин, темозоломид и др.) и иммунотерапии (интерфероны, интерлейкин 2), как правило, ограниченны при транзитных метастазах меланомы кожи. Лечение отличается выраженной токсичностью [8]. Данное обстоятельство подтолкнуло ученых к поиску новых лечебных методик, позволяющих доставлять высокие концентрации противоопухолевых препаратов в пораженную конечность при минимальном риске системной токсичности. Изоляция пораженной конечности (транзитные метастазы по определению находятся в пределах конечности) от системного кровообращения должна способствовать реализации данной концепции. В 1958 г. O. Creech и E.T. Krementz разработали и применили на практике технологию, получившую название изолированной регионарной перфузии (ИРП) [9].
Техника и режимы изолированной регионарной перфузии
Пораженную конечность можно изолировать путем хирургического доступа к подвздошным, бедренным, подколенным, подмышечным или плечевым артериям и венам. Магистральные для пораженного региона сосуды клипируются и канюлируются проксимальнее уровня локализации опухоли, после чего канюли подключаются к замкнутому перфузионному контуру. Для достижения максимальной изоляции конечности проксимальнее уровня канюляции накладывается пневматический жгут [2, 10]. Длительность перфузии обычно составляет для верхней конечности 30 минут, для нижней – 60 минут.
Стандартным препаратом для ИРП является мелфалан с оптимальным профилем эффективности и токсичности для данной методики [11]. При ИРП удается достичь 20-кратной концентрации лекарственного препарата в пораженной конечности по сравнению с концентрацией, создаваемой системной химиотерапией [12]. Стандартными дозами мелфалана при ИРП для нижней и верхней конечностей считаются 10 и 13 мг/л объема конечности соответственно [2].
В 1990-х гг. D. Lienard и соавт. показали, что фактор некроза опухоли (ФНО) альфа, системное введение которого во многом не оправдало ожиданий из-за серьезных побочных эффектов, может безопасно использоваться в условиях ИРП и повышать уровень ответа на лечение как при меланоме кожи, так и при саркоме мягких тканей конечности [13]. С тех пор комбинацию мелфалана и ФНО-альфа стали широко применять при ИРП у пациентов с транзитными метастазами меланомы кожи. ФНО-альфа используют в дозе 2 мг для нижней конечности, в дозе 1 мг – для верхней конечности.
Гипертермия является важным компонентом методики ИРП, поскольку обладает самостоятельным цитотоксическим действием, а также усиливает захват лекарственных препаратов опухолевыми клетками [14, 15]. Температура перфузата в диапазоне 41,5–43 оС считается наиболее эффективной с точки зрения увеличения ответа на лечение [16], в то же время часто приводит к развитию тяжелых послеоперационных осложнений (вплоть до ампутации конечности) и характеризуется выраженной токсичностью [17]. Именно поэтому в клинической практике температуру перфузата при ИРП обычно поддерживают на уровне 40–41 оС [10, 18].
Чтобы обеспечить минимальное системное воздействие химиопрепарата, циркулирующего в изолированном перфузионном контуре, необходимо следить за скоростью циркуляции перфузата и отсутствием утечек.
Кроме того, ИРП рекомендуется проводить в условиях оксигенации, чтобы поддерживать нормальную оксигенацию и рН изолируемой области [8].
По окончании перфузии проводят промывку перфузионного контура физиологическим раствором, чтобы предотвратить попадание оставшейся дозы противоопухолевого препарата в системный кровоток после деканюляции и удаления пневматического жгута с конечности.
Безопасность и эффективность изолированной регионарной перфузии
Осложнения ИРП подразделяют на системную токсичность, обусловленную утечкой препарата в системный кровоток, и местную.
Сегодня, когда ИРП выполняется опытными хирургами в специализированных онкологических центрах, случаи возникновения клинически значимой утечки противоопухолевых препаратов (более 10% введенной дозы) крайне редки, поэтому серьезные проявления системной токсичности также регистрируются редко [2].
Местная токсичность ИРП оценивается в соответствии со схемой, предложенной J. Wieberdink и соавт. [19]. Риск ампутации конечности после ИРП (5-я степень токсичности) низкий – 0–2%. Токсичность 3-й и 4-й степени регистрируется у 4–26% пациентов. В большинстве случаев после ИРП отмечается 1-я (нет реакции) или 2-я (умеренная эдема/эритема) степень токсичности [20].
Поскольку вопрос об эффективности ИРП в качестве адъювантной терапии остается спорным [21–24], данная методика используется преимущественно для улучшения локального контроля над заболеванием, а также с паллиативной целью для купирования местных симптомов. ИРП позволяет добиться у пациентов с транзитными метастазами меланомы кожи конечности ответа на лечение, которого не удается достичь при использовании других методик: частота полных ответов составляет 26–91%, частичных – 9–50%. Общая частота ответов на лечение – 69–100% (табл. 1) [20, 25–33].
Следует отметить, что ИРП показывает лучшие результаты по сравнению с другой методикой регионарного лечения меланомы кожи – изолированной регионарной инфузией. Преимуществом последней перед ИРП считается малоинвазивность [20].
Систематический обзор 22 исследований подтвердил эффективность добавления ФНО-альфа к мелфалану: средняя частота полных ответов у 556 пациентов, получавших при ИРП комбинацию ФНО-альфа и мелфалана, составила 68,9% против 46,5% у 562 больных, у которых ИРП выполнялась только с мелфаланом [34].
Частота рецидивов после ИРП достигает 50%, а длительность ответа на лечение, как правило, превышает один год [35]. В случае рецидива предлагается использовать такую же тактику, как и для транзитных метастазов меланомы в целом: местное иссечение опухоли, если это технически выполнимо, а при распространенном процессе – повторную ИРП. В нескольких исследованиях показано, что у определенной категории пациентов терапевтический эффект повторной ИРП не уступает эффекту первой процедуры [36, 37].
Отсутствие клинических исследований, посвященных сравнительной оценке отдаленных результатов ИРП с результатами других методов лечения, не позволяет сделать вывод об эффективности методики с точки зрения увеличения выживаемости больных. Медиана общей выживаемости пациентов после ИРП составляет около двух лет, причем данная величина коррелирует с ответом на лечение [35]. По данным одноцентрового клинического исследования с участием 103 пациентов с транзитными метастазами меланомы кожи, пятилетняя общая выживаемость больных после ИРП составила 26%, безрецидивная – 12% [38].
Материал и методы исследования
В исследование изолированной регионарной перфузии конечности, проведенное в НИИ онкологии им. Н.Н. Петрова, были включены 24 пациента с меланомой кожи конечности (табл. 2), которым в период с 2004 по 2014 г. в отделении общей онкологии им. Н.Н. Петрова была выполнена ИРП.
16 больным с множественной диссеминацией транзитных метастазов меланомы кожи ИРП конечности была проведена в индукционном режиме, восьми больным меланомой кожи конечности – в адъювантном режиме (после широкого иссечения местного рецидива или одиночного транзитного метастаза).
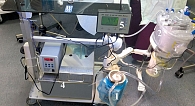
ИРП выполнялась по следующей методике [10, 39]. На первом этапе выделялись, канюлировались и клипировались магистральные для пораженного региона сосуды проксимальнее уровня локализации опухоли. Одновременно с данными манипуляциями системно вводили гепарин из расчета 100 ЕД/кг. Далее резервуар заполняли перфузатом – 500 мл 0,9%-ного раствора NaCl, содержащего 5000–10 000 ЕД гепарина. Для предупреждения сброса цитостатика в системный кровоток через коллатеральное кровообращение накладывали жгут проксимальнее уровня канюляции. Затем изолированную сосудистую сеть подсоединяли к перфузионному контуру (рис. 1).
Температура перфузата во время ИРП составляла 40–41оС. В качестве противоопухолевого препарата использован мелфалан, доза которого рассчитывалась как 10 мг/л объема нижней конечности и 13 мг/л объема верхней конечности. Во время перфузии проводили непрерывный мониторинг не только температуры, но и рН-перфузата с помощью рН-метра в составе технической перфузионной установки.
Для определения степени сброса мелфалана в системный кровоток в процессе ИРП конечности у десяти больных на 5-й, 30-й и 60-й минутах перфузии осуществлялся забор перфузата из замкнутого контура (2 мл) и венозной крови (2 мл). Полученные образцы исследовали на базе ФГБОУ ВПО «Санкт-Петербургский политехнический университет» ООО «Центр коллективного пользования „Аналитическая спектрометрия“» методом высокоэффективной жидкостной хроматографии, масс-спектрометрии. Точное содержание мелфалана в биологических пробах определяли по количеству его более устойчивого конечного продукта – дигидроксимелфалана (ДГМ). Содержание ДГМ полностью соответствовало количеству мелфалана в биологических средах.
В послеоперационном периоде регулярно контролировали общее состояние больных и показатели лабораторных исследований. Степень местной токсичности оценивали по системе J. Weiberdink и соавт. [19]. Системное токсическое действие на организм определяли по шкале токсичности (критерии СТС NCIC) [40]. Пациенты, которым ИРП была выполнена в неоадъювантном режиме, через две-три недели были подвергнуты контрольному объективному и инструментальному обследованию, по результатам которого оценивали эффект лечения.
Статистическая обработка полученных результатов была проведена с помощью пакетов программ IBM SPSS Statistics 20.0 и GraphPad.
Результаты и их обсуждение
Интраоперационных осложнений при проведении ИРП не зафиксировано. На рис. 2 представлены результаты рН-метрии перфузата при ИРП нижней конечности.
Резкий скачок в значении рН произошел в первые пять минут перфузии, когда кровь из изолированной области смешивалась с физиологическим раствором, которым предварительно был заполнен перфузионный контур. Далее на протяжении ИРП показатель рН перфузата менялся незначительно и в среднем составлял 7,19 ± 0,40. В норме pH крови человека поддерживается в пределах 7,35–7,47. Таким образом, уровень рН в изолированном контуре не отличается от физиологических значений, что является одним из подтверждений безопасности процедуры ИРП и косвенным доказательством достаточности оксигенации перфузируемого региона.
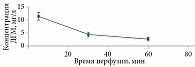
При анализе образцов перфузионного раствора установлено, что в процессе ИРП конечности концентрация мелфалана уменьшалась и к моменту завершения процедуры составляла в среднем 3,3% исходной дозы (рис. 3). Несмотря на клипирование магистральных сосудов перфузируемой конечности и циркулярное наложение жгута выше места канюлирования сосудов, при проведении ИРП конечности у всех больных отмечался сброс цитостатика в системный кровоток (рис. 4).
В процессе ИРП конечности в системный кровоток четырех больных (из десяти, у которых брали пробы) попало менее 1,0 мг мелфалана. У оставшихся шести пациентов в крови было обнаружено от 1 до 1,6 мг мелфалана. Относительно используемых доз системный сброс мелфалана в проведенном исследовании не превысил 1,6%, что подтверждает незначительный уровень системной утечки во время ИРП. Полученные данные позволяют говорить о том, что концентрация мелфалана в перфузионном растворе в процессе ИРП конечности снижалась в основном за счет его накопления в мягких тканях конечности и опухолевых тканях.
Несмотря на использование более высоких доз мелфалана для ИРП, системная токсичность не отличалась от таковой при стандартных схемах химиотерапии. Системная токсичность у больных после проведения ИРП была обусловлена сбросом через многочисленные сосудистые коллатерали цитостатика из замкнутого контура в системный кровоток. Частота возникновения гранулоцитопении 3–4-й степени составила 29%, тромбоцитопении 3–4-й степени – 22%. При этом в 36% случаев показатели тромбоцитов крови оставались в пределах нормальных значений. Анемия 3–4-й степени зафиксирована у 45% больных. Однако основной причиной анемии, наблюдаемой с первых дней послеоперационного периода, была интраоперационная кровопотеря – в среднем 930 мл (диапазон 400–2800 мл). Такая выраженная кровопотеря была связана с методикой выполнения ИРП, в основном из-за кровопотери при канюлировании сосудов и процедуре отмывания, когда происходит потеря раствора, содержащего как цитостатик, так и форменные элементы крови.
Из симптомов местной токсичности чаще регистрировались отек конечности, гиперемия кожи, боли по ходу сосудов, парестезия.
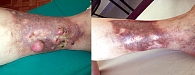
Важный момент: у некоторых пациентов ИРП приводила к полному или частичному местному разрешению опухолевого процесса (рис. 5).
Медиана наблюдения пациентов с меланомой кожи конечностей составила 23 месяца (5–50 месяцев). В ходе динамического наблюдения из 24 больных живы восемь, из них четверо − без признаков опухолевого процесса, четверо – с наличием местно-распространенного опухолевого процесса без признаков отдаленного метастазирования (у одного больного местное прогрессирование опухолевого процесса). 16 больных в период динамического наблюдения умерли в результате прогрессирования и дальнейшей генерализации опухолевого процесса. Медиана безрецидивной выживаемости после выполнения ИРП составила 13 ± 4,2 месяца, годичная безрецидивная выживаемость – 54%, двух- и трехлетняя – 35%, четырехлетняя – 26%. Общая годичная выживаемость пациентов с меланомой кожи конечностей после выполнения ИРП достигла 83%, общая двух-, трех- и четырехлетняя выживаемость – 46,5, 33 и 25% соответственно. Полученные результаты соотносятся с литературными данными об отдаленных результатах ИРП у больных меланомой кожи конечности [35].
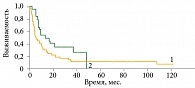
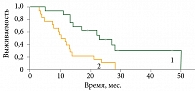
Результаты лечения сравнивали у больных меланомой кожи конечностей, у которых совместно с хирургическим вмешательством выполнялась ИРП, и у пациентов без нее (контрольная группа). Контрольную группу составили 54 пациента с меланомой кожи конечностей, которым проведено хирургическое либо комбинированное лечение без применения ИРП. Годичная безрецидивная выживаемость больных, получавших ИРП, достигла 54%, двух- и трехлетняя – 35%, четырехлетняя – 26%, медиана безрецидивной выживаемости – 13,0 ± 4,2 месяца. В то же время у пациентов контрольной группы, которым было проведено специализированное лечение без ИРП, показатель годичной безрецидивной выживаемости составил 29%, двухлетней – 18,5%, трех- и четырехлетней – 11%, медиана периода без прогрессирования – 4,9 ± 0,9 месяца (рис. 6), что было достоверно ниже, чем в группе с ИРП.
Аналогичная ситуация имела место при анализе общей выживаемости больных меланомой кожи конечности. Общая годичная выживаемость пациентов, получавших комбинированное лечение по поводу множественной диссеминации транзитных метастазов меланомы кожи конечностей с ИРП без полного удаления опухолевых узлов, составила 87%, двухлетняя – 42%, трехлетняя – 25%. При этом показатель общей годичной выживаемости пациентов с множественной диссеминацией транзитных метастазов меланомы кожи конечностей, получавших паллиативное лечение без ИРП, составил 35%, двухлетней – 6% (рис. 7).
Таким образом, нам удалось показать, что ИРП действительно эффективна с точки зрения улучшения отдаленных результатов лечения пациентов с метастатической меланомой кожи конечности при использовании в качестве адъювантной терапии.
Заключение
Лечение транзитных метастазов меланомы кожи остается сложной задачей для онкологов во всем мире. За последние 50 лет изолированная регионарная перфузия зарекомендовала себя как безопасная и эффективная технология и стала важной составляющей мультимодального подхода к лечению больных меланомой кожи конечностей.
Будучи одной из разновидностей регионарной химиотерапии, ИРП позволяет добиваться хорошего терапевтического ответа, превосходящего таковой системной химиотерапии. Кроме того, ИРП эффективна у пациентов, у которых возможности других методов лечения исчерпаны.
Несмотря на то что основными показаниями к применению ИРП остаются местный контроль над злокачественным процессом и облегчение местных симптомов заболевания, данная методика, как показывает наш опыт и опыт некоторых зарубежных авторов, может быть весьма эффективна в адъювантных условиях после иссечения опухолевых очагов. Для подтверждения данных результатов требуется проведение сравнительных клинических исследований, по итогам которых место ИРП среди существующих подходов к лечению метастатической меланомы кожи может быть пересмотрено.
G.I. Gafton, K.Yu. Senchik, G.S. Kireyeva, V.G. Petrov, V.V. Semiglazov, Yu.V. Semiletova, I.G. Gafton, G.V. Zinovyev
N.N. Petrov Research Institute of Oncology, Saint-Petersburg
Contact person: Georgy Ivanovich Gafton, doc-tor@mail.ru
Here, various aspects of using isolated limb regional perfusion (ILP) in patients with metastatic skin melanoma of the limbs are discussed in the paper. Standard approaches for performing ILP and description of various perfusion regimens are outlined, and results of using ILP worldwide are analyzed. In addition, personal experience on safety and efficacy of ILP with melphalan in patients with limb skin melanoma are presented. pH-measurement in perfusate as well as pharmacokinetics of melphalan and analyzed post-surgery complications were used to assess ILP safety. Total and relapse free survival was estimated after treatment, and long-term therapeutic outcomes were compared between patients with/without ILP in a combination therapy. It was shown that ILP was efficient as an adjuvant therapy in patients with metastatic skin melanoma of the limbs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.