Возраст
Возраст дебюта СД 2 типа постепенно снижается. Так, в развивающихся странах максимальная частота выявления диабета приходится на возрастную группу 45–64 года, в то время как в развитых странах – 65 лет и старше. Отмечается тревожная тенденция повышения риска развития СД 2 типа у подростков и детей [3]. Снижение возрастного порога заболевания ведет к увеличению частоты ранней смертности, различных осложнений, приводящих к инвалидности, снижению социальной активности и ухудшению качества жизни. Долгосрочные последствия этой эпидемии выливаются в огромные человеческие страдания и экономические затраты.
Осложнения
Исследования показали, что на момент дебюта СД 2 типа около 50% больных уже имеют макро- и микрососудистые осложнения. Возможно, это результат того, что метаболические нарушения возникают гораздо раньше первых клинических проявлений СД, и к моменту постановки диагноза приводят к необратимым сосудистым изменениям. Наиболее драматично развитие центральных форм диабетической нейропатии, к которым относятся острые нервно-психические расстройства на фоне декомпенсации метаболизма (кетоацидоза, лактатацидоза, гиперосмолярного и гипогликемического состояний); острые нарушения мозгового кровообращения – инсульт, преходящие нарушения мозгового кровообращения; прогрессирующая диабетическая энцефалопатия. К истинно диабетической принято относить прогредиентно развивающуюся на фоне нарушений углеводного обмена метаболическую энцефалопатию [1]. Однако выделение «чистой», метаболической формы энцефалопатии при СД весьма проблематично, поскольку с течением заболевания прогрессируют церебральные нарушения, обусловленные развитием сосудистых изменений, артериальной гипертензии и автономной нейропатии. Диабетическая энцефалопатия обычно развивается постепенно, у молодых пациентов ее хронические проявления усугубляются последствиями перенесенных острых гипер- и гипогликемических эпизодов, у пожилых – нарушениями мозгового кровообращения.
Когнитивный дефицит
Как и при других метаболических энцефалопатиях, клинические проявления диабетической энцефалопатии неспецифичны, наиболее часто развивается нарушение когнитивных функций: снижение памяти и внимания, замедление мышления, снижение скорости психических реакций и способности к обучению. Установлена общность механизмов развития когнитивного дефицита при СД и болезни Альцгеймера, больные с СД входят в группу риска развития деменции. Известно, что в процессе старения мозга принимают участие те же патогенетические механизмы, что и при развитии диабетических осложнений, и ключевым фактором здесь является оксидативный стресс. Выявляемые при нейропсихологическом обследовании изменения у больных СД 2 типа более стойкие, чем при СД 1 типа. Чаще всего это нарушения вербальной памяти и процесса обработки информации средней степени выраженности. Иногда при СД выявляются нарушения праксиса, гнозиса, речевых и пространственных функций, зрительной и слуховой памяти, а также нарушения межполушарных взаимодействий с дисфункцией правого полушария [4].
Течение СД сопровождается частыми колебаниями уровня сахара в крови, порой резкими, которым придается очень большое значение в развитии мозговых расстройств. Особенно опасны в этом отношении гипогликемические эпизоды, возникающие во время терапии инсулином или пероральными сахароснижающими средствами. Когнитивный дефицит часто имеет место и у больных с впервые диагностированным СД 2 типа, еще не получавших сахароснижающую терапию, но у которых уже диагностируется энцефалопатия – состояние, которое, по мнению многих ученых, при диабете является неизбежным [5]. В патогенезе диабетической энцефалопатии (как и диабетической полинейропатии) принимают участие целый ряд факторов: сосудистая дисфункция, приводящая к уменьшению кровоснабжения нервов и мозговой ткани, нарушение трофики и прямое токсическое влияние гипергликемии на нервы. Влияние диабета на мозг более выражено у пожилых людей: происходит ускорение обусловленного старением когнитивного снижения и развития энцефалопатии [6].
Влияние гиперинсулинемии
Особым вопросом в общей проблеме СД является влияние инсулина на когнитивные функции. Инсулин, идентичный панкреатическому, и типичные инсулиновые рецепторы широко экспрессируются в разных отделах мозга. Инсулин проникает в мозг посредством рецепторзависимого транспорта через гематоэнцефалический барьер и принимает участие в регуляции энергетического гомеостаза, репродуктивных и когнитивных функций организма. Вопросы, касающиеся нейрональных эффектов инсулина, остаются во многом дискуссионными, однако в последнее десятилетие получены убедительные доказательства того, что инсулин и инсулинрецепторная сигнальная система мозга необходимы для нормального функционирования нейронов. Дисфункция этой системы приводит к развитию нейродегенеративных заболеваний. Было показано, что инсулин и инсулиновые рецепторы играют важную роль в синаптической передаче и могут быть связаны с такими важнейшими функциями мозга, как пищевое поведение, обучение и память [7].
Имеются данные о том, что инсулин может принимать непосредственное участие в реализации некоторых когнитивных функций, а нарушения его метаболизма могут сопровождаться развитием ряда неврологических синдромов и когнитивных расстройств. Помимо выполнения в головном мозге медиаторных функций, инсулин принимает участие в регуляции синтеза белка-предшественника амилоида и продукта его метаболизма β-амилоида – основного компонента амилоидных отложений, а также регулирует фосфорилирование тау-протеина, составляющего основу нейрофибриллярных образований [8]. Таким образом, можно говорить о связи СД 2 не только с сосудистым поражением головного мозга, но и с нейродегенеративным процессом, лежащим в основе деменции, что подтверждается в целом ряде исследований, выявивших эту связь [9]. Гиперинсулинемия может определять когнитивное снижение, а нарушения в системе синтеза и секреции инсулина – негативно влиять на когнитивные функции [10]. Установлено также, что у больных СД 2 типа, получающих инсулин, высок риск развития деменции, которая не просто отражает тяжесть диабета, но и может быть непосредственно связана с назначением инсулинотерапии [11]. Данные последних исследований в области изучения когнитивного здоровья пациентов с СД 2 типа показывают, что резко выраженное снижение когнитивных способностей демонстрируют даже пациенты среднего возраста как в дебюте диабета, так и с небольшой длительностью заболевания [12].
Таким образом, инсулинотерапия или использование средств, чрезмерно стимулирующих секрецию инсулина, с одной стороны ослабляют токсический эффект хронической гипергликемии, с другой стороны приводят к выраженной гиперинсулинемии. Последствиями гиперинсулинемии могут быть прогрессирование ожирения и макрососудистых осложнений, а также связанные с ними нарастающие изменения в синаптических структурах и клеточных мембранах центральной нервной системы, что способствует развитию деменции. В настоящее время нет клинических исследований, где была бы доказана эффективность сахароснижающих препаратов, применяемых в современной терапии СД (особенно 2 типа), в отношении профилактики развития когнитивных нарушений [13].
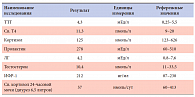
Изучение патофизиологических основ развития СД может дать представление о масштабах распространенности связанных с ним состояний и заболеваний, а также расширить возможности их своевременной коррекции. Развитие нарушений углеводного обмена и их связь с нарушениями жирового обмена В крупных эпидемиологических исследованиях было убедительно показано, что диагностика патологических состояний гипергликемии только по уровню глюкозы крови натощак (рекомендации Американской диабетической ассоциации – ADA) приводит к недооценке истинной распространенности диабета более чем на треть. В настоящее время общепринятыми диагностическими лабораторными критериями СД являются представленные в таблице 1 пороговые уровни гликемии натощак и через 2 часа после нагрузки глюкозой.
Согласно современным представлениям, нарушенная толерантность к глюкозе (НТГ) и нарушенная гликемия натощак (НГН) способны прогрессировать с исходом в СД 2 типа. В 1990-х гг. эксперты ВОЗ предложили использовать новый термин – «предиабет», который объединил НТГ и НГН. Сегодня в мире около 314 млн человек имеют предиабет, через 20 лет их число увеличится в 1,5 раза и составит около 500 млн человек, которые пополнят многомиллионную армию больных сахарным диабетом 2 типа.
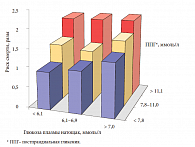
Установлено, что частота развития СД у пациентов с НТГ и НГН примерно одинакова. Поскольку НТГ более распространена в популяциях, чем НГН, именно с первым состоянием связано большее число новых случаев СД. По данным эпидемиологических исследований, вероятность перехода предиабета в СД 2 типа зависит от возраста больного, расовой принадлежности, степени ожирения. В среднем частота развития СД 2 типа у пациентов с предиабетом составляет 5% в год (от 3,6 до 8,7%). При пятилетнем наблюдении за такими больными СД 2 типа развивается у 35–40%, а при сочетании НТГ и НГТ – у 65% пациентов [6]. В этой связи изучению особенностей течения предиабета, его ранней диагностике и возможностей первичной и вторичной профилактики придается большое значение. Врачу любой специальности рекомендуется уделять особое внимание факторам риска развития СД 2 типа (рис. 1) и проводить скрининг (табл. 2), поскольку рано выявленный предиабет и правильные профилактические меры могут повлиять на судьбу пациента.
Главным фактором риска развития СД 2 типа у пациента является наличие избыточного веса, особенно абдоминальное ожирение. В последние десятилетия ученые высказывают предположения об общности заболеваний, ассоциированных с избыточным весом, и различных метаболических нарушений. В 1960-е гг. делались попытки объединения взаимосвязанных метаболических нарушений, ускоряющих развитие макрососудистых атеросклеротических заболеваний и СД 2 типа. В 1988 г. американский ученый Gerald Reaven, объединив нарушения углеводного обмена, артериальную гипертензию и дислипидемию понятием «синдром Х», впервые высказал предположение о том, что общей основой этих нарушений может быть инсулинорезистентность и компенсаторная гиперинсулинемия [14]. В конце прошлого века метаболические нарушения и заболевания, развивающиеся у лиц с ожирением, назвали метаболическим синдромом.
- абдоминальное ожирение;
- инсулинорезистентность и гиперинсулинемия;
- артериальная гипертензия;
- гипертриглицеридемия;
- повышение холестерина липопротеидов низкой плотности (ХС ЛПНП) и снижение холестерина липопротеидов высокой плотности (ХС ЛПВП);
- нарушение толерантности к глюкозе и/или нарушенная гликемия натощак;
- нарушения системы гемостаза;
- хроническое сосудистое воспаление.
В настоящее время существуют 5 групп диагностических критериев МС. Отечественными учеными, экспертами Всероссийского научного общества кардиологов (ВНОК) были разработаны и опубликованы критерии метаболического синдрома [25]. Основной критерий: центральный (абдоминальный) тип ожирения – окружность талии (ОТ) более 80 см у женщин и более 94 см у мужчин.
Дополнительные критерии:
- артериальная гипертония (АД ≥ 130/85 мм рт. ст.);
- повышение уровня триглицеридов (≥ 1,7 ммоль/л);
- снижение уровня ХС ЛПВП (< 1,0 ммоль/л у мужчин; < 1,2 ммоль/л у женщин);
- повышение уровня ХС ЛПНП > 3,0 ммоль/л;
- гипергликемия натощак (глюкоза в плазме крови натощак ≥ 6,1 ммоль/л);
- нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 часа после нагрузки глюкозой в пределах ≥ 7,8 и ≤ 11,1 ммоль/л).
Наличие у пациента центрального ожирения и двух дополнительных критериев является основанием для диагностирования у него метаболического синдрома. Сочетание нарушений, объединенных понятием «метаболический синдром», в значительной степени ускоряет развитие и прогрессирование заболеваний, связанных с атеросклерозом. Кроме этого, многие исследователи рассматривают МС как прелюдию сахарного диабета 2 типа: риск развития СД 2 типа у пациентов с МС в среднем в 5–9 раз выше, чем у лиц без него [15]. По данным статистики, у больных с впервые диагностированным СД 2 типа уже при первом обращении к врачу выявляются макро- и микрососудистые осложнения этого заболевания: нарушение зрения (диабетическая ретинопатия), нарушение функции почек (диабетическая нефропатия), поражение сосудов сердца, мозга, сосудов нижних конечностей и др. А при развившемся СД 2 типа риск развития сердечно-сосудистых заболеваний (ССЗ) в 3–4 раза выше, чем без него [16]. Именно эти осложнения являются основной причиной высокой инвалидизации и смертности больных СД 2 типа (до 70% пациентов умирают от инфаркта миокарда или инсульта и их последствий).
Механизмы развития ССЗ и СД 2 типа у пациентов с МС
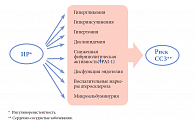
Ключевым звеном патогенеза метаболического синдрома является первичная инсулинорезистентность (ИР) и компенсаторная гиперинсулинемия (ГИ). Инсулинорезистентность – это нарушение инсулинопосредованной утилизации глюкозы клетками. ИР – состояние, сопровождающее целый ряд физиологических и патологических процессов. Физиологическая ИР выявляется в пубертатном периоде, при беременности, в климактерическом периоде, во время ночного сна, при богатой жиром диете. Метаболическая ИР характерна для метаболического синдрома, СД 2 типа, декомпенсированного СД 1 типа, диабетического кетоацидоза, ожирения, выраженной недостаточности питания, гиперурикемии, индуцированной инсулином гипогликемии, алкоголизма. Эндокринная ИР отмечается при тиреотоксикозе, гипотиреозе, синдроме Кушинга, акромегалии, феохромоцитоме. Неэндокринная ИР типична для гипертонической болезни, хронической почечной недостаточности, цирроза печени, сердечной недостаточности, ревматоидного артрита, черного акантоза, миотонической дистрофии, раковой кахексии, а также наблюдается при травмах, ожогах, сепсисе, состояниях после хирургических вмешательств.
Наибольшее клиническое значение имеет потеря чувствительности к инсулину мышечной, жировой и печеночной тканей. Предполагают, что причиной ускоренного атерогенеза и высокой летальности от ишемической болезни сердца и инсультов у больных СД 2 типа также могут быть ИР и сопутствующая ей ГИ. У пациентов с ИР имеются дефекты генов, ответственных за передачу сигнала после соединения инсулина со своим рецептором (пострецепторные дефекты): прежде всего у них нарушается транслокация и синтез внутриклеточного транспортера глюкозы GLUT-4. Кроме того, у пациентов с ИР могут быть обнаружены дефекты генов, кодирующих субстрат рецептора инсулина типа 1 и/или фосфатидилинозитол-3-киназу, а также нарушение экспрессии других генов, обеспечивающих метаболизм глюкозы и липидов – глюкозо-6-фосфатдегидрогеназы, глюкокиназы, липопротеинлипазы, синтазы жирных кислот и др.
Генетическая предрасположенность к ИР может не реализоваться и не проявиться клинически (в виде метаболического синдрома и/или СД 2 типа) при отсутствии необходимых для этого внешних факторов – избыточного калорийного питания (особенно жирной пищи) и низкой физической активности. Эти факторы сами по себе способствуют развитию абдоминального ожирения, накоплению свободных жирных кислот и, следовательно, усилению имеющейся ИР. Вызванная инсулинорезистентностью компенсаторная ГИ позволяет какое-то время поддерживать углеводный обмен в норме, но вместе с тем способствует развитию метаболических, гемодинамических и органных нарушений, что в конечном итоге приводит к сердечно-сосудистым заболеваниям и СД 2 типа.
ИР мышечной ткани проявляется в снижении поступления глюкозы из крови и утилизации ее миоцитами. ИР жировой ткани выражается в том, что адипоциты становятся нечувствительными к антилиполитическому действию инсулина, что способствует выходу в кровь свободных жирных кислот и глицерина. Свободные жирные кислоты поступают в печень, где становятся основным источником формирования атерогенных липопротеинов очень низкой плотности. ИР ткани печени характеризуется снижением синтеза гликогена и активацией процессов распада гликогена до глюкозы (гликогенолиз) и синтеза глюкозы de novo из аминокислот, лактата, пирувата, глицерина (глюконеогенез), в результате чего глюкоза из печени поступает в кровоток. В целом, ИР – это эволюционно закрепленный механизм выживания в неблагоприятных условиях, когда периоды изобилия чередовались с периодами голода. Наличие ИР обеспечивало накопление энергии в виде отложений жира, запасов которого хватало на то, чтобы пережить голод [17]. В странах с высоким экономическим развитием, где созданы условия пищевого изобилия и люди нередко ведут малоподвижный образ жизни, сохранившиеся в их генетической памяти механизмы ИР продолжают работать на накопление энергии, что способствует развитию абдоминального ожирения, дислипидемии, раннему атеросклерозу, артериальной гипертензии и СД 2 типа.
К настоящему времени проведено более 10 клинических исследований с участием не менее 15 тыс. человек. Результаты опубликованных работ позволяют утверждать, что инсулинорезистентность и сопутствующая ей гиперинсулинемия являются факторами риска ускоренного атерогенеза и высокой летальности от ишемической болезни сердца (ИБС). Имеется достаточно клинических доказательств того, что гиперинсулинемия является независимым фактором риска развития ИБС у лиц без СД 2 типа: Paris prospective study (около 7 000 обследованных), Busselton (более 1 000 обследованных) и Helsinki Policemen Study (982 обследованных) [18]. В последние годы это подтверждено и в исследованиях с участием больных СД 2 типа. Robert W. Stout показал, что инсулин оказывает прямое атерогенное действие на стенки сосудов, вызывая пролиферацию и миграцию гладкомышечных клеток, синтез липидов в них и пролиферацию фибробластов. Таким образом, ИР и ГИ вносят весомый вклад в прогрессирование атеросклероза как у лиц без СД, так и у больных СД 2 типа [19].
ИР играет существенную роль в развитии артериальной гипертензии (АГ). Взаимосвязь гиперинсулинемии и эссенциальной АГ настолько прочна, что при высокой концентрации инсулина плазмы можно прогнозировать у больного развитие в скором времени АГ. Эта связь прослеживается как у больных с ожирением, так и у лиц с нормальной массой тела.
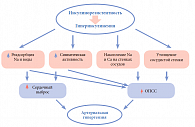
Существуют несколько механизмов, объясняющих повышение АД при гиперинсулинемии (рис. 3). Инсулин способствует активации симпатической нервной системы, повышению реабсорбции Na и воды в почечных канальцах, внутриклеточному накоплению Na и Ca; как митогенный фактор инсулин активирует пролиферацию гладко-мышечных клеток сосудов, что ведет к утолщению сосудистой стенки. Механизм влияния инсулина на симпатическую нервную систему (СНС) до конца не ясен. Предполагают, что инсулин может активировать СНС путем прямого воздействия на центральную нервную систему, проникая через гематоэнцефалический барьер в перивентрикулярную область гипоталамуса, где, связываясь со своими рецепторами на поверхности нейронов, блокирует активность парасимпатической нервной системы и, напротив, активирует СНС. Gerald M. Reavean предположил, что причиной гиперактивации СНС в условиях гипергликемии может быть повышенный метаболизм глюкозы в ядрах гипоталамуса, что тормозит передачу блокирующих импульсов на симпатические центры продолговатого мозга.
Стимуляция СНС при гиперинсулинемии сопровождается увеличением сердечного выброса, повышением общего периферического сосудистого сопротивления, что неизбежно приводит к повышению АД. Одновременное снижение активности парасимпатической системы, вызванное гиперинсулинемией, увеличивает частоту сердечных сокращений. Инсулин оказывает прямое воздействие на проксимальные канальцы нефронов, поэтому в условиях гиперинсулинемии происходит повышение реабсорбции натрия, калия, уратов и воды. В результате увеличивается объем циркулирующей жидкости, что приводит к повышению сердечного выброса.
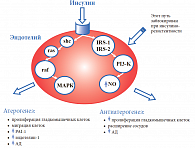
Внутриклеточное накопление Na+ и Ca2+ – эффект действия инсулина. Инсулин блокирует активность натрий-калий-АТФ-азы и кальций-магний-АТФ-азы клеточных мембран, что приводит к повышению внутриклеточного содержания Na+ и Ca2+. Вследствие накопления этих электролитов в стенке сосудов повышается чувствительность сосудистых рецепторов к действию сосудосуживающих факторов. Под влиянием инсулина происходит утолщение стенки сосудов. Митогенные свойства инсулина обнаружены достаточно давно в серии экспериментальных работ, где было показано, что он стимулирует клеточный рост, пролиферацию и миграцию гладкомышечных клеток сосудов, приводит к утолщению их стенки. В норме инсулин, связываясь с рецепторами на поверхности клеток эндотелия, может действовать двумя различными путями (рис. 4).
Первый путь – это активация секреции оксида азота (NO) через субстраты инсулиновых рецепторов 1 и 2 (IRS-1 и IRS-2) и фосфатидилинозитол-3-киназу (PI3-K). Этот механизм обеспечивает сосудорасширяющие и антиатерогенные свойства инсулина, участвует в инсулинзависимом транспорте глюкозы в клетки. Второй путь – реализация митогенных свойств инсулина через каскад посредников (адаптивный белок (shc), белок, связывающий shc (ras), киназа серин-треонина (raf)), повышающих активность митоген-активированной протеинкиназы (МАРК), что завершается пролиферацией и миграцией гладкомышечных клеток, активацией синтеза сосудосуживающего фактора эндотелина-1 и повышением АД. Оказалось, что в условиях ИР первый механизм не работает – именно этот путь резистентен к действию инсулина, следовательно, молекула NO не синтезируется. В то же время второй механизм сохраняет свою высокую активность. По этой причине гиперинсулинемия, развивающаяся вследствие ИР (при метаболическом синдроме, СД 2 типа, висцеральном ожирении), не только не снижает АД, а напротив, оказывает гипертензивное и атерогенное действие.
Существует взаимосвязь между активностью ренин-ангиотензиновой системы, уровнем АД и чувствительностью тканей к инсулину. Хорошо известно, что гиперактивность ренин-ангиотензиновой системы стойко поддерживает высокое АД. Однако лишь недавно в экспериментальных условиях получены убедительные данные о том, что ангиотензин II (АТ II) дозозависимо ингибирует пострецепторную сигнальную систему инсулина (комплекс IRS-1 и IRS-2, связанный с PI3-K), реализующую транспорт глюкозы в клетки и продукцию NO [18]. Одновременно АТ II стимулирует МАРК, задействованную в осуществлении митогенной и пролиферативной активности инсулина. Таким образом, гиперактивность ренин-ангиотензиновой системы и АТ II вызывает резистентность тканей к антиатерогенному и гипотензивному действию инсулина, что приводит к развитию сердечно-сосудистых заболеваний, а также блокирует транспорт глюкозы в клетки, способствуя развитию предиабета, а затем и СД 2 типа.
Возможность профилактики развития СД 2 типа
Проспективное исследование UKPDS (U.K. Prospective Diabetes Study) позволило проанализировать прогрессирование СД 2 типа в течение более 10 лет. Было установлено, что к моменту клинического дебюта СД 2 типа только 50–60% от всей массы β-клеток поджелудочной железы продолжают активно секретировать инсулин – это первая из причин заболевания (рис. 5) [20]. Таким образом, метаболические нарушения, ведущие к развитию СД 2 типа, реально развиваются задолго до клинического дебюта диабета. Примерно за 5–6 лет до манифестации диабета (при снижении функциональной способности β-клеток до 75%) можно диагностировать предиабет – нарушенную толерантность к глюкозе или сочетание НТГ и НГН.
Второй основной причиной развития СД 2 типа является сниженная чувствительность мышечной и жировой тканей, а также печени к действию эндогенного инсулина. Инсулинорезистентность тканей, существующая задолго до дебюта заболевания, приводит к истощению эндогенных запасов инсулина. Функциональная активность β-клеток поджелудочной железы к моменту клинической манифестации СД 2 типа снижается на 50%, что и приводит к повышению уровня гликемии. Долгое время (иногда в течение нескольких лет) больной субъективно может не ощущать признаков гипергликемии, то есть заболевание протекает бессимптомно. В то же время сосудистые осложнения сахарного диабета, в том числе и энцефалопатия, уже начинают развиваться, что обусловлено быстрым прогрессированием постпрандиальной гипергликемии, которая имеет большое значение в развитии сердечно-сосудистой патологии.
Постпрандиальная гипергликемия (уровень глюкозы плазмы крови после приема пищи) является самостоятельным фактором риска развития сердечно-сосудистых осложнений и преждевременной смерти, как показали результаты крупных международных исследований [21]. В исследовании DECODE использовались данные ряда проспективных крупномасштабных исследований, проводившихся в Европе. На основании их анализа было показано, что более высокий риск сердечно-сосудистой смертности наблюдался у пациентов с повышением постпрандиального уровня глюкозы более чем 11,1 ммоль/л, независимо от уровня гликемии натощак (рис. 6).
Как было отмечено выше, начало СД 2 типа характеризуется не только выраженными нарушениями чувствительности тканей к инсулину, но и недостаточностью функции β-клеток поджелудочной железы, которая не может компенсировать инсулинорезистентность путем повышения секреции инсулина. Эти изменения на стадии клинических проявлений СД безусловно необратимы, поэтому даже раннее начало лечения СД 2 типа не может привести к полному выздоровлению, однако применение лекарственных средств, устраняющих влияние основных патогенетических механизмов – главным образом ИР – необходимо на любом этапе развития углеводных нарушений. В то же время, если начать профилактические мероприятия до дебюта СД 2 типа – на этапе предиабета, то можно предотвратить развитие и прогрессирование заболевания и сопутствующих ему тяжелых осложнений. Профилактика и современная терапия СД обусловлена патогенезом, поэтому основывается на применении одних и тех же препаратов и методов.
Рекомендации по немедикаментозному лечению включают коррекцию образа жизни: соблюдение диеты, регулярные физические нагрузки – меры, направленные на снижение массы тела, инсулинорезистентности, нормализацию артериального давления, липидных нарушений и восстановление углеводного обмена. В случае низкой приверженности пациентов к немедикаментозным методам коррекции, а также при их неэффективности оправдано применение препаратов, улучшающих чувствительность тканей к инсулину, что облегчает поступление глюкозы в клетки без дополнительной ГИ. К таким препаратам в первую очередь относится метформин, эффективность которого в снижении риска развития СД 2 типа была доказана в крупных международных плацебо-контролируемых исследованиях. Важно помнить, что самым эффективным методом лечения СД 2 типа является сочетание медикаментозной коррекции с изменением образа жизни.
Профилактика развития деменции у пациентов с нарушениями углеводного и жирового обменов
Профилактика любого осложнения, связанного с сахарным диабетом, особенно 2 типа, является непростой задачей, поскольку здесь связаны воедино множество факторов: сложный патогенез заболевания и длительное латентное течение СД, не проявляющегося клинически первые 7–8 лет; требующиеся от врача (чаще всего невролога или терапевта) глубокие знания проблемы для проведения дополнительных методов обследования и ранней диагностики заболевания или направления к эндокринологу. Таким образом, в современной практике диагноз СД 2 типа чаще всего устанавливается одновременно с появлением у пациента первого макроваскулярного осложнения – острого инфаркта или инсульта, которое, собственно, и является поводом для более серьезного обследования.
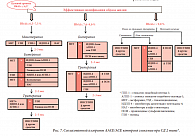
При СД одной из первых поражается центральная и периферическая нервная система. Периферическая полинейропатия и энцефалопатия смешанного генеза (сосудистого и метаболического) приводит к прогрессирующему снижению когнитивной функции и развитию деменции. А если учесть, что терапия СД тоже может неблагоприятно воздействовать на когнитивные функции у пациента, меры по профилактике церебральных нарушений должны быть более активными. По этой причине предупреждение развития осложнений у таких пациентов предполагает раннюю диагностику самого диабета и применение патофизиологического подхода к лечению. На съезде Международной федерации диабета (2009) Американская ассоциация клинических эндокринологов (American Association of Clinical Endocrinologists – AACE) представила новый алгоритм терапии СД 2 типа, использующий разумный патогенетический подход к лечению таких пациентов (рис. 7) [22].
Данная стратегия включает обязательное на первом этапе терапии снижение массы тела у всех пациентов с СД 2 типа на 5–10% от исходного значения. Препаратами первой линии для нормализации уровня гликемии являются антигипергликемические средства с отсутствием риска набора веса и гипогликемии: метформин, глитазоны, ингибиторы α-глюкозидазы, аналоги глюкагоноподобного пептида 1 и ингибиторы дипептидилпептидазы 4. Раннее назначение инсулинотерапии, согласно этому алгоритму, невозможно без этапа правильной антигипергликемической терапии, состоящей из двух или трех препаратов, влияющих на разные этапы развития диабета. Как альтернатива инсулинотерапии (при отсутствии симптомов абсолютной недостаточности инсулина) возможна стартовая комбинированная терапия антигипергликемическими препаратами, причем как у пациентов с субкомпенсацией, так и у пациентов с тяжелой декомпенсацией и уровнем гликированного гемоглобина более 9%.
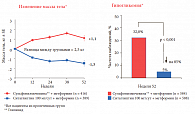
В настоящее время получены данные большого количества международных многоцентровых исследований, сравнивающих эффективность и безопасность разных классов сахароснижающих препаратов. Так, в рандомизированном, двойном слепом, активно контролируемом исследовании в параллельных группах у пациентов с СД 2 типа (n = 1172), не достигших целевого уровня гликемии, сравнивалась эффективность и безопасность комбинированной терапии с добавлением к текущей терапии метформином ≥1500 мг/сут производных сульфонилмочевины (ПСМ) (глипизид) с титрацией до 20 мг/сут или ситаглиптина 100 мг/сут [23].
Длительность терапии составила 52 недели. В отношении снижения уровня гликированного гемоглобина (-0,7%) была доказана сопоставимая эффективность обеих комбинаций, при этом профиль безопасности был достоверно и статистически значимо лучше в группе терапии ситаглиптином + метформин. Случаи гипогликемии были выявлены в 32% в группе добавления ПСМ по сравнению с 5% в группе ситаглиптина. Прибавка массы тела +1,1 кг была зарегистрирована в группе ПСМ по сравнению с -1,5 кг в группе ситаглиптина, общая разница между группами в массе тела составила 2,6 кг (рис. 8) [23]. При непереносимости пациентами метформина или возникновении побочных эффектов при его применении можно назначить стартовую терапию СД 2 типа ситаглиптином. Согласно данным 24-недельного исследования с участием более 1 000 пациентов, в котором сравнивалась эффективность и переносимость ситаглиптина 100 мг/сут по сравнению с метформином 2000 мг/сут, было показано сопоставимое снижение уровня гликированного гемоглобина (разница между группами не была статистически достоверной) (рис. 9) [24].
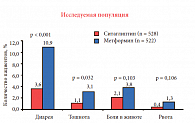
Терапия как ситаглиптином, так и метформином в целом переносилась хорошо: частота развития гипогликемии была низкой при применении обоих препаратов, но при использовании ситаглиптина отмечалась более низкая частота развития нежелательных явлений со стороны желудочно-кишечного тракта по сравнению с метформином, что проявлялось в снижении частоты диареи и тошноты (рис. 10) [24]. Таким образом, сегодня у врача есть выбор – назначить пациенту с СД 2 типа раннюю инсулинотерапию или производные сульфонилмочевины первого поколения, получив сразу целый спектр нежелательных метаболических последствий – от быстрого набора веса до прогрессирования энцефалопатии, или использовать разумный патогенетический подход с учетом индивидуального риска для каждого пациента.
NB