Эффективность и безопасность инициации базальной инсулинотерапии у пожилых пациентов с сахарным диабетом 2 типа и множественными гериатрическими синдромами: результаты наблюдательного исследования в условиях реальной клинической практики
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведено одноцентровое когортное исследование с участием 66 пациентов в возрасте 65 лет и старше с СД 2 типа с уровнем гликированного гемоглобина (HbA1c) выше индивидуальных целевых значений на фоне терапии неинсулиновыми сахароснижающими препаратами (НССП).
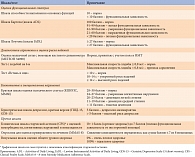
Всем участникам исследования проведено диабетологическое и комплексное гериатрическое обследование.
Пациенты основной группы (n = 39) были переведены на терапию аналогами базального инсулина (БИ) и НССП. Пациентам группы сравнения (n = 27) проведена интенсификация сахароснижающей терапии неинсулиновыми препаратами.
В основной группе в среднем через 23 (20–24) месяца собрана информация о гликемическом контроле, частоте гипогликемических эпизодов, составе сахароснижающей терапии, факте наличия падений и атеросклеротических сердечно-сосудистых заболеваний.
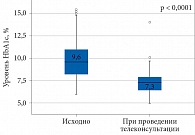
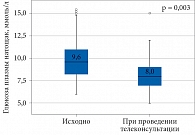
Результаты. Основной причиной выбора аналогов БИ для интенсификации терапии был уровень HbA1c, превышающий индивидуальный целевой более чем на 1,0–1,5% на фоне терапии двумя-тремя НССП. В результате инициации БИТ уровень HbA1c снизился с 9,60 [8,25–10,95] до 7,30 [6,60–7,90]% (p < 0,001), уровень глюкозы плазмы натощак при проведении самоконтроля – с 9,6 [8,0–11,1] до 8,0 [7,0–9,0] ммоль/л (p = 0,003). Индивидуального целого уровня HbA1c достигли 66,6% пациентов. У 35,9% уровень HbA1c составил менее 7,0%. Частота легких гипогликемий на фоне БИТ не увеличилась. Тяжелые гипогликемии отсутствовали.
Выводы. У пожилых пациентов с СД 2 типа и гериатрическими синдромами инициация БИТ аналогами инсулина приводит к длительному улучшению гликемического контроля без увеличения частоты гипогликемических эпизодов. В связи с высоким сахароснижающим потенциалом БИ (избыточное снижение гликемии) может потребоваться пересмотр проводимой терапии, а именно коррекция дозы БИ или даже его отмена.
Материал и методы. Проведено одноцентровое когортное исследование с участием 66 пациентов в возрасте 65 лет и старше с СД 2 типа с уровнем гликированного гемоглобина (HbA1c) выше индивидуальных целевых значений на фоне терапии неинсулиновыми сахароснижающими препаратами (НССП).
Всем участникам исследования проведено диабетологическое и комплексное гериатрическое обследование.
Пациенты основной группы (n = 39) были переведены на терапию аналогами базального инсулина (БИ) и НССП. Пациентам группы сравнения (n = 27) проведена интенсификация сахароснижающей терапии неинсулиновыми препаратами.
В основной группе в среднем через 23 (20–24) месяца собрана информация о гликемическом контроле, частоте гипогликемических эпизодов, составе сахароснижающей терапии, факте наличия падений и атеросклеротических сердечно-сосудистых заболеваний.
Результаты. Основной причиной выбора аналогов БИ для интенсификации терапии был уровень HbA1c, превышающий индивидуальный целевой более чем на 1,0–1,5% на фоне терапии двумя-тремя НССП. В результате инициации БИТ уровень HbA1c снизился с 9,60 [8,25–10,95] до 7,30 [6,60–7,90]% (p < 0,001), уровень глюкозы плазмы натощак при проведении самоконтроля – с 9,6 [8,0–11,1] до 8,0 [7,0–9,0] ммоль/л (p = 0,003). Индивидуального целого уровня HbA1c достигли 66,6% пациентов. У 35,9% уровень HbA1c составил менее 7,0%. Частота легких гипогликемий на фоне БИТ не увеличилась. Тяжелые гипогликемии отсутствовали.
Выводы. У пожилых пациентов с СД 2 типа и гериатрическими синдромами инициация БИТ аналогами инсулина приводит к длительному улучшению гликемического контроля без увеличения частоты гипогликемических эпизодов. В связи с высоким сахароснижающим потенциалом БИ (избыточное снижение гликемии) может потребоваться пересмотр проводимой терапии, а именно коррекция дозы БИ или даже его отмена.

Введение
Сахарный диабет (СД) 2 типа занимает одно из ведущих мест среди хронических заболеваний у лиц пожилого возраста [1]. С возрастом поддержание стабильного гликемического контроля становится особенно сложной задачей, что связано с полиморбидностью, возрастными физиологическими изменениями и развитием гериатрических синдромов, включая когнитивные [1]. На ранних этапах заболевания удовлетворительный гликемический контроль обычно достигается с помощью модификации образа жизни и назначения пероральных сахароснижающих препаратов (ПССП). Однако по мере прогрессирования СД эффективность данной терапии снижается, и значительной доле пациентов требуется интенсификация лечения [2], в частности инициация инсулинотерапии. У пациентов пожилого возраста данный процесс сопровождается рядом проблем. Так, помимо технических и психологических барьеров назначение препаратов инсулина связано с повышенным риском развития гипогликемий, которые в свою очередь могут увеличивать вероятность падений и сопряженных с ними травм, а также усугублять когнитивные нарушения [3].
В консенсусном отчете Американской диабетической ассоциации и Европейской ассоциации по изучению диабета (American Diabetes Association/European Association for the Study of Diabetes) 2022 г. подчеркивается важность индивидуального подхода к выбору целей лечения у пожилых пациентов с СД 2 типа. При этом предлагается дифференцировать целевые уровни гликированного гемоглобина (HbA1c) в зависимости от общего функционального состояния пациента [4, 5].
В реальной клинической практике решение о назначении препаратов инсулина зачастую принимается без учета выраженности гериатрических синдромов и функционального статуса, что приводит как к повышению риска развития гипогликемий, так и к низкой приверженности лечению [6]. Кроме того, данные о связи исходного функционального и когнитивного статуса с необходимостью назначения или пересмотра инсулинотерапии в российской популяции пациентов старшего возраста ограниченны.
Как следствие, клиническую значимость представляет изучение факторов, которые необходимо учитывать при инициации базальной инсулинотерапии (БИТ), а также для обеспечения ее долгосрочной эффективности и безопасности у пожилых пациентов с СД 2 типа.
Целью настоящего исследования стала оценка клинических, функциональных и гериатрических характеристик пожилых пациентов с СД 2 типа, переведенных на БИТ, и ее влияния на гликемический контроль и другие значимые для пожилых пациентов исходы.
Материал и методы
На базе клиники эндокринологии ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» с 2021 по 2023 г. было проведено наблюдательное когортное исследование, состоявшее из двух этапов: первый этап – с 2021 по 2022 г., второй этап – с 2022 по 2023 г. В исследование были включены 66 пациентов с СД 2 типа, проживающих как в Москве, так и в других регионах России.
На первом этапе (при включении в исследование) в соответствии с действующими клиническими рекомендациями по ведению пациентов с СД 2 типа проведены сбор анамнеза, оценка антропометрических показателей, физикальное обследование, анализ данных дневника самоконтроля гликемии, лабораторные и инструментальные исследования [7]. Было также выполнено комплексное гериатрическое обследование с оценкой когнитивного, функционального и эмоционального состояния [8] и социальных характеристик (табл. 1) [9].
Для анализа факторов, ассоциированных с выбором базального инсулина (БИ) для интенсификации сахароснижающей терапии (инициации БИТ), были сформированы две группы:
- основная группа (n = 39) – получающие любые неинсулиновые сахароснижающие препараты (НССП) на момент поступления в стационар с последующей интенсификацией терапии препаратами БИ;
- группа сравнения (n = 27) – получающие любые НССП на момент поступления в стационар с последующей интенсификацией терапии другими ПССП/агонистами рецепторов глюкагоноподобного пептида 1 (ГПП-1).
В качестве препаратов БИ использовали аналоги инсулина длительного или сверхдлительного действия, поскольку они ассоциируются с более низким риском развития гипогликемий по сравнению с препаратами НПХ-инсулина.
На втором этапе в основной группе через 18–24 месяца было проведено телеконсультирование для сбора данных о динамике веса, составе сахароснижающей терапии, гликемическом контроле, частоте гипогликемических эпизодов, факте наличия падений и новых случаях сердечно-сосудистых событий.
Критерии включения пациентов в исследование:
- наличие СД 2 типа;
- возраст 65 лет и старше;
- уровень НbА1с выше индивидуального целевого;
- получение на момент поступления в стационар комбинированной сахароснижающей терапии ПССП и агонистами рецепторов ГПП-1 (НССП) с последующей ее интенсификацией препаратами БИ, ПССП, агонистами рецепторов ГПП-1;
- прохождение комплексного гериатрического обследования;
- отсутствие тяжелой деменции;
- подписание информированного согласия на участие в исследовании.
Критерии невключения/исключения:
- наличие СД 1 типа;
- тяжелая деменция (< 11 баллов по краткой шкале оценки психического статуса (Mini-mental State Examination, MMSE));
- смена схемы сахароснижающей терапии в группе БИ (отмена БИ, назначение прандиального инсулина или готовых смесей инсулина);
- отказ от участия в повторном телеконсультировании пациентов, переведенных на БИ.
Протокол исследования был одобрен локальным этическим комитетом ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова».
Анализ данных проводился с использованием пакета программ IBM SPSS Statistics 23. Количественные данные представлены в виде медианы и интерквартильного размаха (Me [Q1; Q3]). Бинарные признаки приведены в виде относительных частот (%). Сравнение количественных данных между группами выполняли с помощью критерия Манна – Уитни. Для сопоставления частотных характеристик применяли точный критерий Фишера. Сравнение внутри группы по парным наблюдениям осуществлялось с использованием критерия Уилкоксона. Уровень статистической значимости принимался равным p < 0,05.
Результаты
Первый этап: установление факторов, влияющих на выбор препарата для интенсификации сахароснижающей терапии
Основную группу составили 39 пациентов в возрасте 71 [68–73] года, из них 13 (33,3%) мужчин и 26 (66,7%) женщин. В группу сравнения вошли 27 пациентов в возрасте 73 [68,0–76,5] лет, из них 9 (33,3%) мужчин и 18 (66,7%) женщин.
В основной группе в среднем через 23 (20–24) месяца проведен сбор информации о гликемическом контроле, частоте гипогликемических эпизодов, составе сахароснижающей терапии, факте наличия падений и атеросклеротических сердечно-сосудистых заболеваний (АССЗ) посредством телеконсультирования (2022–2023 гг.).
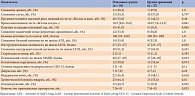
Пациенты основной группы и группы сравнения были сопоставимы по возрасту, длительности заболевания, индексу массы тела (ИМТ), наличию хронических осложнений СД, в том числе хронической болезни почек (ХБП) и АССЗ (табл. 2). Обе группы также не различались по социальным параметрам. Так, при включении в исследование проживающих в одиночестве в основной группе было 33,3%, в группе сравнения – 22,2% (р = 0,412). С супругами практически того же возраста проживали 66,7% в основной группе и 77,8% в группе сравнения (р = 0,412). Таким образом, фактически каждый третий пациент, у которого впервые была инициирована инсулинотерапия, оказался одиноким.
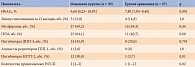
У всех включенных в исследование диагностированы гериатрические синдромы – один или несколько. Статистически значимых различий в функциональном статусе и распространенности основных гериатрических синдромов между двумя группами не обнаружено (табл. 3). Однако исходно у трети пациентов основной группы имело место снижение остроты зрения, примерно половина предъявляла жалобы на головокружение, что было статистически значимо выше, чем у пациентов группы сравнения (см. табл. 3).
Пациенты, вошедшие в основную группу, при поступлении в клинику имели более высокий уровень HbA1c, чем пациенты группы сравнения, – 9,60 [8,25–10,95] vs 7,80 [7,05–8,40]% (р = 0,001) соответственно. Процент больных с легкими гипогликемическими эпизодами был сопоставимым в обеих группах. Тяжелые гипогликемические эпизоды в анамнезе зарегистрированы не были.
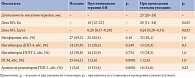
Сравнительный анализ сахароснижающей терапии до ее интенсификации выявил статистически значимые различия между группами. Количество применяемых сахароснижающих препаратов в основной группе исходно было больше, чем в группе сравнения, – 2 [2–2] vs 1 [1–2] (p = 0,02). Различия отмечены и в отношении классов принимаемых сахароснижающих препаратов. Так, в основной группе чаще, чем в группе сравнения, применяли ингибиторы натрий-глюкозного котранспортера 2 (НГЛТ-2) – 30,8 vs 3,7% соответственно (р = 0,01). Доля получавших такие препараты, как метформин, агонисты рецепторов ГПП-1, производные сульфонилмочевины (ПСМ) и ингибиторы дипептидилпептидазы 4 (ДПП-4), в двух группах была сопоставимой – 69,2 vs 59,3% (р = 0,44), 2,6 vs 0% (р = 1,0), 64,1 vs 40,7% (р = 0,05), 35,9 vs 29,6% (р = 0,791) соответственно (табл. 4).
После интенсификации терапии в основной группе количество сахароснижающих препаратов увеличилось с двух до трех (p = 0,071). При этом количество получавших ПСМ снизилось с 64,1 до 2,6% (p < 0,001), а количество применявших агонисты рецепторов ГПП-1 возросло с 2,6 до 33,4% (p < 0,001) (табл. 5).
Пациенты с СД 2 типа пожилого возраста зачастую полиморбидны и страдают различными гериатрическими синдромами. В нашем исследовании основными факторами в пользу проведения интенсификации сахароснижающей терапии БИ, а не другими НССП были исходный уровень HbA1c, превышающий целевой уровень более чем на 1,50% (9,60 [8,25–10,95] vs 7,80 [7,05–8,40]%; р = 0,001), а также количество (2 [2–2] vs 1 [1–2]; р = 0,02) и класс сахароснижающих препаратов, уже принимаемых пациентом (см. табл. 4). Однако с учетом распространенности снижения остроты зрения и головокружений в рассматриваемой когорте при возможности выбора лечения предпочтение следует отдавать препаратам с более простой схемой применения и более безопасным, что и было сделано у пациентов, вошедших в группу сравнения. В клинической практике интенсификация терапии препаратами инсулина может быть обусловлена не только невозможностью улучшения гликемического контроля с помощью добавления других классов НССП, но и наличием ХБП, лимитирующей назначение максимальных доз некоторых классов НССП, однако в нашем исследовании этого продемонстрировано не было.
Второй этап: оценка влияния инициации базальной инсулинотерапии на гликемический контроль, гипогликемические эпизоды и риск падений
В эту часть исследования были включены все 39 пациентов основной группы, поскольку качественного изменения сахароснижающей терапии не произошло (см. табл. 5). Необходимо отметить, что препараты БИ, кратность и способы их введения также не изменились, то есть была продолжена терапия аналогами БИ длительного или сверхдлительного действия, которые пациенты вводили с помощью шприц-ручек.
Длительность терапии аналогами БИ на момент проведения телеконсультации составила 23 [20–24] месяца. При этом оценивались такие параметры, как вес, уровень HbA1c и глюкозы плазмы натощак по данным самоконтроля, состав сахароснижающей терапии, в том числе доза БИ и прием других сахароснижающих препаратов, наличие гипогликемических эпизодов, наличие факта падений и развития новых АССЗ после инициации БИТ.
На момент проведения телеконсультации отмечено снижение ИМТ с 30,900 [28,120–34,745] до 29,60 [27,72–32,60] кг/м2 (р = 0,72), что, вероятно, было обусловлено влиянием агонистов рецепторов ГПП-1 и ингибиторов НГЛТ-2. После инициации терапии БИ зафиксировано незначительное и вместе с тем статистически значимое повышение дозы инсулина с 18 [12–22] до 20 [11–24] Ед и дозы инсулина на 1 кг массы тела с 0,20 [0,17–0,28] до 0,24 [0,20–0,31] Ед (см. табл. 5). Однако с клинической точки зрения БИТ осталась сопоставимой с получаемой при выписке из стационара. После инициации терапии БИ в среднем в течение 23 месяцев у пациентов наблюдалось статистически значимое снижение уровня HbA1c с 9,60 [8,25–10,95] до 7,30 [6,60–7,90]% (р < 0,0001) и гликемии натощак по данным самоконтроля с 9,6 [8,0–11,1] до 8,0 [7,0–9,0] ммоль/л (р = 0,003) (рис. 1 и 2).
Индивидуального целевого уровня HbA1c достигли 26 (66,6%) пациентов из 39 (100%). Уровень HbA1c менее 7,0% имел место у 14 (35,9%) пациентов, в том числе у 8 (20,5%) менее 6,5%. Это позволяет выделить подгруппу пациентов с чрезмерным снижением HbA1c, то есть потенциальных кандидатов на снижение дозы/отмену (депрескрайбинг) БИ. При анализе структуры предшествующей терапии у лиц с HbA1c менее 6,5% установлено, что большинство из них исходно получали ПСМ. У данных пациентов одновременно были отменены ПСМ и назначены агонисты рецепторов ГПП-1 в комбинации с БИ. Около половины пациентов, достигших уровня HbA1c менее 7% (11 (44%)), также исходно находились на терапии ПСМ и в дальнейшем были переведены на комбинацию БИ и агонистов рецепторов ГПП-1.
Вместе с тем 13 (33,3%) пациентов не достигли индивидуальных целевых значений HbA1c. Для них был характерен более высокий исходный уровень HbA1c – 9,85 [7,55–11,75] vs 9,30 [8,45–10,35]%. При этом в среднем в течение 12 месяцев после инициации БИТ дальнейших изменений сахароснижающей терапии, в том числе титрации дозы БИ, не происходило.
Количество пациентов с легкими гипогликемическими эпизодами после назначения БИ не изменилось – 12,8 vs 15,3% (р = 1,0). За указанный период тяжелые гипогликемические эпизоды зарегистрированы не были.
Падения в течение 12 месяцев отмечены у 6 (15,4%) пациентов, у 2 (5,1%) из них в исходе диагностирован перелом. У двух пациентов, перенесших падения, в анамнезе в течение года отмечались легкие гипогликемии, однако ни в одном случае падение не было ассоциировано с гипогликемическим эпизодом, а объяснялось факторами, приводящими к травме (поскользнулся, споткнулся и т.п.). С момента инициации базальной инсулинотерапии острое нарушение мозгового кровообращения было зарегистрировано у одного пациента (гипогликемические эпизоды в анамнезе отсутствовали). Острый инфаркт миокарда не был диагностирован ни у одного участника исследования.
Обсуждение
Результаты проведенного исследования позволили установить не только различия между пожилыми пациентами с СД 2 типа, переведенными на БИ, и теми, кому для интенсификации терапии были рекомендованы ПССП/агонисты рецепторов ГПП-1, но и ключевые факторы, влияющие на назначение им инсулина в клинической практике.
Основной причиной инициации инсулинотерапии был уровень HbA1c, превышающий целевой более чем на 1,0–1,5% на фоне комбинированной сахароснижающей терапии двумя-тремя препаратами, что свидетельствовало о выраженной декомпенсации и сопровождалось клиническими симптомами. В этой ситуации продолжение ранее назначенного лечения было неоправданным, и с учетом фактически использованного арсенала НССП инсулинотерапия становилась оптимальным решением для достижения даже умеренных гликемических целей, направленных на профилактику развития прежде всего острых осложнений СД и коррекцию симптомов гипергликемии. Назначение аналогов БИ привело к существенному улучшению гликемического контроля и достижению индивидуальных целей лечения без увеличения частоты гипогликемических эпизодов у большинства пациентов.
Результаты нашего исследования согласуются с данными субанализа результатов французского исследования LIGHT, в котором оценивались эффективность и безопасность инсулина гларгин у пациентов с СД 2 типа, ранее не получавших инсулин [10]. Через шесть месяцев терапии уровня HbA1c менее 7% достигли 31,9% пациентов моложе 70 лет и 26,0% пациентов в возрасте 70 лет и старше. Частота симптомных гипогликемий составила 6,5 и 5,4% соответственно. Тяжелых эпизодов гипогликемии не зарегистрировано. Полученные нами результаты также сопоставимы с результатами субанализа данных тайваньской когорты пациентов в возрасте 65 лет и старше, у которых снижение уровня HbA1c составило 1,2%, а частота симптомных гипогликемий без тяжелых эпизодов – 3,1% [11]. Это подтверждает эффективность и безопасность БИТ у пожилых пациентов с СД 2 типа при индивидуальном подборе дозы.
Особенностью нашего исследования является то, что оно было проведено в условиях реальной клинической практики и продемонстрировало длительность поддержания удовлетворительного гликемического контроля после добавления аналогов БИ к ранее назначенной терапии.
Важным наблюдением стало то, что у больных, которым был назначен БИ, имели место множественные гериатрические синдромы, включая снижение зрения и когнитивные нарушения. Гериатрические синдромы не только определяют функциональный статус и цели лечения, но и усложняют проведение инсулинотерапии, поэтому рассматриваются как один из ведущих факторов при принятии решения о ее назначении, объеме и дальнейшем пересмотре (депрескрайбинге) [5]. В нашем исследовании треть пациентов после инициации БИТ достигла уровня HbA1c менее 7%, в том числе каждый пятый – уровня HbA1c менее 6,5%, что в контексте гериатрической практики может расцениваться как избыточное снижение гликемии. Согласно современным представлениям, у пожилых пациентов с СД 2 типа и сопутствующими гериатрическими синдромами чрезмерное снижение уровня HbA1c ассоциировано с повышенным риском гипогликемий и падений, а также с ухудшением функционального и когнитивного статуса [12]. Именно поэтому с учетом значительного сахароснижающего потенциала БИ важны как своевременная оценка гликемического контроля после его назначения, так и регулярный пересмотр функционального статуса пациента/риска развития АССЗ с целью возможного изменения как целей лечения, так и сахароснижающей терапии. Так, если клиническая необходимость в строгом гликемическом контроле отсутствует, при возникновении или прогрессировании факторов уязвимости (старческая астения, когнитивные нарушения, высокая коморбидность) проводят снижение дозы/отмену БИ. Наибольшее снижение уровня HbA1c, вероятно, было достигнуто вследствие одновременной отмены ПСМ и назначения фиксированной комбинации БИ с агонистом рецепторов ГПП-1. Однако для окончательных выводов требуется углубленный анализ индивидуальных схем фармакотерапии на больших подгруппах пациентов.
Заключение
Назначение аналогов БИ может быть приемлемым вариантом интенсификации сахароснижающей терапии у пожилых пациентов с СД 2 типа с множественными гериатрическими синдромами и выраженной декомпенсацией углеводного обмена, уже находящихся на комбинированной терапии НССП. Это позволит улучшить гликемический контроль, не прибегая к назначению сложных с точки зрения выполнения схем инсулинотерапии, ассоциированных с высоким риском развития гипогликемии, таких как терапия готовыми смесями инсулина или базис-болюсная инсулинотерапия. Одновременно следует учитывать как высокий сахароснижающий потенциал БИ (избыточное снижение гликемии), так и возможное ухудшение функционального статуса/развитие АССЗ, что будет требовать пересмотра целей лечения и терапии, то есть проведения депрескрайбинга.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
I.V. Glinkina, PhD, A.V. Oderiy, V.V. Fadeev, MD, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Contact person: Anna V. Oderiy, anya.oderij2112@gmail.com
Objective – the aim of this study was to examine the clinical and geriatric characteristics of older adults with type 2 diabetes mellitus (T2DM) who were transitioned to basal insulin therapy (BIT), as well as to assess its impact on glycemic control, the incidence of hypoglycemic episodes, and other clinically important outcomes in real-world clinical practice.
Material and methods. A single-center cohort study was conducted involving 66 patients aged 65 years and older with T2DM and glycated hemoglobin (HbA1c) levels above their individualized targets while receiving non-insulin glucose-lowering therapy (NIGLT). All participants underwent a comprehensive diabetological and geriatric assessment.
Patients in the main group (n = 39) were switched to therapy with basal insulin (BI) analogues in combination with NIGLT. Patients in the comparison group (n = 27) underwent intensification of glucose-lowering therapy using only non-insulin agents. In the main group, data on glycemic control, frequency of hypoglycemic episodes, composition of glucose-lowering therapy, history of falls, and presence of atherosclerotic cardiovascular disease were collected after a median of 23 (20–24) months.
Results. The primary reason for initiating basal insulin analogues for therapy intensification was an HbA1c level exceeding the individualized target by more than 1.0–1.5% despite treatment with two or three non-insulin glucose-lowering agents. Following initiation of basal insulin analogues, HbA1c decreased from 9.60 [8.25–10.95] to 7.30 [6.60–7.90]% (p < 0.001), and fasting self-monitored blood glucose declined from 9.6 [8.0–11.1] to 8.0 [7.0–9.0] mmol/L (p = 0.003). Individualized HbA1c targets were achieved by 66.6% of patients, 35.9% had HbA1c levels below 7.0%. The incidence of mild hypoglycemia during BIT did not increase, and no severe hypoglycemic episodes occurred.
Conclusions. Initiation of BIT with basal insulin analogues in older adults with T2DM and geriatric syndromes leads to sustained improvement in glycemic control without increasing the incidence of hypoglycemic episodes. Given the high hypoglycemic potential of BI (with the possibility of excessive glycemic lowering), therapy reassessment – such as BI dose adjustment or even discontinuation may be warranted.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.