количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Роль топической интерферонотерапии в комбинированном лечении кондиломатоза аногенитальной области
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Дерматология" №3
- Аннотация
- Статья
- Ссылки
Кондиломатоз аногенитальной области (КАО, аногенитальный папилломатоз, аногенитальные бородавки, остроконечные кондиломы) – одно из наиболее распространенных инфекционных заболеваний половых органов, вызываемое вирусом папилломы человека (ВПЧ) (7).
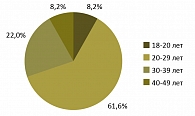
Рисунок 1. Распределение больных по возрасту
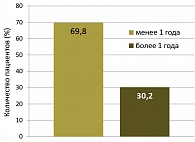
Рисунок 2. Длительность заболевания

Таблица. Распространенность патологического процесса
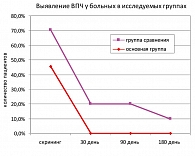
Рисунок 3. Результаты ПЦР у больных группы сравнения (динамическое наблюдение)
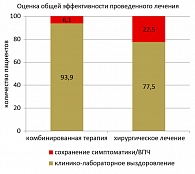
Рисунок 4. Эффективность исследуемой терапии (180 день от начала терапии)
В настоящее время выделено, по крайней мере, 100 различных серотипов ВПЧ, однако ключевая роль в развитии КАО отведена ВПЧ 6 и 11 типов (реже – 16). В отличие от высокоонкогенных штаммов, данные типы ВПЧ не повышают риск развития злокачественных новообразований, однако в связи с высокой резистентностью к терапии, частым развитием рецидивов и негативным влиянием на качество жизни больных проблема лечения КАО в настоящее время все еще находится в центре внимания практикующих дерматовенерологов и врачей смежных специальностей (8, 9, 13).
Наиболее часто передача вируса осуществляется при половом контакте, однако не исключен и бытовой путь передачи (через руки инфицированного человека, предметы его обихода) (8, 9, 13). Высока частота интранатального инфицирования при аспирации плодом содержимого влагалища и цервикального канала, что в дальнейшем влечет за собой развитие папилломатоза гортани, нередко требующего проведения оперативного вмешательства (3, 10).
Еще несколько десятилетий назад остроконечные кондиломы, в основном, диагностировались у представителей социально неблагополучных слоев населения (лиц, занимающихся проституцией и т.п.), однако в настоящее время ареал распространения данного заболевания существенно расширился.
Так, наиболее часто остроконечные кондиломы диагностируются у пациентов молодого возраста (20-25 лет), живущих активной половой жизнью, причем риск заражения ВПЧ при однократном половом контакте превышает 50% (8, 9, 13). Вероятно именно этот факт, а также частое субклиническое течение заболевания и обуславливают высокую частоту выявления генитального папилломатоза у обоих половых партнеров (65-70%).
На данный момент основным методом лечения КАО являются деструктивные методы воздействия (диатермокоагуляция, лазерная терапия, криодеструкция, химическая деструкция с помощью трихлоруксусной кислоты, ферезола, Солкодерма® и др.) (8, 9). В течение долгого времени применяются цитотоксические препараты – подофиллин, подофиллотоксин, 5-фторурацил, обладающие рядом побочных эффектов, что в значительном числе случаев ограничивает их использование (16, 17). Описанные методы лечения имеют общий недостаток – частое рецидивирование, развивающееся в первые 3 месяца уже у 25% больных (8, 9, 16). Наиболее вероятной причиной подобных неудач в лечении является способность ВПЧ оказывать супрессирующее влияние как на местный, так и на системный иммунный ответ, осуществляемое за счет синтеза ряда вирусных белков, а также особенности жизненного цикла вируса (8, 9).
Известно, что ВПЧ поражает клетки базального слоя эпителия, внедрившись в ядро которых вирус может существовать в неактивном состоянии неопределенно долгое время. При возникновении благоприятных условий в кератиноцитах начинается процесс размножения вируса, который не сопровождается разрушением клеток, что ограничивает выход вирус-специфических белков и их контакт с антигенпрезентирующими клетками.
В ходе развития папилломавирусной инфекции (ПВИ) отсутствует фаза виремии, что препятствует распознаванию заболевания иммунной системой хозяина и развитию полноценного системного ответа.
Синтезируемый вирусом белок Е7 нейтрализует противовирусную и противоопухолевую активность интерферона альфа (ИФНα) за счет способности блокировать большинство генов, индуцируемых интерфероном. Помимо этого, он блокирует фактор регуляции активности интерферона IRF, являющийся фактором транскрипции генов, которые активируются при воздействии на клетки ИФНα и -γ. Это вызывает снижение противовирусной активности эндогенных интерферонов при сохранении их физиологической концентрации. Тем не менее, известно, что у больных с ПВИ отмечается угнетение выработки ИФНα и -γ до 40% и 50% соответственно, однако механизм данного феномена в настоящее время изучен недостаточно.
Кроме того, белок Е7 оказывает негативное влияние на процессы созревания антиген-презентирующих клеток, а также подавляет экспрессию генов главного комплекса гистосовместимости, затрудняя тем самым процесс распознавания антигенных структур Т-лимфоцитами (13).
Таким образом, иммунологические нарушения при ПВИ выражаются, в основном, в угнетении клеточно-опосредованных реакций иммунной системы и снижении активности и концентрации эндогенного интерферона, что служит обоснованием для включения данного цитокина или его индукторов в стандартную терапию ПВИ.
Терапевтическое применение индукторов интерферона в условиях длительно существующего иммунодефицита, сопровождающего ПВИ, представляется недостаточно обоснованным. Прежде всего, это объясняется неспособностью пораженных клеток к длительной и достаточной продукции интерферона, быстрой их истощаемостью, а также необходимостью предварительного накопления клона иммунокомпетентных клеток (9). Исходя из этого, более рациональным можно считать профилактическое использование индукторов интерферона, которое следует начинать после проведения полноценного курса иммуномодулирующей терапии препаратами экзогенного интерферона.
Введение экзогенного интерферона позволяет достичь выраженного эффекта, начиная с первых дней терапии. По результатам многочисленных зарубежных и отечественных исследований установлено, что парентеральное введение интерферона существенно повышает эффективность лечебных мероприятий, однако сопровождается рядом побочных эффектов, снижающих приверженность больных терапии. К наиболее частым нежелательным явлениям системного применения препаратов интерферона относятся гриппоподобный синдром, диспептические явления, депрессия, потеря веса, угнетение кроветворения и др. (7, 14-18). Неудовлетворительные параметры безопасности парентеральных форм интерферона послужили лимитирующим фактором для их широкого применения и обусловили необходимость разработки более безопасных лекарственных форм.
Российским ученым принадлежит первенство в создании суппозиториев, содержащих рекомбинантный человеческий ИФНα, позволивших проводить эффективную и безопасную топическую интерферонотерапию. Наиболее современным представителем этой группы является препарат Генферон®, суппозитории вагинальные, ректальные (ЗАО «Биокад», Россия), в состав которого входит рекомбинантный человеческий интерферон альфа-2b (рчИФНα-2b), таурин и анестезин. Согласно результатам сравнительного исследования фармакокинетики различных лекарственных форм ИФНα, ректальное введение ИФНα характеризуется высокой биодоступностью (более 80%) и более длительной циркуляцией. Более низкая концентрация рчИФНα-2b, представленная в суппозиториях, не вызывает снижения клинической эффективности: известно, что именно низкие дозы рчИФНα-2b оказывают выраженное иммуномодулирующее действие, а местное применение способствует наступлению противовирусного и антипролиферативного эффекта непосредственно в очаге поражения (4).
С учетом вышесказанного значительный научный и практический интерес представляет изучение эффектов топической интерферонотерапии в рамках комбинированного лечения больных, страдающих ПВИ.
Для оценки целесообразности включения суппозиторной формы ИФНα в стандартный алгоритм лечения КАО нами было проведено сравнительное рандомизированное двойное слепое плацебо-контролируемое исследование эффективности препарата Генферон® в сочетании с деструктивным методом лечения остроконечных кондилом.
Материалы и методы
Исследование проведено на базе двух клинических центров: кафедры дерматовенерологии ФППО ГОУ ВПО Первого МГМУ им. И.М. Сеченова (профессор, д.м.н. Потекаев Н.Н.) и кафедры кожных и венерических болезней, клинической микологии с курсом дерматокосметологии ФУВ ГОУ ВПО РГМУ Росздрава (заведующий кафедрой – профессор, д.м.н. Бутов Ю.С.).
Целью настоящего исследования являлось изучение эффективности препарата Генферон® в комбинированном лечении остроконечных кондилом.
Под наблюдением находилось 73 человека (53 мужчины и 20 женщин) в возрасте от 19 до 49 лет с кондиломатозным поражением аногенитальной области.
К участию в исследовании допускались пациенты в возрасте от 18 до 55 лет с установленным диагнозом остроконечных кондилом, давшие письменное информированное согласие, способные следовать всем предписанным процедурам. Дополнительными критериями включения являлись лабораторно подтвержденное наличие вируса папилломы человека, а также характерная цитологическая картина слизистой оболочки влагалища и цервикального канала.
В соответствии со стандартами, принятыми в участвующих в исследовании центрах, диагноз остроконечных кондилом аногенитальной области считался установленным при визуальном обнаружении характерных разрастаний. Дополнительным критерием диагноза являлось обнаружение ВПЧ методом ПЦР.
После включения в исследование больные были рандомизированы в 4 группы:
группа А – женщины, применявшие суппозитории Генферон® в дозе 1 000 000 МЕ 2 раза в сутки ректально в течение 10 дней, затем им была проведена электрокоагуляция кондиломатозных разрастаний, после чего больные продолжали применять препарат Генферон® в дозе 500 000 МЕ вагинально 2 раза в сутки 10 дней параллельно с ректальным применением в дозе 1 000 000 МЕ 1 раз в 2 дня в течение 20 дней;
группа В – женщины, получающие плацебо по схеме, аналогичной таковой у пациенток группы А (также на фоне проведения деструктивного лечения);
группа С – мужчины, получающие суппозитории Генферон® ректально в дозе 1 000 000 МЕ 2 раза в сутки в течение 10 дней, после чего им проводилась электрокоагуляция кондилом, и назначался препарат Генферон® в той же дозе 1 раз в 2 дня в течение еще 20 дней;
группа D – мужчины, получающие плацебо по схеме, аналогичной таковой у пациентов группы С (также на фоне проведения деструктивного лечения).
Исследование предусматривало проведение 5 визитов: скрининг (день 1), визит на 11 день для выполнения деструкции и 3 текущих визита на 30, 90 и 180 день для оценки ранних и отдаленных эффектов комбинированного лечения.
На скрининге у всех пациентов был собран подробный анамнез заболевания, проведен осмотр половых органов и перианальной области, молекулярно-генетическое исследование методом ПЦР на наличие ВПЧ. Для проведения ПЦР-диагностики были использованы тест-системы, зарегистрированные в МЗ и СР РФ и/или получившие сертификаты производства ГИСК им. Л.А. Тарасевича. При положительном результате ПЦР и/или развитии рецидива кондиломатоза, повторное ПЦР-исследование осуществлялось на 30, 90 и 180 день от начала терапии.
Окончательная оценка эффективности проводилась на 180 день от начала терапии. Критериями излечения являлось исчезновение клинических проявлений заболевания, а также отрицательный результат ПЦР-исследования. Кроме того, лечение считалось эффективным, если на момент завершения участия в исследовании у пациента не наблюдалось рецидивирования кондиломатоза.
Безопасность и переносимость исследуемой терапии оценивали на основании анализа частоты возникновения неблагоприятных явлений у всех больных, получивших хотя бы одну дозу препарата Генферон®.
При интерпретации результатов использовали стандартные методы сравнительного анализа и описательной статистики. В зависимости от характера распределения признака использовали параметрический или непараметрический анализ (t-критерий Стьюдента, критерий Манна–Уитни и Вилкоксона соответственно). Частотные показатели интерпретировали на основании точного критерия Фишера. Статистически значимыми считались различия при р < 0,05.
Характеристика исследуемого препарата
Препарат Генферон® (ЗАО «Биокад», Россия) представляет собой суппозитории для ректального введения, активными компонентами которых являются рекомбинантный человеческий интерферон альфа-2b, таурин и анестезин.
ИФНα обладает широким спектром иммунобиологической активности: он способен ингибировать практически любую стадию размножения вируса, включая процесс проникновения в клетку, транскрипцию, созревание, сборку и высвобождение патогена из клетки. ИФНα увеличивает фагоцитарную активность иммунокомпетентных клеток (макрофагов, моноцитов, нейтрофилов), натуральных киллеров, повышает количество и киллерный потенциал Т-клеток, стимулирует дифференцировку В-лимфоцитов и продукцию ими специфических антител, способствует повышению уровня секреторного IgA и оказывает ряд других положительных иммуномодулирующих эффектов. Помимо этого, препараты экзогенного ИФНα потенцируют действие противомикробных лекарственных средств, что позволяет повысить эффективность этиотропной терапии ряда заболеваний, вызванных трудно поддающимися стандартному лечению микроорганизмами (микоплазмами, уреаплазмами, хламидиями) (1-3, 5, 15, 19).
Таурин – это незаменимая серосодержащая аминокислота, метаболит цистеина. Оказывает выраженное противовоспалительное, антиоксидантное, метаболическое и регенеративное воздействие. Сочетание таурина и ИФНα в составе одной лекарственной формы увеличивает биологическую активность последнего и обеспечивает более широкий спектр действия препарата по сравнению с другими суппозиторными формами ИФНα (6, 8, 9).
Анестезин (МНН: бензокаин) – местный анестетик, способствующий устранению зуда и жжения, которые часто сопутствуют кондиломатозу, а также купирующий болевой синдром после проведения деструктивного лечения. Не оказывает системного воздействия (6, 8, 9).
Сегодня накоплен обширный опыт применения препарата Генферон® в терапии различных инфекционно-воспалительных заболеваний, а именно: хронических воспалительных заболеваний органов малого таза у женщин, урогенитальных инфекций вирусной и бактериальной этиологии, хроническом бактериальном простатите, цервикальной неоплазии и др. Имеющиеся научные данные свидетельствуют о высоком терапевтическом потенциале и широком профиле безопасности препарата Генферон®, что послужило предпосылкой для изучения его эффектов в рамках нашего клинического исследования (4, 6, 8, 9, 11).
Результаты и обсуждение
В исследовании приняли участие 73 пациента (53 мужчины и 20 женщин) в возрасте от 19 до 49 лет. Средний возраст больных составил 28,2 ± 7,1 года, большинство больных на момент включения были младше 30 лет (рисунок 1).
У части включенных в исследование пациентов имелся отягощенный соматический анамнез; так, наиболее часто больные страдали хроническими заболеваниями желудочно-кишечного тракта (хронический гастрит, язва желудка и двенадцатиперстной кишки), бронхиальной астмой и псориазом.
Длительность кондиломатоза варьировала от нескольких лет до нескольких месяцев, но в большинстве случаев не превышала 1 года (рисунок 2). Предшествующее деструктивное лечение было проведено 10% больных, оказавшееся неэффективным и повлекшим за собой развитие рецидива. У 16,3% обследованных лиц ВПЧ был диагностирован у полового партнера.
При осмотре половых органов и аногенитальной области у всех больных был диагностирован кондиломатоз различной степени распространенности (см. таблицу). Распространенная форма кондиломатоза с одновременным вовлечением уретры, слизистой оболочки головки, кожи тела полового члена, мошонки и перианальной области зарегистрирована у 18,1% мужчин, обширное поражение слизистой больших и малых половых губ с переходом на кожу промежности и перианальной области – у 16,6% женщин. В большинстве случаев папилломатозные разрастания определялись на фоне гиперемированной слизистой в области малых половых губ у женщин, у мужчин – в области головки полового члена. Папилломатоз слизистой прямой кишки, выявленный при ректальном исследовании, наблюдался лишь у 4,1% больных.
По результатам исследования методом ПЦР, выполненного при скрининге, вирус папилломы человека был диагностирован, в целом, у 34,2% пациентов (25% больных группы плацебо и 45,4% больных основной группы). На 30, 90 и 180 день после начала терапии ВПЧ не определялся ни у одного пациента, получившего лечение препаратом Генферон®, в то время как в группе сравнения ВПЧ не удалось элиминировать у 20% больных. К 180 дню вирус был выделен у 10% больных группы плацебо.
Динамическое наблюдение за больными, продолжавшееся в течение 6 месяцев, позволило выявить более выраженную положительную динамику в группе пациентов, получавших комбинированную терапию КАО. Так, через 30 дней после начала терапии единичные папилломы аногенитальной области диагностировались приблизительно с одинаковой частотой в обеих группах – у 21,2% больных основной группы и 17,5% пациентов группы плацебо (точный критерий Фишера, p > 0,05). Но к 90 дню в группах было достигнуто статистически значимое различие: рецидив КАО зарегистрирован у 9,1% пациентов, получавших комбинированную терапию, и у 20% группы сравнения (р < 0,05). В соответствующем числе случаев пациенты нуждались в повторных процедурах физической деструкции. К моменту окончания исследования (180 день от начала терапии) очаги папилломатоза наблюдались в 22,5% случаев в группе плацебо и лишь в 6,1% случаев в основной группе, при этом у больных обеих групп КАО был умеренным и обычно не выходил за пределы слизистой оболочки малых половых губ у женщин и головки полового члена у мужчин.
Общая эффективность лечения оценивалась на 180 день согласно результатам осмотра половых органов и перианальной области, элиминации ВПЧ по данным исследования методом ПЦР, а также оценки рецидивирования кондиломатоза (рисунок 4). Эффективность комбинированной терапии с использованием препарата Генферон® была статистически выше и составила 93,9%, тогда как эффективность изолированного деструктивного метода лечения – 77,5% (точный критерий Фишера,
р < 0,05).
р < 0,05).
Все пациенты основной группы получили полный курс лечения препаратом Генферон®. Как ректальное, так и вагинальное введение не вызывало у больных субъективного дискомфорта и возникновения побочных реакций. Ни один пациент не был исключен из исследования в связи с непереносимостью терапии, что свидетельствует о безопасности применения исследуемого препарата как в пред-, так и в послеоперационном периоде.
Выводы
Кондиломатоз аногенитальной области является широко распространенным и трудно поддающимся лечению заболеванием. Результаты проведенного нами исследования подтверждают общие эпидемиологические данные о высокой частоте встречаемости данной патологии среди лиц молодого возраста. Установлено статистически достоверное повышение эффективности лечебных мероприятий при использовании комбинированного метода лечения, сочетающего физическую деструкцию кондилом и применение местного иммуномодулирующего препарата Генферон®. Так, у больных, которым был проведен курс интерферонотерапии, достоверно чаще удавалось добиться элиминации ВПЧ, по данным исследования методом ПЦР, исчезновения клинических проявлений и снижения частоты рецидивирования аногенитальных кондилом. Более высокая эффективность комбинированного метода лечения объясняется, по всей видимости, коррекцией имеющегося иммунологического дефицита у больных ПВИ и создает предпосылки для дальнейшего изучения положительных эффектов иммунотропной терапии у данной категории пациентов.
Рекомендуемая схема терапии кондиломатоза аногенитальной области:
женщины – Генферон® в дозе 1 000 000 МЕ 2 раза в сутки ректально в течение 10 дней, затем проводится деструкция кондилом, после чего больные продолжают применять препарат Генферон® в дозе 500 000 МЕ вагинально 2 раза в сутки 10 дней параллельно с ректальным применением в дозе 1 000 000 МЕ 1 раз в 2 дня в течение 20 дней;
мужчины – Генферон® в дозе 1 000 000 МЕ 2 раза в сутки в течение 10 дней, после чего им проводится деструкция кондилом и назначается препарат Генферон ректально в той же дозе 1 раз в 2 дня в течение еще 20 дней.
1. Ершов Ф.И., Григорян С.С., Готовцева Е.П. Система интерферона в норме и при патологии. М., 1996.
2. Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы (от молекул до лекарств). М.: ГЭОТАР-Медиа, 2005.
3. Каримова Ф.С., Иванченко Г.Ф., Григорян С.С. Лечение папилломатоза гортани индукторами интерферона // Вестник оториноларингологии. 2000; №5.
4. Корсунский В.Н., Брускин А.Б., Денисов Л.А., Иванов Р.А. Сравнительное изучение фармакокинетики различных лекарственных форм интерферона //Эффективная фармакотерапия. 2007; №1.
5. Малиновская В.А. Виферон. Руководство для врачей. М., 1998.
6. Петрунин Д.Д., Уджуху В.Ю., Кубылинский А.А. Аналитический обзор препаратов интерферона α2 в форме суппозиториев, зарегистрированных в Российской Федерации // Проблемы репродукции. 2005; №5.
7. Попов В.Ф., Попов О.В. Лекарственные формы интерферонов. Справочник врача. М.: Триада-Х, 2002.
8. Прилепская В.Н., Роговская С.И., Бебнева Т.Н., Межевитинова Е.А. и соавт. Лечение плоскоклеточных интраэпителиальных поражений шейки матки низкой степени препаратом Генферон // Эффективная терапия в акушерстве и гинекологии. 2008; №2.
9. Уджуху В.Ю., Кубылинский А.А., Тихомиров А.А. Опыт применения Генферона и криодеструкции при лечении поражений аногенитальной области вирусом папилломы человека // Инфекционные болезни. 2005; №3.
10. Феклисова Л.В., Новокшонова В.А., Месхина Е.Р. и др. Рекомбинантные интерфероны в лечении вирусных и вирусно-бактериальных инфекций у детей. Методические рекомендации МОНИКИ. М., 1996.
11. Фрейдлин И.С. От иммунорегуляции к иммунокоррекции. СПб., 1995.
12. Ханферян Р.А., Боровиков О.В., Боровиков И.О., Закиева В.А. и соавт. Клинико-иммунологическая эффективность лечения рецидивирующих форм вульвовагинального кандидоза с системным применением Генферона // Эффективная терапия в акушерстве и гинекологии. 2008; №3.
13. Шперлинг Н.В., Венгеровский А.И., Зуев А.В., Чукаева Л.М., Шперлинг И.А. Особенности применения индукторов интерферона у больных остроконечным кондиломатозом аногенитальной области // Казанский медицинский журнал. 2008; №8.
14. Ярилин А.А. Основы иммунологии. М.: Медицина, 1999.
15. Chiusolo P.et al. Fatal bone marrow aplasia during interferon-α treatment in chronic myelogenous leukemia // J.Haemotologica. 2000; p. 212.
16. Hamad Al Ashgar, MD; Fahad Al Sohaibani, MD; Ingvar Kagevi, MD; Martin Gyger, MD. Autoimmune hepatitis induced by inyerferon-a therapy in a patient with chronic myeloid leukemia // Fnnals of Saudi Medicine. 2002; Vol 22, Nos 1-2: 73-74.
17. Maw R.D. A comparison of interferon alpha-2a and podophyllin in the treatment of primary condylomata acuminate. The Condylomata International Collaborative Study Group. Genitourin Med. 1991; 67: 394-399.
18. Pestka S. The Interferons: 50 years after their discovery, there is much more to learn // J.Biol.Chem. 2007; Vol. 282, no 28: 20047-20051.
19. Vilcek J. Fifty years of interferon research: aiming at a moving target // J. Immunity. 2006; 25(3): 343-348.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.