Комплексная лабораторная диагностика патологии шейки матки ВИЧ-инфицированных пациенток по материалам Самарского областного клинического центра профилактики и борьбы со СПИД
- Аннотация
- Статья
- Ссылки
- English
Цель – изучить проблему цервикального канцерогенеза на основании морфологических исследований с использованием современных лабораторных методов (полимеразная цепная реакция (ПЦР), иммуноферментный анализ (ИФА)) с целью повышения эффективности неинвазивных методов диагностики патологии шейки матки.
Материал и методы. Представлены результаты исследований цитологических препаратов из эндо- и экзоцервикса с последующей бактериоскопической диагностикой у 4838 пациенток, а также результаты 972 исследований методом ПЦР и ИФА у ВИЧ-инфицированных пациенток с различными стадиями прогрессирования основного заболевания за 2023 г. Статистическую обработку данных выполняли с помощью программы STATISTICA 10.
Результаты и обсуждение. Указаны показатели чувствительности и специфичности цитологического метода в диагностике патологии шейки матки в комплексе с высокотехнологичными лабораторными методами (ПЦР и ИФА), что повышает уровень диагностической значимости. Заболеваемость ВПЧ-инфекцией, приводящей к цервикальной неоплазии, среди ВИЧ-позитивных женщин значительно выше, чем среди ВИЧ-негативных.
Выводы. Показатели цитологического исследования в комплексе с данными других современных лабораторных методов служат важным прогностическим и диагностическим фактором.
Цель – изучить проблему цервикального канцерогенеза на основании морфологических исследований с использованием современных лабораторных методов (полимеразная цепная реакция (ПЦР), иммуноферментный анализ (ИФА)) с целью повышения эффективности неинвазивных методов диагностики патологии шейки матки.
Материал и методы. Представлены результаты исследований цитологических препаратов из эндо- и экзоцервикса с последующей бактериоскопической диагностикой у 4838 пациенток, а также результаты 972 исследований методом ПЦР и ИФА у ВИЧ-инфицированных пациенток с различными стадиями прогрессирования основного заболевания за 2023 г. Статистическую обработку данных выполняли с помощью программы STATISTICA 10.
Результаты и обсуждение. Указаны показатели чувствительности и специфичности цитологического метода в диагностике патологии шейки матки в комплексе с высокотехнологичными лабораторными методами (ПЦР и ИФА), что повышает уровень диагностической значимости. Заболеваемость ВПЧ-инфекцией, приводящей к цервикальной неоплазии, среди ВИЧ-позитивных женщин значительно выше, чем среди ВИЧ-негативных.
Выводы. Показатели цитологического исследования в комплексе с данными других современных лабораторных методов служат важным прогностическим и диагностическим фактором.
Введение
Стратегия выявления типов вируса папилломы человека (ВПЧ) высокого канцерогенного риска (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59), способных привести к развитию опухолей гениталий и рака шейки матки (РШМ), крайне важна. Стратегия предусматривает увеличение охвата женщин с риском развития предрака. Цитологический метод характеризуется высокой специфичностью (78–99%) и вместе с тем недостаточной чувствительностью (68–86%). Определение ДНК ВПЧ высокого канцерогенного риска молекулярно-биологическими методами позволяет прогнозировать риск развития РШМ, ассоциированного с ВПЧ [3], течение инфекционного процесса на этих этапах скрининга [1].
Больные с положительным результатом тестирования на ВПЧ рассматриваются как имеющие потенциальный риск развития онкологической патологии [2]. Количественный метод выявления ВПЧ помогает повысить качество диагностики уже на первых этапах скрининга, прогнозировать течение инфекции [3]. Применение количественного теста для идентификации ВПЧ и цитологического ПАП-теста ассоциируется с повышением частоты выявления онкологической патологии шейки матки и удлинением интервала между обследованиями [4].
Выявление ДНК ВПЧ высокого канцерогенного риска в клиническом материале методом полимеразной цепной реакции (ПЦР) обладает высокой чувствительностью (88–100%), но недостаточной специфичностью (68–97%), что требует выполнения кольпоскопической диагностики.
Ложноположительный результат влияет на психологическое состояние женщины и может привести к необоснованным вмешательствам, связанным с дополнительной финансовой нагрузкой на систему здравоохранения. Чувствительность и прогностическая значимость отрицательного теста на ВПЧ в сочетании с отрицательным результатом цитологического исследования приближаются к 100%.
Для решения проблемы необходима правильная стратегия сертификации, а именно использование:
- теста с высокой чувствительностью и отрицательной прогностической ценностью (NPV) для выявления женщин, которые могут вернуться к рутинному наблюдению;
- теста с высокой специфичностью и положительной прогностической ценностью (PPV) для выявления женщин, которым необходимо дальнейшее обследование.
Цель – проанализировать результаты морфологических исследований с использованием ПЦР, позволяющих оценить патологические процессы шейки матки, изучить проблему цервикального канцерогенеза, повысить эффективность неинвазивных методов диагностики патологии шейки матки.
Материал и методы
Работа выполнена в ГБУЗ «Самарский областной клинический центр профилактики и борьбы со СПИД», ГБУЗ «Волжская клиническая больница», ЧУЗ «Клиническая больница „РЖД-Медицина“» на основании результатов исследования 4838 ВИЧ-инфицированных пациенток в возрасте 18–56 лет за 2023 г. (из них 3728 (77,1%) пациенток репродуктивного возраста (18–36 лет)).
Всем пациенткам проводились раздельные цитологические исследования биоматериала, полученного из экзо- и эндоцервикса щеткой cervix branch. При обнаружении патологических изменений 3167 (65,5%) пациенткам выполнялась расширенная программа лабораторных исследований (гистологические исследования, ПЦР-исследование, бактериоскопические исследования, диагностика инфекции, передаваемой половым путем) на основании показателей цитологического исследования.
ПЦР-диагностика и бактериоскопические исследования проводились для обнаружения инфекционного агента. Все пациентки, вошедшие в исследование, исходя из результатов обследования на ВПЧ с типированием были разделены на три группы: ВПЧ высокого риска – 63%, ВПЧ низкого риска – 26%, ВПЧ не обнаружен – 11% пациенток.
Бактериоскопическое исследование для определения биоценоза влагалища выполнялось всем пациенткам (n = 4838). Патогенная микробиота имела место у 3676 (76%) женщин. В частности, у 68 (1,4%) из них обнаружена специфическая микробиота.
ПЦР-диагностические исследования выполнены 972 пациенткам с различной патологией шейки матки (эрозия, эктопия, бактериальный вагиноз и т.д.). Обнаружены 18-й и 16-й типы, а также другие генотипы ВПЧ высокого канцерогенного риска. Они являются наиболее значимыми онкогенными типами, которые вносят наибольший риск в развитие цервикального канцерогенеза. В 94% случаев ВПЧ является причиной развития рака вульвы, анального рака, рака полового члена, назофарингеальной карциномы и полости рта. Это лишний раз подтверждает необходимость тестирования на ВПЧ-инфекцию различных групп населения, особенно инфицированных ВИЧ.
У 76% пациенток наблюдалась сопутствующая патология шейки матки. У 78% из них папилломавирусная инфекция протекала на фоне эктопии, энтропиона. Рубцовая деформация наблюдалась в 12,5% случаев, эндометриоз – в 6%, полипы цервикального канала – в 3,5% случаев.
Цитологические препараты окрашивались ручным способом методами Папаниколау и Лейкодиф. Морфологическое заключение формировалось на основании междисциплинарных классификаций (Международная классификация болезней 10-го пересмотра, Bethesda).
Цитологические и бактериоскопические препараты изучались под микроскопом OLYMPUS (Япония), LEICA (Германия) с 100- и 200-кратным увеличением.
ПЦР-диагностика проводилась с использованием автоматической системы закрытого типа m ABBOTT sp, rt, диагностической тест-системы Abbott RealTime HR HPV. Данная тест-система выявляет 14 высокоонкогенных типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, 68), отдельно обозначает наличие 16-го и 18-го типов.
ПЦР-диагностика ДНК ВПЧ основана на обнаружении в биоматериале фрагментов ДНК ВПЧ, образцов, полученных с поверхности патологических разрастаний, кожи или половых органов.
Результат теста дает врачу возможность оценить потенциальный риск развития онкологического процесса, что особенно важно на ранних стадиях заболевания, когда видимые органические поражения отсутствуют.
Цитологический метод позволяет диагностировать опухолевые и псевдоопухолевые поражения по изменению клеточного биосубстрата.
Статистическую обработку данных выполняли в программе STATISTICA 10.
Результаты и обсуждение
При цитологическом исследовании патологические изменения шейки матки и биоценоза влагалища выявлены у 3815 (78,9%) ВИЧ-инфицированных пациенток, в частности изменения, характерные для ВПЧ-инфекции и реактивных кератозов, – у 1135. 972 пациенткам выполнена ПЦР (исследование типирования ВПЧ): у 20,1% ВИЧ-инфицированных пациенток обнаружена патология шейки матки (эктопия, кольпит, гиперкератоз, бактериальный вагиноз, железистая гиперплазия эпителия). Отсутствие внутриклеточного поражения (NILM) установлено методом традиционной цитологии у 3858 (79,7%) пациенток, LSIL – у 467 (9,7%), HSIL – у 173 (3,6%), CIN I – у 242 (5,0%), CIN II – у 69 (1,4%), CIN III – у 23 (0,5%) пациенток. Плоскоклеточный рак и аденокарцинома зафиксированы в 6 (0,1%) случаях.
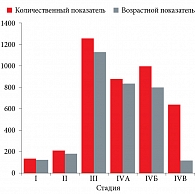
ВИЧ-инфицированные пациентки с патологией шейки матки (n = 4192) были распределены по стадиям основного заболевания:
- cтадия I – 153 (4%) женщины, из них 92% в возрасте 16–23 лет;
- стадия II – 224 (5%), из них 88% в возрасте 17–26 лет;
- стадия III – 1263 (30%), из них 90% в возрасте 18–25 лет;
- стадия IVА – 890 (21%), из них 95% в возрасте 25–35 лет;
- стадия IVБ – 1009 (24%), из них 80% в возрасте 35–45 лет;
- стадия IVВ – 653 (16%), из них 20% в возрасте 35– 45 лет (рис. 1).
Патологические изменения (сочетанная патология) носили следующий характер:
- воспалительные заболевания (неспецифический кольпит) – 1135 (29,7%) пациенток;
- эктопия шейки матки – 1204 (31,6%);
- нарушение биоценоза (бактериальный вагиноз) – 518 (13,6%);
- вирусные заболевания (ВПЧ-инфекция и другое) – 860 (22,5%);
- интраэпителиальная неоплазия (дисплазия) стадии II – 69 (1,8%), стадии III – 23 (0,6%);
- РШМ – 6 (0,2%), стадии IVБ и IVВ.
В ходе ПЦР-диагностики было установлено, что ВПЧ-инфекция чаще сочетается с уроплазмозом (33% случаев) и кандидозом (69% случаев). У 7,2% пациенток с ВПЧ-инфекцией обнаружен микоплазмоз, у 6% – герпес и цитомегаловирус, у 2% – хламидиоз. У 32% женщин инфекция протекала на фоне снижения концентрации лактобактерий, у 33,5% – на фоне анаэробного дисбиоза. Комплексное использование неинвазивных лабораторных методов при хронических цервицитах, ассоциированных с ВПЧ-инфекцией, позволяет оптимизировать диагностический процесс, исключая неадекватную травматизацию шейки матки, особенно у женщин репродуктивного возраста.
Иммунологическое определение ВПЧ 16-го и 18-го типов указывает на высокий уровень экспрессии, характерный для неоплазии плоского эпителия, – 34,2% обследованных женщин. У 88,5% ВПЧ-позитивных пациенток выявлена CIN I. Негативная реакция в 11,5% случаев свидетельствовала о ложнопозитивных и ложнонегативных данных в отношении определения маркеров и ассоциировалась с реактивным характером дисплазии. У 18,3% женщин с цитологически подтвержденной CIN I маркер 16-го и 18-го типов ВПЧ был отрицательным. Вероятно, ВПЧ находился в клетке в эписомальной форме либо CIN I развивалась на фоне других высоких канцерогенных типов ВПЧ-инфекции.
Цитологические признаки папилломавирусной инфекции
Четкими морфологическими признаками вирусных изменений клетки являются:
- койлоцитарная атипия с характерными для ВПЧ изменениями;
- двуядерные клетки;
- амфофилия цитоплазмы с участками просветления и уплотнения по периферии;
- многоядерные клетки.
Косвенные признаки:
- паракератоз;
- дискератоз;
- прочие (неспецифические признаки) [5].
Снижение общего и локального иммунитета ассоциируется с высокими показателями ВПЧ-инфицирования, определенным микробиоценозом ВИЧ-инфицированных пациенток [61].
Исходя из выраженности неопластического процесса шейки матки и стадии ВИЧ-инфекции, выявлены разнонаправленные изменения факторов местного иммунитета у больных с тяжелыми интраэпителиальными цервикальными поражениями. При инвазии часто выявляется 16-й тип ВПЧ. Дисбиотические нарушения биоценоза влагалища являются сопутствующим фактором тяжелых цервикальных поражений [4].
Характер локальных иммунопатологических нарушений при ВПЧ-ассоциированной цервикальной патологии у ВИЧ-инфицированных пациенток обусловлен патогенетическими формами профретивной и инфретивной стадий ВПЧ.
При сравнении частоты возникновения рака у женщин на разных стадиях заболевания установлен рост на стадиях III–IV основного заболевания (ВИЧ-инфекция) [1].
Распределение РШМ и предрака по стадии основного заболевания
Интраэпителиальная неоплазия в 59% случаев заболевания выявлена на стадиях III–IV основного заболевания, в 12% случаев – на стадии II, в 17,4% – на стадии I, в 11,6% – на стадии карциномы in situ.
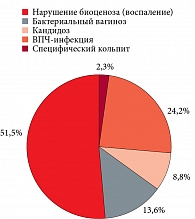
Как показали анализ амбулаторных карт и ретроспективное наблюдение, из 3815 ВИЧ-инфицированных пациенток у 1950 (51,1%) пациенток с РШМ и предраком выявлены нарушения биоценоза и признаки воспаления влагалища и шейки матки в течение нескольких лет до развития заболевания, рецидивирующий бактериальный вагиноз – у 518 (13,6%), рецидивирующий кандидозный кольпит – у 336 (8,8%) женщин. У 924 (24,2%) женщин выявлена ВПЧ-инфекция, у 87 (2,3%) пациенток – специфический кольпит (рис. 2).
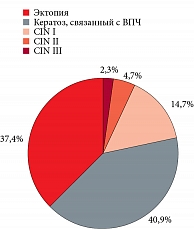
Фоновые и предраковые заболевания шейки матки были распределены следующим образом: эктопия шейки матки, эндоцервикоз – 1428 (37,4%) случаев, реактивный кератоз эпителия шейки матки, связанный с ВПЧ-инфицированием, – 1559 (40,9%), CIN I – 561 (14,7%) CIN II – 178 (4,7%), CIN III – 89 (2,3%) случаев (рис. 3).
Результаты статистических данных исследования шейки матки ВИЧ-инфицированных пациенток показали, что предраковые состояния и РШМ значительно превышают среднероссийские и региональные показатели:
- CIN II (дисплазия) по России и региону – 0,02%;
- CIN III (дисплазия) по России и региону – 0,005%;
- РШМ по России и региону – 0,002%.
Установлена связь ВИЧ-инфекции с инфекцией, вызванной ВПЧ, и цервикальной дисплазией. Смешанная инфекция ВИЧ и ВПЧ, равно как и тяжесть иммунодепрессии, увеличивают риск генитальных интраэпителиальных неоплазий.
Заключение
Выявлен высокий уровень заболеваемости РШМ и предраком у ВИЧ-инфицированных пациенток в возрастной группе 18–29 лет (активный сексуальный и репродуктивный возраст). Развитию РШМ предшествует длительное нарушение биоценоза влагалища, ассоциированное с бактериальным вагинозом, кандидозным вагинитом, специфическим кольпитом, фоновыми и предраковыми заболеваниями шейки матки при ВПЧ-инфекции у ВИЧ-инфицированных пациенток. Рецидивирующие нарушения биоценоза влагалища и ВПЧ-инфекцию можно рассматривать как ведущие факторы цервикального канцерогенеза у ВИЧ-инфицированных пациенток.
Лабораторным показателем выраженности ВПЧ-ассоциированных поражений шейки матки низкой и высокой степени является экспрессия маркеров p16 и р18. Это означает, что их можно использовать в качестве дополнительных критериев оценки патологических процессов шейки матки. Заболеваемость ВПЧ-инфекцией, которая приводит к цервикальной неоплазии, у ВИЧ-позитивных женщин в 5–10 раз выше, чем у ВИЧ-негативных.
Обобщив опыт применения различных лабораторных методов исследования ВИЧ-инфекции, можно сделать вывод, что только комплексный подход к лабораторной диагностике с использованием высокотехнологичных методов дает базовые представления об этиологии и патогенезе заболеваний с высоким канцерогенным риском.
Авторы заявляют об отсутствии конфликта интересов.
D.G. Khurtin, O.I. Reznikova, O.S. Zolotovitskaya, O.Yu. Kozlova, I.Yu. Dolgova, M.I. Beloglazova, Ye.V. Likhuto, Ye.Ye. Potyakina
Samara Regional Clinical Center for AIDS Prevention and Control
Clinical Hospital ‘RZD-Medicine’
Association of Clinical Cytologists of Russia
Volzhskaya Central District Hospital
Ministry of Health of the Samara Region
Contact person: Olga S. Zolotovitskaya, olegzolotovickij@yandex.ru
The problem of cervical pathology in HIV-infected patients remains extremely relevant. Due to the increasing incidence of cervical cancer in the reproductive age, the role of non-invasive diagnostic methods is indisputable.
The aim is to study the problem of cervical carcinogenesis on the basis of morphological studies using modern laboratory methods (polymerase chain reaction (PCR), enzyme immunoassay (ELISA)) in order to increase the effectiveness of non-invasive methods for diagnosing cervical pathology.
Material and methods. The results of studies of cytological preparations from endo- and exocervix with subsequent bacterioscopic diagnosis in 4838 patients, as well as the results of 972 studies by PCR and ELISA in HIV-infected patients with various stages of progression of the underlying disease for 2023 were provided. Statistical data processing was performed using the STATISTICA 10 program.
Results and discussion. The indicators of sensitivity and specificity of the cytological method in the diagnosis of cervical pathology in combination with high-tech laboratory methods (PCR and ELISA) are indicated, which increases the level of diagnostic significance. The incidence of HPV infection leading to cervical neoplasia is significantly higher among HIV-positive women than among HIV-negative ones.
Conclusions. Cytological examination indicators in combination with data from other modern laboratory methods serve as an important prognostic and diagnostic factor.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.