Нейропротекция при остром ишемическом инсульте
Доклад зарубежного лектора Карлоса МОЛИНЫ (больница Vall d’Hebron, Барселона) был посвящен одной из наиболее актуальных тем современной неврологии – нейропротекции при ишемическом инсульте. В последние годы, судя по количеству проводимых клинических испытаний, интерес мировой науки к нейропротекторам только возрос. Каким же должен быть препарат, применяемый для защиты клеток мозга? В первую очередь, он должен оказывать влияние на несколько звеньев ишемического каскада и на различные механизмы восстановления.
Кроме того, препарат должен быть безопасным, характеризоваться минимальной токсичностью даже при использовании в высоких дозах и обладать хорошими фармакодинамическими и фармакокинетическими показателями (в частности, способностью создавать высокую концентрацию препарата в ишемическом очаге). Наконец, эффективность средства должна быть подтверждена в ходе клинических испытаний, в том числе II фазы, а также данными метаанализов.
Все средства с нейропротективным действием Карлос Молина предложил условно разделить на три группы: препараты с уже зарегистрированными нежелательными эффектами, вновь разработанные средства и, наконец, малочисленная группа лекарств с доказанной эффективностью. Недостаточная эффективность нейропротективной терапии может быть обусловлена различными причинами, среди которых профессор К. Молина перечислил лишь основные:
- низкая активность препарата, нестабильность антиоксидантных систем;
- сочетание разных подтипов ишемического инсульта у одного пациента;
- снижение эффективности препарата при длительном применении.
В последнее время в неврологическом сообществе активно ведется поиск новых терапевтических стратегий, с целью нейропротекции используют альбумин, статины, миноциклин и цитиколин. Последний является необходимым участником синтеза фосфолипидов, которые, в свою очередь, входят в состав клеточных мембран, в том числе мембран нервных клеток. Цитиколин способен снижать высвобождение глутамата из нейронов и повышать его захват астроцитами. Эффект от его применения является дозозависимым.
Очень важно, что цитиколин (Цераксон) можно применять в сочетании с другими препаратами, используемыми в терапии инсультов, в частности с тромболитиками. Введение цитиколина в течение 24 часов после возникновения инсульта способствует повышению нейропластичности и активации процессов восстановления. На фоне одновременного применения цитиколина и тканевого активатора плазминогена наблюдается увеличение числа циркулирующих эндотелиальных прогениторных клеток.
Докладчик подробно остановился на доказательной базе цитиколина (Цераксона): за 30 лет, прошедших с момента появления препарата, было проведено 13 рандомизированных клинических исследований, причем в 10 из них приняли участие в общей сложности 2279 пациентов. Наличие столь обширной базы позволило провести метаанализ, целью которого было определить, влияет ли терапия цитиколином на риск инвалидизации пациентов в долгосрочной перспективе. Выяснилось, что применение цитиколина снижает риск инвалидизации на 11,6%. Эти данные подтверждают целесообразность назначения препарата при инсульте.
Работы, в которых изучался цитиколин (Цераксон), разумеется, не были однородными по дизайну, в них, в частности, существенно различались время начала терапии и длительность наблюдения. Так, в исследование, проводившееся в Японии в конце 1980-х годов, включались пациенты в течение 14 дней после развития инсульта. Таким образом, данная работа продемонстрировала эффективность цитиколина в отношении подострой нейрорепарации: умеренное или выраженное улучшение наблюдалось у 51% пациентов, получавших цитиколин, и только у 33% пациентов из группы контроля.
Профессор К. Молина продемонстрировал собравшимся также некоторые другие результаты исследований цитиколина, после чего перешел к описанию работы, получившей название ICTUS (The International Citicoline Trial on AcUte Stroke). В этом проспективном двойном слепом рандомизированном плацебоконтролируемом исследовании приняли участие 60 центров (40 испанских, 10 португальских и 10 немецких). Первичная цель этого исследования – доказать преимущество цитиколина (по сравнению с плацебо) в восстановлении неврологических функций через 12 недель с момента развития ишемического инсульта. К сожалению, анализ данных, полученных в ходе исследования ICTUS, пока не завершен, но уже в мае 2012 г. результаты данного испытания будут представлены на европейской конференции по инсульту European Stroke Conference. В заключение Карлос Молина рассказал о возможностях немедикаментозной нейропротекции. Сегодня в арсенале врачей имеется значительное количество физиотерапевтических методов, использование которых благоприятно влияет на прогноз и позволяет улучшить самочувствие больного.
Нерешенные проблемы реабилитации больных, перенесших церебральный инсульт
Как отметила заведующая отделом медико-социальной реабилитации НИИ цереброваскулярной патологии и инсульта, д.м.н., профессор Г.Е. ИВАНОВА, актуальность проблемы церебральных инсультов напрямую связана с наметившейся в последние десятилетия тенденцией к увеличению доли пожилых людей в популяции. К сожалению, нет никаких данных, указывающих на то, что в ближайшие годы или даже десятилетия эта тенденция изменится, а значит, терапевтам, кардиологам, неврологам уже сегодня следует готовиться к тому, что количество пациентов будет лишь расти.
Неоднозначно влияет на состояние здоровья людей и научно-технический прогресс. С одной стороны, появляются высокоэффективные методики лечения самых разных заболеваний, что позволяет достоверно снизить летальность. С другой – растет показатель инвалидизации, увеличивается число людей, которые страдают хроническими заболеваниями, существенно влияющими на качество жизни, трудоспособность и способность к самообслуживанию.
Кроме того, по мере развития медицинской науки и фармацевтической промышленности увеличивается и количество препаратов, используемых в терапии того или иного заболевания. Нередко, особенно при лечении пациентов с сочетанной патологией, это приводит к полипрагмазии. По мнению профессора Г.Е. Ивановой, «перегружать» пациента разнообразными лекарствами ни в коем случае нельзя. Решением данной проблемы является выбор «наиболее эффективного минимума», что подразумевает назначение только тех препаратов, эффективность которых подтверждена многочисленными исследованиями.
Вышесказанное в полной мере относится к лечению пациентов, перенесших инсульт, причем не только к медикаментозной терапии, но и к немедикаментозным реабилитационным мероприятиям. В настоящее время существует большой арсенал реабилитационных методик, и в этих условиях первоочередной задачей невролога является определение оптимального количества мероприятий, которое не нанесет вреда пациенту. Для того чтобы реабилитация была эффективной, по мнению профессора Г.Е. Ивановой, врач должен прежде всего определить объем энергетических ресурсов пациента, а также те нарушения, которые требуют наибольших расходов энергии. При этом все терапевтические воздействия, медикаментозные и немедикаментозные, в идеале должны либо восполнять содержание макроэргов в организме, либо стимулировать их образование, либо снижать потребности пациента в энергии.
К сожалению, у врача, разрабатывающего план реабилитационных мероприятий для пациента, перенесшего инсульт, очень мало времени. Если целью реабилитации является предотвращение критического снижения ранее измененных функций, а также стимуляция восстановительных процессов и восполнение энергозатрат, связанных с неадекватными диагностическими исследованиями и лечебными воздействиями, то реабилитационные мероприятия должны быть начаты не позже чем через 48 часов после развития патологического процесса. Необходимо помнить, что эти 48 часов отсчитываются не со времени госпитализации пациента или вызова «скорой», а с момента, когда произошла сосудистая катастрофа.
Профессор Г.Е. Иванова описала взаимосвязь между мотивацией пациента, функциональными резервами (которые в данном случае следует рассматривать как способность организма поддерживать энергетический метаболизм при изменении интенсивности деятельности) и стимуляцией, подчеркнув при этом, что именно способность к изменению уровня потребления кислорода и утилизации его тканями в зависимости от изменяющейся потребности является краеугольным камнем определения реабилитационного потенциала. Несоответствие уровня потребления кислорода и потребности в нем приводит к развитию целого ряда негативных последствий:
- снижению энергетических ресурсов в функционально активных тканях;
- снижению активности важнейших ферментов;
- накоплению продуктов обмена;
- нарушению целостности функционирующих структур из-за недостаточности их пластического обеспечения или нарушения гомеостаза;
- нарушению нервной или гуморальной регуляции;
- подавлению иммунитета.
Профессор Г.Е. Иванова подробно описала механизм формирования в головном мозге очага инфаркта и процессы, сопровождающие данное явление (изменение метаболизма глутамата и кальция, увеличение числа свободнорадикальных реакций, избыточное образование оксида азота и др.). Так, большая часть инфаркта формируется в течение 3–6 часов после появления первых симптомов, завершается же формирование очага в среднем за 2–3 дня, иногда этот процесс занимает до 7 дней. Процесс изменения активности мозга, вызванного инсультом, можно разделить на несколько этапов. Сначала пораженная сенсомоторная кора теряет способность реагировать на раздражители, однако цереброваскулярная активность в этой области сохраняется. Затем, через 2 недели после инсульта, наблюдается усиление ответных реакций в периинфарктной зоне на фоне снижения активности интактного полушария. При этом развивается целый ряд системных патологических процессов, прямо или косвенно связанных с инсультом (табл. 1).
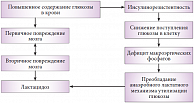
Как подчеркнула профессор Г.Е. Иванова, некорректно составленная программа реабилитационных мероприятий может не только способствовать ухудшению неврологической симптоматики, но и привести к развитию или усугублению полиорганной недостаточности. Многие генерализованные патологические процессы, связанные с инсультом, так или иначе затрагивают и процесс выработки макроэнергических фосфатов (рис. 1). Реабилитационные мероприятия должны назначаться с учетом особенностей энергетического обмена больного и не только стимулировать эндогенную пластичность, способствовать ускорению процессов накопления энергетических субстратов, но и сочетаться с проводимой медикаментозной терапией. Несоблюдение последнего принципа может привести к истощению резервов организма и развитию обратной реакции.
Реабилитационные воздействия должны осуществляться сразу на всех уровнях: клеточном, тканевом и органном (изменение уровня поляризации клеточных мембран, стимуляция метаболизма и т.д.), системном (оптимизация состояния ЦНС, снижение АД и т.д.) и межсистемном уровнях. Последнее подразумевает поэтапное формирование активного адекватного взаимодействия с внешней средой. С целью повышения толерантности пациента к нагрузкам профессор Г.Е. Иванова порекомендовала использовать аэробные циклические и дыхательные упражнения, а также медикаментозную терапию, в частности, средства, активирующие метаболизм миокарда и ЦНС и улучшающие вегетативную регуляцию. Одним из эффективных препаратов для стимуляции синтетических процессов и процессов утилизации кислорода в условиях ишемии и гипоксии является препарат Актовегин. Он активирует процессы ресинтеза глюкозы из лактата с последующим усилением транспорта глюкозы в клетки, а затем в митохондрии, повышает эффективность гликолиза, активирует синтез макроэнергических фосфатов и осуществляет ряд других функций, направленных на нормализацию показателей энергетического обмена. Столь обширный спектр механизмов действия обусловлен многообразием входящих в состав Актовегина ингредиентов (табл. 2).
Синатотропное действие Актовегина связывают со стимуляцией синтеза аденозина, таурина и глицина. Наличие в составе препарата пула пуриновых и пиримидиновых оснований обеспечивает нормальную работу системы синтеза антиапоптозных белков в клеточном ядре. Кроме того, Актовегин препятствует развитию апоптоза за счет блокады фермента каспазы-3. У больных с ишемическим инсультом старше 70 лет Актовегин обладает определенными преимуществами по сравнению с Церебролизином: он снижает летальность, сокращает длительность пребывания в стационаре и ускоряет регресс очаговых неврологических симптомов при инсульте средней и легкой степени тяжести. И наконец, немаловажно, что Актовегин способен потенцировать эффекты таких препаратов, как сартаны, блокаторы АПФ и соли оротовой кислоты. Завершая свое выступление, профессор Г.Е. Иванова рассказала о таких реабилитационных методиках, как вертикализация и роботизированная терапия, а также о способах определения оптимальной интенсивности реабилитационных мероприятий.
Заключение
Сейчас, когда одновременно существуют тенденции к удлинению периода активной жизни и увеличению доли людей старшего возраста в популяции, вопросы эффективности реабилитации после церебрального инсульта становятся все острее. Действительно, пациенты, перенесшие инсульт, уже сегодня могут рассчитывать на существенное восстановление навыков самообслуживания, возможно, еще через некоторое время неврологи и реабилитологи смогут уменьшить процент случаев инсульта, приводящих к утрате трудоспособности и инвалидизации пациентов. Разумеется, достичь таких результатов удастся только в том случае, если врачи будут обладать всей необходимой информацией о медикаментозных и немедикаменозных методах реабилитации пациентов, перенесших инсульт, в частности, с использованием таких нейропротекторов, как Цераксон и Актовегин.