Секретные материалы. XX Съезд оториноларингологов России. Сателлитный симпозиум компании «Алкалоид»
- Аннотация
- Статья
- Ссылки



Персистирующая инфекция верхних дыхательных путей: как избежать и как лечить
Симпозиум открыл заведующий кафедрой, директор клиники болезней уха, горла и носа Первого Московского государственного медицинского университета им. И.М. Сеченова, главный оториноларинголог Минздрава по Центральной России, д.м.н., профессор Валерий Михайлович СВИСТУШКИН. Он отметил, что во всем мире наблюдается неуклонный рост антибиотикорезистентности и распространения устойчивых штаммов микроорганизмов. Как следствие – ежегодное увеличение числа летальных исходов, обусловленных инфекциями, вызванными полирезистентными возбудителями. При сохранении тенденции развития антибиотикорезистентности к 2050 г. количество летальных исходов, связанных с инфекциями, вызванными резистентными бактериями, достигнет 10 млн.
В последние годы в мире отмечается увеличение доли возбудителей инфекций дыхательных путей, в том числе Streptococcus pneumoniae, Haemophilus influenzae, не чувствительных к макролидам1, 2.
В России также наблюдается тенденция к увеличению уровня устойчивости к амоксициллину и макролидам возбудителей респираторных и ЛОР-инфекций. В настоящее время в лечении пациентов с внебольничной инфекцией дыхательных путей ведущую роль играют препараты группы бета-лактамов, макролиды рассматриваются как альтернативные препараты.
Последние данные свидетельствуют о продолжении эволюции резистентности бактериальных возбудителей, возникновении микробной панрезистентности. Формированию и распространению резистентности микроорганизмов способствуют нерациональное использование антибиотиков, неправильный выбор препарата, дозы, продолжительности курса, несоблюдение пациентами режима лечения, использование некачественных медикаментов. Так, по данным американских ученых, в 51,7% случаев антибактериальные препараты назначаются необоснованно или в отсутствие показаний к их применению3.
Как показали результаты австралийского исследования, при острых инфекциях дыхательных путей антибактериальная терапия назначается в 4–9 раз чаще, чем рекомендовано. Например, в клинических рекомендациях отсутствуют указания на применение антибиотиков при остром бронхите/бронхиолите. Между тем в клинической практике их используют в 85% случаев4.
Важную роль в развитии антибиотикорезистентности играет отношение населения к лечению. По данным опроса, проведенного в 2011 г. Всероссийским центром изучения общественного мнения, до 95% населения нашей страны, не имеющего медицинского образования, хранит в домашних аптечках в среднем семь видов антибактериальных препаратов. Наиболее распространенными являются бисептол и левомицетин.
Кроме того, в многочисленных исследованиях последних лет доказана нерациональность применения антибактериальной терапии при острых респираторных вирусных инфекциях, особенно на ранних стадиях. Профилактическое назначение антибактериальных препаратов при респираторных вирусных заболеваниях повышает риск развития бактериальной инфекции. Респираторный тракт здорового человека содержит свыше 140 различных геномов микроорганизмов, бронхиальное древо – 2000 бактериальных геномов на 1 см2 поверхности. Дисбиоз респираторного тракта, желудочно-кишечного тракта, кожи, возникающий на фоне антибиотикотерапии, способствует клиническому развитию патогенной бактериальной инфекции, а также аллергической предрасположенности5, 6.
Среди ошибок, допускаемых при лечении, в частности, острого гнойного синусита средней степени тяжести, в нашей стране следует отметить использование линкомицина, ранних фторхинолонов (ципрофлоксацин), половинных доз макролидов, а также инъекционных форм антибиотиков.
Директор института антимикробной химиотерапии Смоленской государственной медицинской академии, президент Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), д.м.н., профессор Р.С. Козлов в информационном письме о состоянии антимикробной резистентности основных респираторных патогенов в России (2018) отметил, что в амбулаторной практике приоритетным считается использование пероральных лекарственных форм антибиотиков с высокой биодоступностью.
По данным российских экспертов, при лечении пациентов с острым стрептококковым тонзиллитом часто встречаются нарушения, приводящие к развитию антибиотикорезистентности. Речь прежде всего идет о пренебрежении врачей к выполнению микробиологических исследований, необоснованном предпочтении местного лечения в ущерб системной терапии, недооценке клинической и микробиологической эффективности и безопасности пенициллинов, назначении сульфаниламидных препаратов, ко-тримоксазола, тетрациклина, фузидина, а также сокращении курса антибиотикотерапии на фоне клинического улучшения7.
Исследователи проанализировали 225 случаев назначения антибактериальных препаратов при острой инфекции верхних дыхательных путей (острый ринофарингит, острый бронхит, острый тонзиллит, острый средний отит, острый синусит) в амбулаторной педиатрической практике, а также изучили тактику ведения 478 детей с внебольничной пневмонией. В ходе исследования был выявлен ряд ошибок: при острых респираторных вирусных инфекциях не проводилась отоскопия, при тонзиллитах не применялся Стрептатест, антибактериальные препараты назначались в дозах ниже рекомендованных, длительность антибиотикотерапии при тонзиллитах, риносинуситах и заболеваниях, вызванных атипичной флорой, составляла менее десяти дней. Необоснованное назначение антибактериальных препаратов имело место в 43,5% случаев острой респираторной патологии8.
Во многих странах отпуск антибиотиков без рецепта запрещен законом и нормативно-правовыми актами. Тем не менее, по данным метаанализа, в мире 62% антибактериальных препаратов отпускается без рецепта. Чрезмерное бесконтрольное использование антибиотиков может способствовать развитию и распространению устойчивости к антибиотикотерапии9.
Стратегия сдерживания роста антимикробной резистентности прежде всего включает принципы рационального назначения антибактериальных препаратов. Их следует назначать только при бактериальной инфекции. Оптимальный режим антибактериальной терапии подбирают исходя из степени тяжести инфекции, фармакодинамических свойств антибактериального препарата, локальной резистентности возбудителей инфекции. Необходимо интегрировать данные о локальной бактериальной резистентности, эффективности и экономической целесообразности антибиотикотерапии, способствовать повышению приверженности пациентов лечению10, 11.
Таким образом, медицинская общественность должна следить за выполнением рекомендаций, направленных на предупреждение распространения антимикробной резистентности. В нашей стране разработчиком клинических рекомендаций по ЛОР-болезням Минздравом России назначена Национальная медицинская ассоциация оториноларингологов. Российские эксперты периодически издают практические рекомендации по стратегии и тактике рационального применения антимикробных средств в амбулаторной практике, публикуют новые данные об этиологической значимости и резистентности микроорганизмов. Так, последние данные демонстрируют, что, несмотря на небольшую распространенность Moraxella catarrhalis в нашей стране, этот возбудитель часто участвует в развитии респираторных инфекций, особенно у детей, в комбинации с гемофильной палочкой и пневмококком. Почти все штаммы M. catarrhalis продуцируют бета-лактамазы. При этом незащищенный амоксициллин неэффективен при инфекциях, в развитии которых участвуют M. catarrhalis12.
Получены новые данные о росте показателей устойчивости S. pneumoniae к амоксициллину: в среднем по России частота умеренно резистентных штаммов превышает 20%, а резистентных – 11%. Распространение пенициллин-резистентных пневмококков сопровождается увеличением числа изолятов, не чувствительных к парентеральным цефалоспоринам третьего поколения (цефтриаксону), – 17,6% умеренно резистентных и 6,9% резистентных13.
Итак, ведущую роль в терапии внебольничных респираторных и ЛОР-инфекций играют препараты группы бета-лактамов – аминопенициллины и цефалоспорины. При инфекциях дыхательных путей, в частности различных тонзиллофарингитах, крайне важно учитывать этиологию и тяжесть заболевания, чувствительность возбудителя, предшествующую антибактериальную терапию.
В национальных клинических рекомендациях по лечению острого синусита препаратом первого выбора для стартовой эмпирической терапии назван амоксициллин. Из альтернативных препаратов рекомендованы цефиксим, амоксициллин/клавуланат, амоксициллин/сульбактам, цефуроксим14. Как известно, устойчивость S. pneumoniae к бета-лактамным антибиотикам не связана с продукцией бета-лактамаз.
Согласно резолюции совета экспертов Национальной медицинской ассоциации оториноларингологов, при назначении антибактериальной терапии необходимо придерживаться принципа минимальной достаточности: при равной эффективности преимущество отдается антибиотикам более узкого спектра. Необоснованное использование для стартовой терапии антибиотиков широкого спектра, в том числе ингибитор-защищенных аминопенициллинов, может способствовать более интенсивному росту микробной резистентности и снижению безопасности лечения. Предпочтительны цефалоспорины с высокой активностью в отношении пневмококка, гемофильной палочки и бета-гемолитического стрептококка.
Цефиксим – бактерицидный цефалоспорин третьего поколения с выраженной антибактериальной активностью против большинства грамположительных и грамотрицательных микроорганизмов. При инфекциях дыхательных путей цефиксим является подходящей альтернативой амоксициллину/клавуланату15.
В многочисленных исследованиях цефиксим продемонстрировал активность в отношении 100% штаммов H. influenzae и считается препаратом выбора при хронических и рецидивирующих респираторных инфекциях12, 16. Так, микробиологическая эффективность цефиксима в отличие от других антибиотиков при остром среднем отите достигает 100%17.
По данным метаанализа 35 исследований, десятидневная терапия стрептококкового тонзиллита у детей пероральными цефалоспоринами клинически и микробиологически эффективнее аналогичных курсов пероральных пенициллинов на 14,9 и 17,2% соответственно18.
Подводя итог, профессор В.М. Свистушкин подчеркнул, что цефалоспорины, в частности Панцеф®, также можно использовать, когда острый тонзиллит трудно дифференцировать с инфекционным мононуклеозом, имеются опасения развития кожной сыпи на фоне применения амоксициллина, а также при наличии в анамнезе нетяжелых аллергических реакций на пенициллины.
Коронавирусная пандемия и ее последствия
Профессор кафедры оториноларингологии им. академика Б.С. Преображенского лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова, д.м.н. Александр Владимирович ГУРОВ акцентировал внимание коллег на последствиях нерационального назначения антибиотиков в период пандемии COVID-19.
Современная эпидемиологическая ситуация поставила перед медицинским сообществом множество вопросов, требующих немедленного решения. Речь прежде всего идет о проблемах влияния новой коронавирусной инфекции на течение хронической и острой патологии ЛОР-органов. По мнению большинства ученых, коронавирусная инфекция далеко не последняя пандемия. По прогнозам Всемирной организации здравоохранения, уже в ближайшие пять лет не исключено появление похожих респираторных вирусов, способных вызывать не менее выраженные пандемические изменения. Это обусловлено множеством факторов, среди которых ключевым считается появление новых вирусных мутаций. Коронавирусы имеют самую длинную по протяженности структуру генома среди вирусных субстанций в современной вирусологии. И поэтому появление новых вирусных частиц – естественный процесс, связанный с мутацией этих биологических объектов. Результаты исследований, проведенных до распространения COVID-19, продемонстрировали высокую частоту бактериального суперинфицирования после активности респираторных вирусов.
На фоне сформировавшегося хронического патологического процесса могут присутствовать вирусные патогены, также поддерживающие изменения в структуре слизистой оболочки респираторного тракта. Вирусы стимулируют регуляцию различных рецепторов, необходимых для бактериальной адгезии, а также последующую колонизацию, размножение и транслокацию микроорганизмов19.
Сообщество респираторных вирусов и бактерий постоянно подвергается эволюционно обусловленным синергетическим и конкурентным межвидовым взаимодействиям.
Важно, что респираторные вирусы вызывают стимуляцию различных рецепторов, являющихся точкой приложения разных вирусов. Они стимулируют последующую бактериальную колонизацию, размножение и даже транслокацию микробов, то есть их переход из одного локуса в другой, и возможность развития в нем патологического процесса.
Все эти явления эволюционно обусловлены. В процессе изучения вирусного и бактериального взаимодействия было установлено их общее эволюционное сродство к структуре слизистой оболочки.
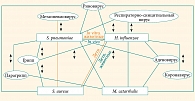
Интересен факт, что большинство респираторных вирусов вызывает стимуляцию и появление в равной степени как пневмококка, так и гемофильной палочки. Единственным исключением из этого правила является коронавирус, который стимулирует появление только гемофильной палочки (рис. 1)19. Это и является ответом на вопрос, почему в настоящее время на фоне коронавирусной пандемии отсутствуют пациенты с ярко выраженной гнойно-воспалительной симптоматикой.
2020 г. стал переломной вехой в плане присутствия гемофильной палочки. Если на протяжении многих лет наблюдения отмечалось увеличение ее присутствия, то в 2020 г. впервые коронавирусная инфекция привела к значительному росту гемофильной инфекции и ее преобладанию над пневмококковыми патогенами.
Как известно, пневмококковая инфекция, вызванная S. рneumoniae, встречается часто, в основном при острой гнойной патологии ЛОР-органов. Основными факторами патогенности пневмококков являются токсины – пневмолизины, блокирующие фагоцитарные функции и обусловливающие воспалительные изменения слизистой оболочки полости носа, околоносовых пазух и полости среднего уха. Спонтанная эрадикация пневмококка не встречается. В свою очередь H. influenzae радикальным образом отличается по своим микробиологическим свойствам от пневмококков. Основной фактор патогенности гемофильной палочки – эндотоксин, или капсульный полисахарид клеточной стенки, обладающий прямым цилиотоксическим действием. Инфекция, вызванная H. influenzae, часто имеет субклинические формы, при этом происходят деструктивные изменения эпителия, цилиостаз, возникает высокий риск осложнений, ранней хронизации процесса. У пациентов, перенесших COVID-19, выявляются признаки поражения слизистой оболочки, вызванные H. influenzae, наблюдается рецидивирующий характер течения инфекции.
Кроме того, наиболее распространенным заболеванием среди инфекций глотки является стрептококковый тонзиллит, обусловленный S. pyogenes. При этом данный вид бактерий выявляют не только у пациентов с хронической тонзиллярной патологией, но и у клинически здоровых пациентов. Основы патогенеза стрептококковой инфекции, вызванной бета-гемолитическим стрептококком группы A (БГСА), связаны с антигенной структурой самого возбудителя, а также вырабатываемыми им экзотоксинами – O- и S-стрептолизинами. Стрептолизин S действует преимущественно в очаге поражения, а стрептолизин O – на весь организм в целом, вызывая его массивную сенсибилизацию и опосредуя таким образом развитие иммунокомплексной патологии.
В отличие от острого воспалительного процесса при хронической гнойной патологии ЛОР-органов микрофлора изменяется по типу суперинфицирования. При этом радикально меняется не только качественный состав самой микрофлоры, но и характер течения инфекционного процесса, выражающийся как в стойкой интоксикации организма, так и патоморфологических изменениях непосредственно в очаге поражения. Количественно-качественный состав микрофлоры при хронических гнойных заболеваниях ЛОР-органов отличается разнообразием.
Анаэробные бактерии также играют значительную роль в этиологии острого и хронического синусита. В условиях патоморфологических изменений при хроническом гнойно-воспалительном процессе отмечается активация облигатной анаэробной микрофлоры. В частности, в развитии одонтогенного синусита, одонтогенного гаймороэтмоидита участвуют микробные ассоциации анаэробных микроорганизмов.
Современные научные данные свидетельствуют о том, что в организме человека все бактерии существуют преимущественно в составе биопленок. Микробные биопленки – сообщества, образованные родственными и неродственными бактериями, отграниченными от внешней среды дополнительными оболочками, внутри которых клетки имеют специализацию и контактируют между собой20. В связи с этим возрастает необходимость в совершенствовании подходов к лечению инфекционных заболеваний и повышении эффективности антимикробной терапии.
На сегодняшний день разработаны рекомендации по применению системной антибактериальной терапии в лечении инфекционных заболеваний респираторного тракта и ЛОР-органов. Так, антибактериальная терапия показана при среднетяжелой и тяжелой форме острого синусита. При легкой форме антибиотики рекомендуются только в случае рецидивирующей инфекции верхних дыхательных путей и сохранения клинической симптоматики свыше 5–7 дней. Кроме того, антибактериальная терапия назначается пациентам с тяжелой сопутствующей патологией и иммунокомпрометированным больным.
Среди актуальных проблем, связанных с эффективностью антибиотикотерапии, – хронизация процесса очаговых поражений ЛОР-органов. Прежде всего это касается нарастающей антибиотикорезистентности пневмококковых инфекций и ранней хронизации процесса при гемофильной инфекции. Сегодня на фоне массового заражения населения COVID-19 и высокой частоты постковидных осложнений данные проблемы усугубились.
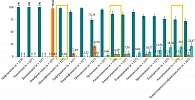
Последние два года стремительно увеличивается резистентность S. рneumoniae к амоксициллину, особенно к азитромицину. В 2020 г. за время тотальной азитромицинотерапии резистентность пневмококка к нему возросла с 8,4 до 38,5%. Начиная с 2020 г. азитромицин в клинических рекомендациях по лечению острого синусита, острого гнойного среднего отита, острого тонзиллита отсутствует в силу неэффективности. Еще один очень важный момент касается того, что происходит с левофлоксацином. О чувствительности пневмококка к левофлоксацину речь не идет в принципе, поскольку используемые концентрации препарата, в том числе высокодозный левофлоксацин, не всегда отвечают требованиям достижения бактерицидного эффекта в клинической практике (рис. 2).
Современные принципы выбора антибактериального препарата при гнойной патологии ЛОР-органов предусматривают:
- активность в отношении предполагаемых возбудителей инфекций ЛОР-органов;
- способность преодолевать потенциальную резистентность возбудителя;
- хорошее проникновение в слизистую оболочку синусов с достижением концентрации выше минимальной подавляющей концентрации (МПК) для данного возбудителя;
- сохранение концентрации в сыворотке крови выше МПК в течение 40–50% времени между приемами препарата.
Следует отметить, что при остром синусите в первые шесть недель течения воспалительного процесса в равной степени встречаются S. рneumoniae и H. influenzae, тогда как в течение последующих шести недель в активации воспалительного процесса превалирующую роль играет H. influenzae. В этом периоде острого синусита, чтобы остановить необратимые изменения в структуре слизистой оболочки и развитие хронизации, необходимо назначать препараты с высокой антигемофильной активностью.
Цефалоспорины третьего поколения характеризуются высокой активностью в отношении грамотрицательной флоры, в том числе H. influenzae. Они высокоэффективны в отношении грамположительной флоры, действуют на стрептококки, в том числе S. рneumoniae, БГСА и др. Цефалоспорины третьего поколения, в частности цефиксим (Панцеф®), рекомендованы в качестве препаратов второй линии терапии при остром риносинусите, обострениях хронического синусита, остром среднем отите, остром тонзиллите, а также рецидивирующем А-стрептококковом тонзиллите.
Мишенью цефалоспоринов, относящихся к бета-лактамным антибиотикам, служат пенициллинсвязывающие белки – транспептидазы прокариотических клеток, обусловливающие процесс поперечного сшивания гетерополимерных цепей пептидогликана, важнейшего структурного компонента клеточной стенки прокариот. Вследствие инактивации транспептидаз сборка полноценной клеточной стенки становится невозможной, и клетка лизируется под избыточным осмотическим давлением цитоплазмы.
По словам докладчика, изучения требует проблема перекрестной реактивности у пациентов, в первую очередь сенсибилизированных к цефалоспоринам и потенциально страдающих аллергией на пенициллины. Установлено, что вероятность перекрестной гиперреактивности между пенициллинами и цефалоспоринами третьего и четвертого поколения не превышает 2%21.
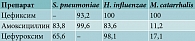
Препарат цефиксим (Панцеф®) высокоэффективен в отношении пневмококка, гемофильной палочки, моракселлы, S. pyogenes (таблица)16, 22–24.
В международном исследовании бактериальной устойчивости к антибактериальным препаратам чувствительность 161 изолята S. pneumoniae к цефиксиму составила 93,8%. 100%-ную чувствительность к препарату продемонстрировали 143 изолята H. influenzae и 874 изолята Moraxella catarrhalis25.
Препарат Панцеф®, характеризующийся рядом преимуществ, считается препаратом выбора при респираторных заболеваниях в различных группах больных. В ряде исследований подтверждена безопасность применения цефиксима во время беременности. Использование препарата во время беременности не увеличивает риск врожденных аномалий26.
Кроме того, в экспериментальных исследованиях доказано, что концентрации препарата, создаваемые в грудном молоке, не являются клинически значимыми для новорожденных, находящихся на грудном вскармливании27.
Препарат Панцеф® отличается хорошей переносимостью и удобством применения, выпускается в различных лекарственных формах и дозах для перорального применения: в таблетках и гранулах для приготовления суспензии.
В заключительной части своего выступления А.В. Гуров остановился на вопросах лечения респираторных инфекций с использованием антибактериальных препаратов из группы хинолонов. Хинолоны – препараты выбора при неэффективности предыдущих курсов антибиотикотерапии, поражениях с высоким риском развития осложнений. Этот вид антибиотиков применяют при облигатных анаэробных инфекциях, хронических воспалительных процессах. Хинолоны назначают пациентам с полисинуситом, изменениями цитоархитектоники слизистой оболочки ЛОР-органов и рецидивирующими гнойно-воспалительными процессами.
В клинических рекомендациях хинолоны, в частности моксифлоксацин, рекомендованы в качестве средств третьей линии для лечения острого риносинусита, обострений хронического риносинусита.
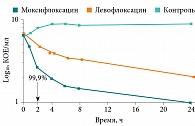
Препарат Кимокс® (моксифлоксацин) относится к четвертому поколению фторхинолонов (респираторным и антианаэробным). Механизм действия моксифлоксацина обусловлен блокированием двух бактериальных топоизомераз II и IV, что приводит к нарушению процессов репликации, репарации и транскрипции биосинтеза ДНК микробной клетки. Кимокс® – антибактериальный препарат широкого спектра действия. По данным исследований, моксифлоксацин in vitro активен в отношении широкого спектра грамотрицательных и грамположительных микроорганизмов, анаэробов, кислотоустойчивых бактерий и атипичных бактерий, а также бактерий, резистентных к бета-лактамным и макролидным антибиотикам. Кимокс® отличается высокой скоростью бактерицидного действия. Так, через два часа после приема препарата погибает 99,9% бактерий S. pneumoniae (рис. 3)28.
Моксифлоксацин быстро проникает в ткани дыхательной системы, органы мочеполовой системы, костную ткань, спинномозговую жидкость, при этом уровни тканевых концентраций препарата выше, чем в крови. Моксифлоксацин избирательно накапливается в тканях: его концентрация в ткани синусов даже в отсутствие воспаления в несколько раз превышает концентрацию в плазме; концентрация внутри макрофагов в 8–12 раз выше плазменной.
Важно, что моксифлоксацин сохраняет антимикробную активность в стандартных дозах. Резистентность микроорганизмов к моксифлоксацину на протяжении почти 20 лет клинического применения остается крайне низкой и стабильной, доза не изменяется на протяжении всего периода использования препарата29.
Более того, воздействие препарата эквивалентно для перорального и внутривенного введения, что обеспечивает возможность переключения между режимами терапии без необходимости менять препарат или дозу.
Таким образом, в период пандемии COVID-19 из-за возросшего применения антибактериальных препаратов перед населением планеты еще более остро встали вопросы антибиотикорезистентности. Только рациональное и обоснованное использование антибактериальных препаратов при респираторных и ЛОР-инфекциях с учетом данных о виде возбудителя инфекции и его чувствительности позволит предотвратить дальнейшее распространение антибиотикорезистентности.
Дифференциальная диагностика заболеваний ротоглотки
Профессор кафедры болезней уха, горла и носа Первого Московского государственного медицинского университета им. И.М. Сеченова, д.м.н. Галина Николаевна НИКИФОРОВА остановилась на вопросах диагностики и лечения заболеваний глотки. Она напомнила, что глотка выполняет важные функции в организме человека, участвуя в процессах пищеварения, дыхания, голосообразования, формирования речи, а также защитных механизмах. Защитный механизм глотки реализуется за счет активной работы лимфоэпителиального кольца, рефлекторного сокращения мускулатуры глотки, кашля. Среди факторов мукозальной иммунной системы глотки важную роль играет микробиом. Он участвует в обменных и защитных процессах, обеспечивает антагонизм по отношению к ряду патогенов, обеспечивает колонизационную резистентность слизистой оболочки, препятствует выделению токсинов патогенными микроорганизмами, выполняет иммуногенную функцию. Глотка – один из наиболее сложных и многочисленных биоценозов макроорганизма.
Фарингеальная лимфоидная ткань участвует в формировании местного и общего иммунитета. Все компоненты лимфоэпителиального глоточного кольца входят в состав единой иммунной системы, формируя иммунологическую резистентность организма. Такое формирование происходит на фоне реализации основных функций лимфаденоидного глоточного кольца: защитной барьерной функции и местного иммунитета миндалин и системного иммунного ответа, запущенного сенсибилизацией лимфоцитов миндалин.
Миндалины – уникальные образования, которые создают условия для постоянной трансэпителиальной миграции макрофагов и других антигенпрезентирующих клеток. Без механизма антигенпрезентации патогены, находящиеся на поверхности слизистой оболочки дыхательных путей, недоступны для запуска иммунного ответа. Иммунный ответ на инфекционный агент можно получить только после его внедрения в ткань, то есть в случае болезни. Миндалины и предназначены для того, чтобы организм мог реагировать на окружающую микрофлору без развития болезни.
Антигенная стимуляция глоточного лимфоэпителиального кольца осуществляется в несколько этапов:
- презентация антигена (антигенпрезентирующая клетка периферических лимфоидных органов, в том числе региональных лимфоузлов, дренирующих кольцо Вальдейера);
- стимуляция и клональная экспансия В- и Т-эффекторных клонов, которые отвечают данному антигену;
- поддержание и регуляция иммунного ответа.
Докладчик отметила, что воспалительные процессы в глотке – одни из самых распространенных в мире. Особенно часто встречаются в детском возрасте, за исключением детей первого года жизни. В России на долю острого тонзиллофарингита приходится 3–7% общего числа регистрируемых заболеваний и 17–42% инфекций. Точных эпидемиологических данных об острых воспалительных процессах в глотке нет, что обусловлено необязательностью их регистрации и отсутствием единой терминологии при формулировке диагноза.
Самыми частыми жалобами у пациентов с заболеваниями глотки являются боль или дискомфорт в горле, ощущение саднения, першения в покое, чувство инородного тела, затруднение носового дыхания, гнусавость. Имеют место такие симптомы и субъективные ощущения, как заложенность в ушах, поверхностный кашель, сухость или повышенная саливация, стекание слизи по задней стенке глотки, продуктивный кашель.
Выраженный болевой синдром при остром фарингите объясняется богатством иннервации глотки. Чувствительная, двигательная и вегетативная иннервация – глоточное сплетение, расположенное на наружной поверхности среднего констриктора глотки под щечно-глоточной фасцией – ветви языкоглоточного и блуждающего нервов, а также симпатических волокон верхнего шейного ганглия. В области устьев слуховых труб имеются нервные связи со второй ветвью тройничного нерва.
Болью в глотке может сопровождаться ряд патологических процессов. «Отраженные» боли в глотке отмечаются при заболеваниях щитовидной железы, невралгии языкоглоточного и/или верхнегортанного нерва, рефлюкс-эзофагите, сердечной патологии, патологии уха, инородных телах в респираторном тракте. Так, жалобы на боль в горле предъявляют пациенты с синдромом Игла – Стерлинга, эпиглоттитом. Однако в большинстве случаев причинами боли в горле становятся вирусы. У 5–15% взрослых и 30–40% детей заболевание вызывают невирусные инфекционные агенты. Среди невирусных возбудителей особое значение имеет БГСА (S. pyogenes). Нередко встречаются S. pneumoniae, S. aureus, H. influenzae и другие патогены. Экономический ущерб, обусловленный инфекцией БГСА, в десять раз выше, чем ущерб от вирусных гепатитов вместе взятых.
Носителем БГСА являются более 20% детей школьного возраста. Чаще БГСА вызывает такие заболевания, как ангина, фарингит, скарлатина, рожистое воспаление, паратонзиллярный абсцесс, флегмона шеи, сепсис, отит, менингит.
Острый катаральный вирусный тонзиллофарингит характеризуется рядом различных жалоб на боль в глотке, локальную или мигрирующую, усиливающуюся при проглатывании слюны («пустой» глоток), симптомы дисфункции слуховой трубы, сухой поверхностный кашель, сопутствующую диарею. Как правило, при вирусном тонзиллофарингите интоксикация выражена незначительно, за исключением стрептококковой ангины.
Острый стрептококковый тонзиллофарингит (ангина) – острое общее инфекционное заболевание с преимущественным поражением лимфоаденоидной ткани глоточного кольца. Различают подтипы – ангину язычной миндалины, глоточной миндалины, гортанную ангину, ангину боковых валиков глотки. По механизму возникновения заболевания различают эпизодическую и эпидемическую формы.
При остром стрептококковом тонзиллофарингите интоксикация выражена в значительной степени, отмечаются болевые ощущения в глотке, усиливающиеся при приеме пищи, гиперемия слизистой глотки, миндалин, отек, экссудат, фибринозный налет в области лакун, зачелюстной лимфаденит.
Наличие других респираторных симптомов (кашель, ринит, охриплость), а также конъюнктивит, стоматит, диарея указывают на вирусную этиологию заболевания. Боль при «пустом» глотке, ощущение инородного тела, сухость в горле – признаки вирусной инфекции.
Ангина при скарлатине отличается от других типов ангины характерными признаками: скарлатинозной маской – бледностью носогубного треугольника на фоне румянца щек, энантемой – выраженной гиперемией миндалин, мягкого неба, язычка, резким отграничением гиперемии, выраженным густым белым налетом на языке (малиновый язык при его очищении), экзантемой – мелкоточечной ярко-красной сыпью, более выраженной на сгибах, не распространяющейся на лицо, шелушением с шестого дня заболевания.
Ангина при инфекционном мононуклеозе (болезнь Филатова, железистая лихорадка, моноцитарная ангина) может вызываться вирусом Эпштейна – Барр (вирус герпеса человека 4-го типа), цитомегаловирусом, вирусом герпеса человека 6-го типа. Явления тонзиллофарингита при инфекционном мононуклеозе развиваются, как правило, на 3–5-й день болезни на фоне имеющегося распространенного лимфаденита. Для данного вида ангины характерны белый налет на миндалинах, лихорадка, генерализованная лимфаденопатия, гематологические изменения. Быстро и точно провести дифференциальный диагноз между инфекционным мононуклеозом и острым тонзиллофарингитом можно с помощью показателя соотношения числа лимфоцитов к общему числу лейкоцитов. У пациентов с инфекционным мононуклеозом в отличие от больных острым тонзиллофарингитом выше средний показатель соотношения «лимфоциты/лейкоциты».
При коревой ангине на второй-третий день заболевания на мягком небе появляются мелкие красные пятна, а на слизистой оболочке щек – мелкие белые точечные пятна с красной каймой, напоминающие манную крупу. Они сохраняются 1–3 дня и исчезают во время появления сыпи на коже.
Тонзиллофарингит при дифтерии появляется в первые-вторые сутки. Гиперемия миндалин при этом заболевании носит застойный синюшный характер, наблюдаются умеренная боль в горле, значительный отек небных миндалин. Налет на небных миндалинах пленчатый, выступает над поверхностью тканей, снимается с трудом. У больных регистрируются зачелюстной лимфаденит, изменения гемограммы (нейтрофильный лейкоцитоз). Безусловно, дифтерия считается опасным заболеванием, поэтому ведение пациентов требует безотлагательного лечения с применением сывороточной терапии.
Герпетическая ангина характеризуется ярко-красной гиперемией миндалин, выраженной болью в горле, умеренным отеком небных миндалин. Налет на небных миндалинах представляет собой папулы, везикулы, которые, вскрываясь, образуют язвочки, не сливающиеся с красным венчиком, фибриноидным налетом. У пациентов наблюдаются зачелюстной лимфаденит, в показателях крови – нейтропения, лимфоцитоз.
В ряде случаев у пациентов с острым тонзиллофарингитом обнаруживаются грибковые поражения глотки (фарингомикоз). Обычно они развиваются у детей раннего возраста. Причинами фарингомикоза могут быть перенесенное тяжелое инфекционное заболевание, системная антибиотикотерапия, длительное применение глюкокортикостероидов и иммунодепрессантов. Фарингомикоз характеризуется острым началом с умеренным повышением температуры. Как правило, общие явления выражены слабо, пациентов беспокоят болезненность в горле, першение, сухость. При фарингоскопии определяются увеличение и невыраженная гиперемия миндалин, наложения творожистого вида, снимающиеся без повреждений подлежащей ткани. Могут выявляться твердые желтовато-белые образования, которые распространяются на другие отделы глотки.
При поражении глотки Candida albicans симптомы тонзиллита развиваются на первые-вторые сутки. У больных отмечаются умеренная боль в горле и гиперемия миндалин, белый творожистый налет на небных миндалинах, лимфаденит, в анализах крови – умеренный лейкоцитоз.
Кроме того, боль в горле может быть одним из проявлений острой лихорадочной фазы ВИЧ-инфекции. При лейкозах и других заболеваниях крови ангина развивается в трети случаев. Характерны активные гнойно-геморрагические, некротические изменения. Проявления фарингита встречаются у пациентов с синдромом Маршалла.
При тонзиллофарингите назначают этиотропную, патогенетическую и симптоматическую терапию. Показанием к назначению системных антибиотиков является острый стрептококковый тонзиллофарингит. На сегодняшний день БГСА сохраняет 100%-ную чувствительность ко всем бета-лактамам, включая пенициллины, цефалоспорины, карбапенемы. Бета-лактамы остаются единственным классом антибактериальных препаратов, к которым у S. pyogenes не развилась резистентность. Актуальной на сегодняшний день остается проблема устойчивости микроорганизмов к макролидам, которая в ряде стран превышает 30%.
Макролиды могут быть использованы при инфекциях носоглотки, но только в случае аллергии на бета-лактамы, фармакодинамической неэффективности бета-лактамов и низкой приверженности пациентов терапии.
Цефиксим является препаратом выбора при остром тонзиллофарингите, вызванном БГСА. Следует отметить, что при инфекциях дыхательных путей цефиксим рассматривается в качестве подходящей альтернативы амоксициллину/клавуланату15.
Клиническая эффективность цефиксима в отношении острых и рецидивирующих инфекций при среднем отите, синусите, тонзиллите и бронхите, а также его безопасность доказаны в многочисленных отечественных и зарубежных клинических исследованиях. Согласно российским клиническим рекомендациям, цефиксим (Панцеф®) – эффективный препарат для лечения ЛОР-инфекций30.
Однократный прием цефиксима обеспечивает более высокую приверженность пациентов терапии по сравнению с двух- и трехкратным приемом амоксициллина/клавуланата31.
Результаты метаанализа 35 исследований с участием 7125 пациентов продемонстрировали, что клиническая эффективность цефиксима при стрептококковом тонзиллите у детей на 14,9% превышает таковую пероральных пенициллинов, а микробиологическая эффективность выше на 17,2%18.
В заключение профессор Г.Н. Никифорова подчеркнула, что Панцеф® (цефиксим) – эффективный препарат для лечения ЛОР-инфекций, согласно международным клиническим исследованиям и российским клиническим рекомендациям, с благоприятными фармакокинетическими характеристиками и широким спектром антимикробной активности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.