Нарушение микробиоценоза кишечника в остром периоде инвазивных острых кишечных инфекций у детей с оценкой влияния терапии нифуроксазидом и препаратами группы цефалоспоринов
- Аннотация
- Статья
- Ссылки
- English
В отличие от терапии антибактериальными препаратами применение нифуроксазида у детей с ОКИ инвазивного типа сопровождалось более выраженной положительной динамикой клинической симптоматики ОКИ, более высокой скоростью наступления выздоровления. Отмечалось восстановление альфа-разнообразия, а также сокращение доли представителей условно-патогенных семейств (в частности, Fusobacteriaceae). В подгруппе цефалоспоринов общая доля условных патогенов также снижалась, но восстановления альфа-разнообразия не наблюдалось, что свидетельствовало о персистенции дисбиотических нарушений.
В отличие от терапии антибактериальными препаратами применение нифуроксазида у детей с ОКИ инвазивного типа сопровождалось более выраженной положительной динамикой клинической симптоматики ОКИ, более высокой скоростью наступления выздоровления. Отмечалось восстановление альфа-разнообразия, а также сокращение доли представителей условно-патогенных семейств (в частности, Fusobacteriaceae). В подгруппе цефалоспоринов общая доля условных патогенов также снижалась, но восстановления альфа-разнообразия не наблюдалось, что свидетельствовало о персистенции дисбиотических нарушений.

Актуальность изменений микробиоценоза кишечника при ОКИ
В структуре инфекционной патологии у детей и взрослых острые кишечные инфекции (ОКИ) прочно занимают одну из лидирующих позиций. В общей структуре инфекционных заболеваний им принадлежит второе место после острых респираторно-вирусных инфекций и гриппа (более 40% всех госпитализированных больных) [1]. Ситуация усугубляется достаточно высокой смертностью от кишечных инфекций, особенно в раннем детском возрасте. По данным Всемирной организации здравоохранения, в мире ежегодно регистрируется около 1,7 млрд случаев диареи. В развивающихся странах дети в возрасте до трех лет переносят диарею в среднем три раза в год. При этом ОКИ сохраняют второе место по значимости в структуре детской смертности в возрасте до пяти лет – ежегодно от нее умирает 760 тыс. детей [2, 3].
Изменение микробиоценоза кишечника при ОКИ является одним из ключевых факторов патогенеза воспалительного процесса и может утяжелять течение заболевания и приводить к развитию осложнений [4].
Сегодня очевидно, что совокупность микроорганизмов – микробиом представляет собой огромный микробный орган человека, который не уступает по функциональной значимости другим органам [5]. Микробиоценоз кишечника человека играет важную роль в поддержании гомеостаза организма, в функции которого входят колонизационная резистентность (межвидовой антагонизм, активация иммунной системы), детоксикация (гидролиз продуктов метаболизма: белков, углеводов, жиров), синтетическая (синтез витаминов, гормонов антибиотических веществ) и пищеварительная функции (ферментативная, регуляция всасывания, регуляция моторики) [6]. Однако микробиоценоз кишечника может быть подвержен изменениям при патологических состояниях, приводящих к изменению доли участия микроорганизмов в физиологических процессах. Возникает дисбаланс в снабжении других органов зависимыми от микробов веществами, нарушаются гомеостаз метаболических процессов, стабильность иммунной системы [7]. В случае превышения компенсаторных ресурсов организма возрастает риск реализации негативных функций микробиоценоза, таких как возникновение эндогенной инфекции (гнойно-септические и другие болезни), сенсибилизация (в виде аллергических проявлений), сохранение плазмидных генов (формирование патогенных клонов), мутагенная активность (развитие опухолей) [6]. Изменение состава микробного сообщества ассоциировано со многими заболеваниями. На сегодняшний день получены доказательства роли кишечной микробиоты в патогенезе аллергических, аутоиммунных заболеваний, метаболического синдрома, сахарного диабета, артериальной гипертензии, заболеваний печени и желчевыводящих путей и др. [8].
В отличие от взрослых у детей в первые 3–5 лет жизни микробиоценоз кишечника в целом характеризуется меньшей устойчивостью. Микробиота, находясь в стадии формирования [5], обладает высокой индивидуальной вариабельностью видового состава, особенно у детей первого года жизни [9]. Нарушение баланса микробиоценоза на данном этапе развития может иметь отдаленные негативные последствия. Это особенно актуально при внешнем стрессорном воздействии на систему микробиоценоза, в частности при ОКИ [4].
Лекарственные препараты, назначаемые при инвазивных ОКИ, по-разному влияют на количественный и качественный состав микробного сообщества и могут опосредованно воздействовать как на ход выздоровления, так и на развитие в дальнейшем хронического воспаления и осложнений. Наиболее тяжелым и даже угрожающим жизни состоянием, связанным с антибиотик-ассоциированным дисбактериозом кишечника, является Сlostridium difficile-ассоциированный колит [10]. Clostridium difficile обусловлены поражения толстой кишки в виде псевдомембранозного колита у пациентов, получавших интенсивную антибактериальную терапию [11].
Внедрение новейших методов молекулярно-генетического анализа значительно расширило представление о составе и функциях кишечного микробиоценоза. Стало очевидно, что полученные с помощью бактериологического метода исследования данные о составе микробиоты и его изменении при различных заболеваниях и состояниях отражают лишь верхушку айсберга. Разнообразие населяющих организм человека микроорганизмов огромно [12]. Этот скрытый биоценоз удалось обнаружить лишь благодаря современным методам метагеномного секвенирования [13]. Метод оценки состояния микробиоценоза желудочно-кишечного тракта на основе секвенирования 16S рРНК бактерий в образцах кала можно считать оптимальным для определения состава микробиоты кишечника.
Новые методы изучения микробиоценоза находятся в стадии разработки и внедрения, отсутствует клиническое осмысление полученных данных, однако именно они открывают новые перспективы для более глубокого понимания микробного взаимодействия, в том числе о роли состояния микробиоценоза при ОКИ у детей. Требуется дальнейшее изучение своевременной коррекции сдвига микробиоценоза, возникшего, с одной стороны, на фоне агрессивного воздействия внешнего возбудителя, с другой, на фоне проведения антибактериальной терапии.
Цель исследования – оценить состав микробиоты кишечника в остром периоде инфекционной диареи у детей и сравнительного влияния на него терапии нифуроксазидом и препаратами группы цефалоспоринов.
Материал и методы
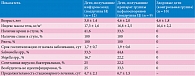
Исследование проводилось в 2018–2019 гг. на базе ИКБ № 2 Департамента здравоохранения г. Москвы, было одобрено локальным этическим комитетом ФБУН ЦНИИ эпидемиологии Роспотребнадзора. В исследование был включен 21 больной ОКИ инвазивного типа – пациенты обоего пола в возрасте от шести месяцев до 14 лет, госпитализированные на 1–4-й день заболевания с симптомами острого гастроэнтероколита/энтероколита. Все пациенты при включении в исследование имели клинические проявления инвазивной диареи, в том числе «колитный» стул (100%), примеси слизи и крови в стуле (гемоколит у 41,6 и 33,3% детей) в сочетании с другими типичными симптомами ОКИ. Исходная частота стула составила 5,9 ± 2,4 эпизода в сутки в подгруппе нифуроксазида и 6,7 ± 1,9 – в подгруппе цефалоспоринов. Клинические характеристики участников исследования представлены в табл. 1.
При первичном осмотре проводились сбор анамнеза, объективный осмотр с оценкой симптомов ОКИ. При соответствии критериям включения и отсутствии критериев невключения пациента включали в исследование и рандомизировали методом «конвертов» в одну из двух исследуемых подгрупп. Пациенты основной группы были рандомизированы на две подгруппы. Подгруппу Н составили 12 пациентов, получавших противомикробную терапию препаратом нифуроксазид (Энтерофурил). Дети в возрасте от шести месяцев до трех лет получали 100 мг нифуроксазида (2,5 мл суспензии) три раза в сутки, дети 3–6 лет – 200 мг нифуроксазида (5 мл суспензии) три раза в сутки, дети 6–18 лет – 200 мг нифуроксазида (5 мл суспензии) четыре раза в сутки.
Подгруппу Ц составили девять пациентов, получавших противомикробную терапию препаратом из группы цефалоспоринов (цефтриаксон 50 мг/кг/сут или цефотаксим 100 мг/кг/сут).
Длительность курса антибактериальной терапии составила 5–7 дней. Средний возраст пациентов в подгруппе Н составил 3,8 ± 1,4 года, в подгруппе Ц – 4,6 ± 2,0 года и не отличался достоверно от пациентов контрольной группы (4,6 ± 1,8 года, тест Стьюдента, p < 0,05).
В контрольную группу вошли десять здоровых детей, критериями включения для которых были:
- отсутствие симптомов ОКИ или клинической картины других острых инфекционных заболеваний в течение месяца, предшествовавшего включению в исследование;
- отсутствие сведений о применении антибиотиков или пробиотиков в течение трех месяцев до включения в исследование.
Больные ОКИ наряду с антибактериальной терапией получали патогенетическую – регидратационную терапию и энтеросорбенты. По показаниям и/или в случае развития осложнений врач назначал посиндромную терапию – парентеральное введение средств с целью регидратации и дезинтоксикации, жаропонижающие и спазмолитические препараты.
В исследование не включались пациенты с сопутствующей хронической инфекционной патологией (хронические гепатиты, ВИЧ-инфекция) и/или тяжелой сопутствующей соматической патологией (пороки развития, детский церебральный паралич, сахарный диабет, сердечная недостаточность и др.).
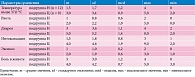
Клиническое наблюдение за пациентами проводилось ежедневно в течение всего периода госпитализации – 5–10 суток. Ежедневно врач-исследователь проводил сбор жалоб, объективный осмотр (с оценкой симптомов заболевания и характеристик стула), контроль и оценку терапии (табл. 2).
Для определения этиологии ОКИ перед началом антибактериальной терапии проводился забор фекалий для молекулярно-генетического исследования в клиническом материале методом ПЦР аденовирусов группы F, ротавирусов группы А, норовирусов 2-го генотипа, астровирусов, микроорганизмов рода Shigella, энтероинвазивных Escherichia coli, Salmonella и термофильных Campylobacter. Выполнялось также бактериологическое исследование (посев) фекалий на наличие патогенных энтеробактерий.
Всем пациентам выполнено исследование микробного состава образцов кала с использованием секвенирования гена 16S рРНК бактерий. Анализ данных проведен на платформе «Кномикс-Биота» [14]. Первичные данные секвенирования (риды) обработаны с помощью программного пакета QIIME2 [15]. К ридам применяли алгоритм DADA2 [16] для очистки от шумоподобных прочтений и получения представленности уникальных последовательностей с точностью до одного нуклеотида. Таблицы относительной представленности на уровне семейства сформированы за счет суммирования представленности последовательностей, принадлежащих соответствующему семейству. Дополнительный анализ данных проведен с помощью языка R [17].
Для изучения состава микробиоты кишечника у всех участников выполнен забор образцов фекалий до начала антибактериальной терапии, а также на 5–7-й день антибактериальной терапии, при наличии первичного подтверждения бактериальной этиологии острого гастроэнтероколита/энтероколита. В подгруппе Н спустя 23–25 дней от момента окончания антибактериальной терапии проведен дополнительный забор образца фекалий.
Для оценки изменений в микробиоме, ассоциированных с заболеванием и терапией, проанализирована относительная представленность семейств бактерий-оппортунистов как отдельно, так и суммарно. Эти величины характеризуют степень отклонения состава микробиоты от нормы. В данном исследовании использован индекс Шеннона, который позволяет оценить не только количество детектированных таксонов в образце, но и равномерность уровней их представленности. Для каждого образца оценивали разнообразие микробного сообщества (альфа-разнообразие) с помощью индекса Шеннона. Данный индекс тем выше, чем более равномерно представлены уникальные последовательности нуклеотидов в сообществе. Снижение индекса Шеннона ассоциировано с различными заболеваниями и может свидетельствовать как об уменьшении численности видов, так и о разрастании одного или нескольких видов бактерий в ущерб представленности других видов. Таким образом, альфа-разнообразие в целом и индекс Шеннона в частности могут использоваться в качестве суммарной характеристики состояния кишечной микрофлоры и описывать сложную структуру одним числом. Как правило, такая характеристика позволяет делать выводы на небольших выборках, что может быть затруднительно при анализе относительной представленности всех таксонов по отдельности ввиду недостаточной мощности.
Чтобы оценить вклад увеличения доли бактерий-оппортунистов в снижение альфа-разнообразия, была проанализирована представленность каждого бактериального условно-патогенного семейства: Enterobacteriaceae, Enterococcaceae, Veillonellaceae, Aeromonadaceae, Streptococcaceae, Moraxellaceae, Fusobacteriaceae. Для каждого семейства, чтобы проверить гипотезу о его более высокой медианной представленности у больных детей до лечения по сравнению со здоровыми детьми, был вычислен односторонний критерий Вилкоксона. Критерий Вилкоксона – один из методов статистической проверки гипотез. Он позволяет проверить гипотезу о том, совпадает ли медианное значение некоторой величины в двух группах. Медианное значение делит популяцию на две равные части: у одной половины людей значение ниже медианного, у другой половины – выше. В статье этот критерий используется для сравнения представленности отдельных условно-патогенных семейств у здоровых и больных детей. Критерий Вилкоксона на основании имеющейся выборки позволяет оценить вероятность (р-значение) случайности наблюдаемых различий между группами. Если p > 5%, различий между группами нет, если p < 5%, различия есть. Критерий Вилкоксона часто используют вместо теста Стьюдента для величин, не соответствующих нормальному распределению. Относительная представленность бактерий в микробиоте – такая величина. Поправка на множественное сравнение при этом не применялась.
Результаты
Согласно результатам молекулярно-генетических (ПЦР) и бактериологических исследований, наиболее частой причиной ОКИ была Salmonella spp. (моноинфекция выявлена у 33,3% пациентов подгруппы Н и 44,4% – подгруппы Ц, в комбинациях с вирусами – у 25 и 22,2% пациентов соответственно). Shigella обнаружена у 16,7 и 22,2% больных подгрупп Н и Ц соответственно. Из общего числа всех включенных пациентов у шести (по три человека в каждой из сравниваемых подгрупп) идентифицировать возбудителя не удалось.
Проводимая терапия продемонстрировала эффективность в 100% случаев в обеих подгруппах, что подтверждено бактериологическим исследованием кала по окончании терапии.
Известно, что синдром острого колита при ряде бактериальных и паразитарных ОКИ сочетает в себе своеобразные проявления болевого и диарейного синдромов. Синдром колита наблюдается при инвазивных вариантах эшерихиозов, шигеллезах, может развиваться при сальмонеллезе, кампилобактериозе, протеозе, стафилококковой инфекции, то есть когда возбудителям присущи выраженные инвазивные и цитотоксические свойства [8]. В клинической картине заболевания симптомы колита преобладали в обеих подгруппах: наличие крови и слизи в стуле (41,6 и 100% в подгруппе Н и 33,3 и 100% в подгруппе Ц соответственно). Скорость купирования основных симптомов ОКИ – лихорадки, болей в животе, рвоты, диареи, интоксикации, эксикоза была в среднем в два раза выше в подгруппе Н.
Длительность стационарного лечения, детектирующая быстроту купирования основной симптоматики и восстановление картины микробиоценоза кишечника, свидетельствует о более высокой скорости выздоровления в группе Н: 4,7 ± 2,1 суток в подгруппе Н и 6,7 ± 1,5 суток в подгруппе Ц (табл. 2). Зафиксирована хорошая переносимость обоих препаратов. Нежелательных явлений и побочных реакций при использовании Энтерофурила и цефалоспоринов не зарегистрировано.
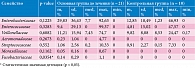
Альфа-разнообразие микробиоты участников с ОКИ (основная группа) до начала лечения было статистически значимо ниже по сравнению со здоровыми детьми контрольной группы (p = 0,0036). Такое снижение на фоне кишечной инфекции может быть связано как с увеличением представленности отдельных бактериальных таксонов, так и с уменьшением уровня некоторых таксонов вследствие диареи, воспалительных процессов и изменения питания. Представленность Fusobacteriaceae была значимо выше у детей с ОКИ (р = 0,0354). Данный род не выявлен ни у одного здорового ребенка, но наблюдался у шести пациентов основной группы: у пяти детей подгруппы Н и одного ребенка подгруппы Ц до лечения. Представленность других семейств между основной и контрольной группами статистически значимо не различалась. Однако рассмотрение наиболее представленных бактериальных семейств в каждом образце показало наличие спорадически высокой представленности отдельных редких оппортунистических семейств (табл. 3). Это говорит о разнообразном характере нарушений баланса микробиоты кишечника, потенциально ассоциированного с ОКИ у детей. Вследствие этого, а также малого размера выборок статистический анализ на уровне отдельных таксонов имеет пониженную чувствительность к выявлению дисбиотических изменений микробиоты. Исходя из этой особенности, с целью повышения чувствительности сравнения проанализирована суммарная доля уровней относительной представленности перечисленных семейств. Семейства были суммированы внутри каждого образца, и для каждого образца проанализировано отношение суммарной доли оппортунистических семейств к доле остальных – комменсальных (за исключением нескольких таксонов, отнесенных к техногенным контаминантам). Суммарная доля условных патогенов была статистически значимо выше у больных детей с ОКИ до начала лечения по сравнению со здоровыми детьми (р = 0,0488).
Отношение доли условно-патогенных семейств к доле комменсальных микроорганизмов составило соответственно 36,8 ± 1,38 у детей с ОКИ, 0,96 ± 0,84 у здоровых детей, односторонний критерий Вилкоксона, p = 0,0361 (рисунок). Суммарная доля бактерий-оппортунистов у детей с ОКИ снизилась в ходе лечения до значений, характерных для здоровых детей (p = 0,0273).
У пациентов подгруппы Н индекс Шеннона был значимо ниже показателей пациентов контрольной группы (p = 0,0044). На фоне приема нифуроксазида его значение возросло (p = 0,0024) и перестало статистически значимо отличаться от альфа-разнообразия участников контрольной группы (p = 0,1593) по окончании терапии. В подгруппе Н через месяц после выписки из стационара индекс Шеннона значимо не изменился (p = 0,9453) и не отличался от значений показателя в группе здоровых детей (p = 0,2370). В основной группе до начала лечения, а именно в подгруппе Н, наблюдалось повышение доли семейства Fusobacteriaceae относительно представленности микроорганизма в микробиоте пациентов контрольной группы (p = 0,0139, критерий Манна – Уитни). Сразу после окончания лечения, а также спустя месяц значимых отличий в представленности микроорганизма между основной и контрольной группами не наблюдалось (p > 0,05). Снижение доли этого семейства в образцах пациентов подгруппы Н за время лечения было близким к статистически значимому (p = 0,0528, парный критерий Вилкоксона) при сравнении образцов, взятых до и сразу после окончания терапии.
Отличий в представленности других семейств условно-патогенных бактерий у детей подгруппы Н и здоровых детей не зафиксировано. В подгруппе Н также не выявлено изменений доли этих микроорганизмов во времени. Суммарная доля условных патогенов по отношению к здоровой микрофлоре в каждом образце в подгруппе Н не отличалась значимо от показателей здоровых пациентов ни до, ни после терапии. Тем не менее различия, наблюдаемые до начала терапии, были близки к порогу значимости (p = 0,0797). Анализ динамики показателя суммарной доли бактерий-оппортунистов внутри самой подгруппы Н не выявил статистически значимого уменьшения с течением времени (p > 0,05, рисунок).
Альфа-разнообразие микробиоты кишечника детей подгруппы Ц до начала лечения было снижено по сравнению с показателем здоровых детей (p = 0,0014) (рисунок). В отличие от подгруппы Н разнообразие микробиоты у пациентов подгруппы Ц не восстановилось за время лечения: статистически значимых изменений после лечения не установлено (p = 0,25), значимое снижение по сравнению с контрольной группой сохранилось (p = 0,0117). Пациенты подгрупп Н и Ц, получавшие разное лечение, отличались друг от друга уже в начальной точке, что обусловлено небольшим размером выборки. В подгруппе Ц повышения доли семейства Fusobacteriaceae не наблюдалось. При рандомизации почти все дети (пять из шести) с повышенной долей этого семейства попали в подгруппу Н. В начальной точке, в отличие от подгруппы Н, в подгруппе Ц ни для одного из условных патогенов его доля не была выше в подгруппе Ц по сравнению со здоровыми лицами (p > 0,05, рисунок). Вероятно, это обусловлено небольшим количеством участников исследования. При проверке гипотезы о снижении представленности таксонов во времени при приеме цефалоспоринов было выявлено значимое уменьшение семейства Enterobacteriaceae (р = 0,0488). Однако отличий от контрольной группы не было в представленности ни одного из изученных семейств ни в одной временной точке. Это может свидетельствовать о небольшом размере эффекта снижения доли этого семейства.
Обсуждение
В данной работе представлены результаты исследования взаимосвязи разнообразия и состава кишечного микробиома у детей при ОКИ инвазивного типа. Исследование состава микробиоты методами 16S рРНК-секвенирования открывает новые возможности для изучения процессов, протекающих в кишечнике при ОКИ и в организме в целом, поскольку изменения в одном эпитопе провоцируют нарушения микробиома в целом. Проанализированы изменения, происходящие на фоне лечения ОКИ нифуроксазидом и цефалоспоринами. Уникальность выборки состоит в том, что пациенты не принимали антибиотиков в течение трех месяцев до интервенции, а в ходе лечения были госпитализированы. Это позволяет исключить искажение результатов за счет лечения в домашних условиях и оценить вклад в изменение конкретной терапии, а также различия в питании.
Уже в раннем периоде острой инвазивной кишечной инфекции у детей зарегистрировано снижение альфа-разнообразия – интегральной характеристики микробного сообщества, оценивающей количество видов в нем и равномерность их относительной представленности. Отмечалось также повышение суммарной доли бактерий-оппортунистов в основной группе по сравнению с контрольной. Наиболее выраженным было повышение представителей семейства Fusobacteriacaе. Согласно данным литературы, некоторые представители данного семейства ассоциированы с воспалительными заболеваниями желудочно-кишечного тракта [18–20]. После лечения альфа-разнообразие восстановилось только в подгруппе Н. Различия в динамике условно-патогенной микрофлоры в интервенционных группах обусловлено изначальным различием микробиома между группами, связанным с их небольшой численностью. В подгруппе Н доля семейства Fusobacteriacae до начала лечения была выше, чем в контрольной группе. Сразу после лечения и через месяц после его окончания данный показатель не отличался от такового здоровых детей. Подгруппа Ц до начала лечения отличалась от контрольной только большей долей бактерий-оппортунистов. К концу лечения этот показатель восстановился до значений, характерных для здоровых детей. В последующих исследованиях микробиоценоза на большей выборке необходимо оценить значимость семейства условно-патогенных бактерий Fusobacteriacae при ОКИ в детском возрасте и влияние бактерий этого семейства на тяжесть течения заболевания.
Таким образом, прием каждого из препаратов сопровождается уменьшением доли условно-патогенной микрофлоры. Однако разнообразие микробиоты восстановилось только на фоне приема нифуроксазида и оставалось сниженным по окончании терапии в подгруппе Ц. Можно предположить, что лучшие результаты в подгруппе детей, которые получали нифуроксазид, объясняются его биоценозосберегающей эффективностью – минимальным негативным влиянием на нормальную микрофлору кишечника и в то же время способностью воздействовать не только на патогенную, но и на условно-патогенную микрофлору.
Данные выводы требуют уточнения на более широкой выборке, обеспечивающей более сбалансированные по начальному составу микробиоты интервенционные группы, а также большую статистическую мощность сравнения. Кроме того, для выбора тактики лечения ОКИ важно сравнить в перспективе динамику микробиоты на фоне терапии при ОКИ, вызванных сочетанной вирусной и бактериальной этиологией с монобактериальными ОКИ. Вместе с тем именно благодаря новейшим методам исследования с использованием высокопроизводительного секвенирования гена 16S рРНК открываются новые перспективы по выявлению преимуществ и недостатков антибактериальных препаратов и антибиотиков, что особенно важно для педиатрической практики.
Заключение
Изучение изменений микробиоценоза кишечника в остром периоде инвазивных ОКИ у детей с использованием современного метода секвенирования гена 16S рРНК бактерий позволило глубже изучить исходное состояние микробиоты кишечника и его динамику на фоне применения антибактериальных средств. В остром периоде ОКИ выявлено снижение альфа-разнообразия – количество видов в нем и равномерность их относительной представленности, а также повышение суммарной доли бактерий-оппортунистов в группе кишечных инфекций по сравнению со здоровыми детьми с ее восстановлением в обеих подгруппах в ходе лечения до значений здоровых детей.
Применение нифуроксазида при ОКИ инвазивного типа у детей по сравнению с антибактериальными препаратами сопровождается более выраженной положительной динамикой клинической симптоматики ОКИ, более высокой скоростью наступления выздоровления. В исследовании зафиксировано восстановление важного интегрального показателя состава микробиоты – альфа-разнообразия, а также сокращение доли представителей условно-патогенных семейств (в частности, Fusobacteriaceae). В подгруппе Ц общая доля условных патогенов также снизилась, но восстановления альфа-разнообразия не наблюдалось.
D.V. Usenko, PhD, A.V. Gorelov, PhD, Prof., RASci Corr. Меm., V.Ye. Odintsova, D.A. Kashtanova, PhD, S.I. Koshechkin, PhD, A.V. Tyakht, PhD, V.S. Krikun
Central Research Institute of Epidemiology of Rospotrebnadzor
Atlas Biomed Group, LLC ‘Knomiks’
Atlas Biomed Group, LLC ‘Atlas’
FSBI ‘Center for Strategic Planning and Management of Biomedical Health Risks’ of the FMBA of Russia
Center for High-Precision Genomic Editing and Genetic Technologies for Biomedicine, Institute of Gene Biology of the RAS
Contact person: Denis V. Usenko, d.usenko@rambler.ru
Among the factors that significantly affect the composition and functional activity of the microbiome of the gastrointestinal tract of children, acute intestinal infections (AIIs) occupy a key place, which is determined by the high frequency of diseases, functional deficiency of bacteriocins and factors of mucosal immunity. An additional negative effect can be provided by antibacterial therapy, often used for bacterial intestinal infections, or empirical therapy, prescribed for the invasive type of acute diarrhea. Violation of the balance of microbiocenosis at this stage of child development can have long-term consequences. The aim of this study was to assess the composition of the intestinal microbiota in the acute period of infectious diarrhea in children and the effect of subsequent therapy with nifuroxazide and cephalosporin drugs on it. The study involved 31 children, including 21 patients with acute intestinal infection of the invasive type (the main group) and 10 clinically healthy children (the control group). Patients of the main group were randomized into two subgroups: 12 patients of subgroup H received nifuroxazide, 9 patients of subgroup C received cephalosporins. For all participants, the microbial composition of excreta samples was studied using high-performance sequencing of the 16S rRNA gene. Data analysis was carried out on the basis of ‘Knomiks-Biota’ and in the programming environment R. In the acute period of AIIs the decrease in the number of types of microorganisms of the gastrointestinal tract and the uniformity of their relative representation (alpha diversity), as well as an increase in the total proportion of opportunistic bacteria compared to healthy children, were revealed.
The use of nifuroxazide in children with an invasive type of AIIs in comparison with the group treated with antibacterial drugs was accompanied by the more pronounced positive dynamics of the clinical symptoms of AIIs, the higher rate of recovery. There was the restoration of alpha diversity, as well as the reduction in the proportion of representatives of opportunistic families (in particular, Fusobacteriaceae). In the comparison group, whose patients received cephalosporins, the total proportion of conditional pathogens also decreased, but the restoration of alpha diversity was not observed, which indicated the persistence of dysbiotic disorders.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.