Синдром беспокойных ног и роль прамипексола в его коррекции
- Аннотация
- Статья
- Ссылки
На сегодняшний день синдром беспокойных ног (СБН) – это хроническое состояние, характеризующееся двигательным беспокойством и дискомфортными ощущениями в ногах, которые возникают в покое и приводят к физическому недомоганию и нарушению сна. Идиопатическим, или первичным, СБН страдают около 5% населения, причем чаще синдром регистрируется в пожилом возрасте (10–15%). Кроме того, СБН может развиваться вторично, на фоне дефицита железа, терминальных стадий почечной недостаточности, беременности, ревматологических заболеваний, диабета, полиневропатий, болезни Паркинсона, рассеянного склероза, повреждений спинного мозга. Несмотря на такое широкое распространение, диагностика и лечение СБН до сих пор вызывают затруднения, что прежде всего связано с недостаточной информированностью врачей относительно данного состояния. Между тем у 20% пациентов заболевание протекает достаточно тяжело и вызывает серьезную дезадаптацию, что при отсутствии правильной диагностики и эффективного лечения может привести к суициду.
В начальной стадии заболевания клинические проявления СБН могут носить интермиттирующий характер, лишь иногда доставляя больному неудобства, однако по мере прогрессирования болезни они становятся постоянными. В большинстве случаев пациент начинает рассказывать о дискомфорте, возникающем в неподвижном состоянии через несколько минут – час после того, как пациент лег или сел. Чем дольше продолжается покой, тем больше вероятность возникновения симптомов и тем более интенсивными они становятся. Симптоматика может быть как одно-, так и двухсторонней. Пациенты описывают дискомфортное состояние как «скребущее, ползущее, зудящее, жгущее, тянущее, ноющее, холодящее, причиняющее беспокойство или боль ощущение», локализующееся где-то глубоко в мышцах или костях, реже в суставах ног. Более чем у половины пациентов задействуются также и руки, однако изолированное вовлечение рук исключается. Ощущение нарастает, и появляется острая потребность двигать ногами, реже руками или всем телом. Как только начинается двигательная активность, симптоматика исчезает, что позволяет дифференцировать СБН с другими заболеваниями. В типичных случаях нелеченые пациенты испытывают максимальный дискомфорт между 0–4 часами ночи и наибольшее облегчение между 6–12 часами дня. В ночное время ухудшение проявляется вне зависимости от того, спит пациент или нет. Большинство больных отмечают период значительного облегчения днем, когда симптоматика СБН выражена минимально или отсутствует. Однако в тяжелых случаях пациенты могут испытывать неприятные симптомы постоянно и только при опросе вспоминают, что отмечали циркадные изменения на более ранних стадиях заболевания. Пациенты, у которых симптомы возникают после продолжительного периода покоя, например во время путешествия, могут не ощущать циркадных изменений. Циркадный ритм может меняться под действием лекарственных препаратов, во время переездов, на фоне плохого и нерегулярного сна. Наиболее характерные признаки СБР легли в основу эссенциальных критериев диагноза СБН, опубликованных в 2003 г. R. Allen и соавт. [1]. К ним относят:
- стремление совершать движения ногами, обычно вызванное или сопровождающееся неприятными ощущениями в ногах (иногда стремление двигать ногами может присутствовать без неприятного ощущения, могут вовлекаться также руки и туловище);
- начало или усиление проявлений в период покоя (например, при лежании или сидении);
- частичное или полное исчезновение симптоматики при движении;
- возникновение или усиление проявлений вечером или ночью (если симптоматика очень выражена, ночное ухудшение может быть малозаметно, но оно обязательно присутствует).
Существует также ряд вспомогательных диагностических критериев, которые не обязательны, но характерны для заболевания. Во-первых, замечено, что семейный анамнез выявляется более чем у 50% больных с идиопатическим СБН. Показано, что возможен аутосомно-доминантный тип передачи с почти полной пенетрантностью, но вариабельной экспрессивностью патологического гена. Предполагают как полигенную, так и моногенную природу болезни. Скорее всего, заболевание является результатом сложного взаимодействия генетических и внешних факторов [29]. Во-вторых, более чем 90% больных СБН отвечают положительно на дофаминергическую терапию (леводопа или агонисты дофаминовых рецепторов), причем эффективная доза этих препаратов гораздо ниже, чем при болезни Паркинсона. Кроме того, приблизительно у 80% больных с СБН выявляются периодические движения конечностями (во время отдыха или сна) продолжительностью от 0,5 до 5 секунд, которые повторяются сериями с интервалом в 20–40 секунд. Характерный рисунок движения – тыльное сгибание большого пальца, иногда с веерообразным разведением остальных и сгибанием стопы, возможно сгибание в коленных и тазобедренных суставах, иногда сгибание рук. Периодические движения конечностями неспецифичны для СБН и могут встречаться при других заболеваниях, а также в норме, особенно у пожилых людей. В типичных случаях диагностика синдрома не составляет труда. Однако симптоматика может оказаться неоднозначной, как, например, при коморбидных состояниях, двигательных расстройствах или нарушениях сна другой этиологии, что затрудняет постановку диагноза. Для выявления симптоматической природы заболевания проводится клинический осмотр, при необходимости – лабораторное и нейрофизиологическое обследования. Положительный эффект дофаминергической терапии подтверждает диагноз СБН. При затруднениях в диагностике может помочь исследование ночного сна (полисомнография). Типичные признаки СБН:
1. Клиническое течение. СБН может начаться в любом возрасте, раннее начало свидетельствует о первичном, а позднее – о вторичном характере заболевания. Для первичного СБН характерно флюктуирующее, для вторичного СБН – хроническое прогрессирующее течение. Возможны ремиссии, в редких случаях – спонтанное выздоровление. Вторичный СБН может исчезнуть при успешном лечении основного заболевания. СБН с ранним началом обычно развивается медленно, в течение многих лет, а поздно возникший СБН прогрессирует быстрее.
2. Нарушения сна. Более чем 90% пациентов жалуются на трудности засыпания или тревожный сон с постоянными пробуждениями. Проблема со сном часто бывает первой причиной обращения пациента к врачу. При исследовании сна выявляются увеличение времени засыпания и периодические движения конечностями, снижение общего времени сна, его эффективности и медленной фазы сна. Эффективность сна часто уменьшается более чем на 50%. Пациенты со средним и тяжелым течением СБН часто спят менее 5 часов за ночь.
3. Медицинский осмотр. Неврологическое исследование при первичном СБН не выявляет патологии, при вторичном СБН можно обнаружить признаки радикуло- или нейропатии.
Патогенез заболевания до конца не изучен, предполагается наличие трех основных взаимодействующих между собой компонентов: дофаминергической дисфункции, нарушений обмена железа и генетической предрасположенности. На дефект дофаминергической системы указывают ухудшение СБН на фоне приема нейролептиков и эффективность терапии дофаминергическими средствами. Есть данные, свидетельствующие о дисфункции дофаминергических путей на уровне диэнцефалоспинального тракта (от гипоталамических ядер к серому веществу спинного мозга). Предполагается, что эти пути осуществляют модулирующее влияние на сенсомоторные спинальные круги. Вероятно, задействованы также нейроны, расположенные в каудальном отделе таламуса и перивентрикулярном сером веществе среднего мозга [17]. Учитывая положительное влияние опиоидов на проявления СБН, рассматриваются также роль дисфункции эндогенной опиоидергической системы и ее взаимодействие с дофаминергической. Недавно проведенное исследование применения ПЭТ с неспецифическими опиоидными лигандами показало отрицательную корреляцию между тяжестью СБН и связыванием лиганда в таламусе, миндалевидном теле и передней поясной извилине – структурах, задействованных в центральных болевых механизмах. Изменения в метаболизме железа, вероятно, влияют на дофаминовую медиацию, поскольку железо выступает в качестве кофактора для тирозингидроксилазы. Кроме того, дофаминергическая трансмиссия может нарушаться под действием генетических факторов, которые к тому же могут воздействовать и на другие структуры ЦНС, способные спровоцировать появление СБН. Таким образом, аномальная гипервозбудимость спинальных кругов может быть обусловлена не только дисбалансом нисходящих дофаминергических влияний, но и поражением на уровне спинного мозга, его корешков и периферической нервной системы.
Терапия СБН носит симптоматический характер. Необходимо подчеркнуть, что лечение рекомендуется назначать лишь в том случае, если симптомы заболевания причиняют дискомфорт и приводят к дезадаптации пациента. Начать рекомендуется с соблюдения режима: выполнять умеренные физические нагрузки, не переутомляться в течение дня, гулять, хорошо проветривать помещение перед сном, принимать душ или ванну для ног вечером, исключать переедание и употребление на ночь чая/кофе/алкоголя. Необходимо также отменить медикаменты, способные спровоцировать развитие СБН, и принимать препараты для восполнения дефицита йода и железа. В момент приступа рекомендуется встать и походить, выполнить релаксирующие упражнения, растереть ноги. Считается, что у 20–25% пациентов с СБН в связи с выраженностью симптомов требуется назначение фармакологической терапии. Для фармакологического лечения используются следующие группы препаратов [22]:
- дофаминергические препараты (агонисты дофаминовых рецепторов или препараты леводопы);
- бензодиазепины (клоназепам);
- антиконвульсанты (габапентин, карбамазепин);
- опиоиды (оксикодон, кодеин, трамадол).
Дофаминергические препараты (препараты леводопы и агонисты дофаминовых рецепторов) – средства первого выбора лечения СБН. Остальные три группы используются в случае непереносимости дофаминергической терапии или при истощении эффекта. Во многих случаях политерапия несколькими лекарственными средствами с разными механизмами действия оказывается эффективнее монотерапии. Дофаминергические препараты влияют на все основные проявления СБН, не приводят к нарушению когнитивных функций, не вызывают сонливости, привыкания и зависимости, как бензодиазепины и опиоиды. Препараты эффективны в небольших дозах и хорошо переносятся, что делает возможным их длительное применение.
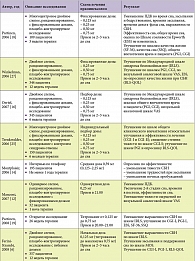
При выборе между леводопосодержащими препаратами и агонистами дофаминовых рецепторов (АДР) предпочтение отдается последним, поскольку применение леводопы у 80% пациентов вызывает феномен аугментации, или «отдачи» [20]. Аугментация – это усиление симптомов или появление их в более раннее время вечером или более позднее утром по сравнению с обычным временем начала (до лечения), ощущения могут распространяться на ранее не задействованные части тела; длительность терапевтического эффекта при этом снижается. Феномен становится особенно заметен, когда доза леводопы доходит до 200 мг в день. При возникновении данного явления рекомендуется снизить дозу леводопы и добавить или полностью перейти на АДР. При применении АДР риск возникновения аугментации гораздо ниже, чем при терапии леводопой, препараты данной группы неплохо переносятся больными, имеют хорошую эффективность в относительно низких дозах и обеспечивают устойчивый эффект [2]. Таким образом, препаратами выбора при СБН являются агонисты дофаминовых рецепторов. Среди препаратов, доступных на российском рынке, наибольший опыт применения накоплен в отношении прамипексола (Мирапекс). Прамипексол – неэрголиновый агонист D2 и D3 дофаминовых рецепторов, на сегодняшний день официально рекомендованный для терапии СБН. Было проведено более десятка исследований (табл. 1), в том числе 4 плацебо-контролируемых [16, 21, 15, 8, 18, 27] испытания, которые продемонстрировали безопасность и эффективность препарата в лечении пациентов с СБН [3, 4, 24, 13, 23]. Достоверно установлено положительное влияние прамипексола на моторные и сенсорные симптомы заболевания [10]. Механизм действия прамипексола при СБН, предположительно, основывается на взаимодействии с D3-рецепторами дорзального и интермедиолатерального ядер серого вещества спинного мозга. Это предположение основано на гипотезе возникновения СБН в результате дисфункции нисходящих ингибирующих дофаминергических путей из гипоталамуса к D3-рецепторам дорзального и интермедиолатерального ядер серого вещества спинного мозга. Данный механизм действия препарата подтверждается в ряде исследований, где прамипексол быстро и эффективно уменьшает периодические движения конечностями (ПДК) при СБН и при этом оказывает очень ограниченное действие на центральные механизмы сна и его архитектонику.
Рассмотрим влияние препарата Мирапекс на основные проявления заболевания: снижение качества сна, периодические движения конечностями во сне и неприятные ощущения в конечностях в покое. Воздействие прамипексола на качество сна пациентов оценивалось с помощью субъективных (шкалы, опросники) и объективных методов. В нескольких работах использовались полисомнографические методики [6, 21, 12]. Было показано, что терапия прамипексолом прежде всего уменьшает выраженность такого феномена, как периодические движения конечностями во сне. Этот симптом, как уже говорилось, чрезвычайно часто сопровождает СБН, усугубляя его влияние на качество сна. Надо отметить, ПДК – наиболее объективный показатель при оценке СБН, поскольку его легко оценить с помощью электрофизиологической методики. В исследованиях Mauro Manconi и соавт. [11] с помощью полисомнографии были наглядно продемонстрированы эффективность небольших доз прамипексола (0,25 мг) уже в первую ночь после его применения и прогрессирующее снижение индекса ПДК в течение ночи, чего не наблюдалось при приеме плацебо. Интересно, что при изолированном синдроме ПДК без СБН снижения индекса не наблюдалось. Учитывая полученные данные, авторы предложили использовать этот эффект в качестве фармакологического теста при диагностически сложных случаях СБН.
Исследование влияния на архитектонику сна без учета показателей ПДК дало менее яркие результаты. В исследовании Partinen и соавт. [18] было получено снижение времени дельта-фазы сна, а в исследовании Ferri и соавт. [7] зафиксировано увеличение продолжительности 2-й фазы сна. Jama с коллегами [9] показал, что прамипексол эффективно воздействует на ПДК и уменьшает время засыпания после 3 недель применения, но другие параметры сна, в частности, его структура, по мнению авторов, изменяются мало. Даже при успешном купировании СБН с ПДК проблемы со сном могут оставаться [15]. Тем не менее с помощью объективных методик в большинстве исследований было достоверно показано, что применение прамипексола уменьшает время засыпания, улучшает эффективность и качество сна. Другой важный показатель – выраженность неприятных ощущений при засыпании – достоверно уменьшался на фоне приема прамипексола [16, 27, 6]. Так, на фоне терапии прамипексолом наблюдалось значимое снижение балла по визуальной аналоговой шкале (VAS) в несколько раз (от 6,8 до 1,3), чего не наблюдалось при приеме плацебо (от 7,0 до 5,8) [9].
Таким образом, прамипексол способен быстро, практически в первую же ночь, купировать основные проявления СБН – ощущение дискомфорта в конечностях и периодические движения в конечностях во время сна, что приводит к улучшению качества сна и жизни пациента. Необходимо упомянуть, что прамипексол не теряет своей эффективности при длительном применении, терапия препаратом в течение 26 недель [19] и даже года [14] обеспечивает положительный эффект на фоне приема небольших доз (0,125–2,25 мг) [14]. К сожалению, при отмене препарата через некоторое время (по данным Trenkwalder с соавт. [25], примерно через 6 месяцев) состояние пациентов начинает значительно ухудшаться. Поэтому пациентам с СБН показана постоянная терапия прамипексолом в небольших, индивидуально подобранных дозировках. Обычно препарат хорошо переносится и не вызывает серьезных побочных эффектов. Тем не менее, как показал опыт, примерно у 20% пациентов требуется отмена терапии, что связано чаще всего с появлением желудочно-кишечных побочных явлений (тошноты, неприятных ощущений в желудке, диареи), реже головной боли или ортостатической гипотензии. Перечисленные нежелательные явления появляются в начале терапии при титрации препарата, затем их выраженность постепенно ослабевает.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.