Сложности диагностики солидной псевдопапиллярной неоплазии поджелудочной железы
- Аннотация
- Статья
- Ссылки
- English
В статье описан накопленный опыт диагностики СППО и приведен клинический случай, в результате которого у пациентки была успешно выявлена солидная псевдопапиллярная опухоль. Так как дифференциальную диагностику пациентке проводили по поводу микрокистозной серозной цистаденомы, точный диагноз имел важное значение для определения дальнейшей тактики ведения. Представленный клинический случай, а также анализ литературных данных и собственных наблюдений позволяют продемонстрировать возможности применения контрастного усиления, тонкоигольной пункции и конфокальной лазерной эндомикроскопии под контролем эндоскопической ультрасонографии в дифференциальной диагностике СППО поджелудочной железы.
В статье описан накопленный опыт диагностики СППО и приведен клинический случай, в результате которого у пациентки была успешно выявлена солидная псевдопапиллярная опухоль. Так как дифференциальную диагностику пациентке проводили по поводу микрокистозной серозной цистаденомы, точный диагноз имел важное значение для определения дальнейшей тактики ведения. Представленный клинический случай, а также анализ литературных данных и собственных наблюдений позволяют продемонстрировать возможности применения контрастного усиления, тонкоигольной пункции и конфокальной лазерной эндомикроскопии под контролем эндоскопической ультрасонографии в дифференциальной диагностике СППО поджелудочной железы.


Солидная псевдопапиллярная опухоль (СППО) (опухоль Gruber – Frantz) является редкой эпителиальной опухолью поджелудочной железы (ПЖ) с неизвестным этиопатогенезом, составляет около 0,17–2,7% всех опухолей поджелудочной железы (1–6% от всех экзокринных опухолей ПЖ), чаще встречается у молодых женщин (Ж : М = 10 : 1) в возрасте 15–45 лет [1, 2]. Опухоль представлена мономорфными клетками, формирующими солидные и псевдопапиллярные структуры с частой кистозной дегенерацией. В 90–100% наблюдений СППО обнаружена мутация гена β-катенина, в результате которой в опухолевых клетках выявляется цитоплазматическая и ядерная экспрессия этого протеина [3, 4].
Поскольку солидные псевдопапиллярные опухоли либо представляют собой злокачественные опухоли, либо имеют высокий потенциал злокачественности, хирургическая резекция является предпочтительным методом лечения. В отличие от аденокарциномы поджелудочной железы, пятилетняя выживаемость пациентов после оперативного лечения составляет более 98% [5, 6]. Вопрос своевременной точной диагностики СППО остается актуальным на сегодняшний день.
Клинические проявления СППО ПЖ неспецифичны и связаны в основном с размером опухоли [7]. Систематический обзор 484 исследований, в которых у 2744 пациентов были выявлены СППО, показал, что в 63% случаев клиническим проявлением является боль в животе, в 38% случаев клинические симптомы отсутствуют [8].
При проведении различных лучевых методов исследования опухоль, как правило, выглядит как четко отграниченное новообразование с фиброзной капсулой, различным числом кистозных полостей, образовавшихся в результате кровоизлияний, а также зонами некроза и кальцификациями (1/3 случаев) [1, 9–11]. С.С. Yu и соавт. на основании полученных с помощью магнитно-резонансной томографии (МРТ) изображений 26 пациентов с СППО выделили три основных их типа [12]: первый тип представлен полностью солидным новообразованием, второй – характеризуется сочетанием солидных участков с кровоизлияниями, при третьем типе новообразование представлено преимущественно кистозной полостью. На сегодняшний день характерная локализация опухоли в отделах поджелудочной железы не определена.
Российские исследователи пришли к заключению, что выявление у женщин молодого возраста (до 40 лет) гипоэхогенного (при ультразвуковом исследовании (УЗИ)) гиподенсного в артериальную фазу контрастного усиления (при мультиспиральной компьютерной томографии (МСКТ)) новообразования неоднородной структуры с кальцинатами и жидкостным компонентом без панкреатической гипертензии с вероятностью 82,3% может свидетельствовать о наличии СППО [13].
На основании анализа современных данных литературы, в табл. 1 обобщены типичные характеристики СППО [14–24].
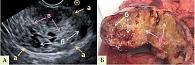
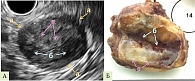
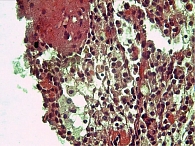
Широкий диапазон критериев лучевой диагностики обусловлен многообразием макроскопической картины СППО (рис. 1–3).
Дифференциальная диагностика СППО проводится с другими солидными, кистозно-солидными или кистозными новообразованиями, такими как протоковая аденокарцинома поджелудочной железы, цистаденокарцинома, нейроэндокринные опухоли, муцинозная цистаденома, серозная микрокистозная цистаденома, псевдокисты и очаговый псевдотуморозный панкреатит. Именно поэтому возможность безопасной морфологической верификации имеет принципиальное значение. Наиболее безопасным путем получения цитологического и гистологического материала для установления диагноза является эндосонография с тонкоигольной пункцией.
В отделении диагностической эндоскопии Московского клинического научного центра (МКНЦ) им. А.С. Логинова солидная псевдопапиллярная опухоль на эндоскопической ультрасонографии выявлена за 10 лет (2014–2024 гг.) у 30 пациентов (у одного мужчины и у 29 женщин), средний возраст всех пациентов составил 38 ± 5,8 лет. Сонографически опухоли были представлены солидно-кистозными новообразованиями с четкой границей. Солидная часть была неоднородна по своей эхоструктуре, кистозные полости располагались в разных частях новообразования (одинаково, центрально и периферически).
Оценка контрастного усиления под контролем эндоУЗИ солидных псевдопапиллярных опухолей проведена нами в 10 случаях. Солидные структуры опухолей активно накапливали контрастное вещество в артериальную фазу (изоусиление (n = 8)/гиперусиление (n = 2)), накопление солидными структурами было неравномерным вследствие наличия участков некроза (n = 10). В венозную фазу сохранялись сигналы в участках, накапливающих контраст с последующим медленным вымыванием в позднюю фазу (через 2–3 минуты).
Тонкоигольная пункция под контролем эндоУЗИ солидных псевдопапиллярных опухолей проведена 15 пациентам, во всех случаях был получен материал для цитологического или гистологического исследований, в восьми случаях для подтверждения диагноза потребовалось дополнительное проведение иммуноцитохимии или иммуногистохимии.
Представленное клиническое наблюдение демонстрирует трудности дифференциальной диагностики данного заболевания поджелудочной железы.
Клинический случай
В МКНЦ им. А.С. Логинова была госпитализирована пациентка Ш., 36 лет, с жалобами на боль в животе опоясывающего характера.
Из анамнеза известно, что в марте 2016 г. при обследовании, по данным УЗИ органов брюшной полости, в области хвоста поджелудочной железы выявлено кистозное новообразование размерами 30 × 20 мм, главный панкреатический проток не расширен. Общий и биохимический анализы крови от марта 2016 г. – без отклонений от нормы.
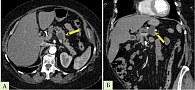
По данным МСКТ с внутривенным контрастированием от 05.04.2016: КТ-признаки микрокистозного новообразования хвоста поджелудочной железы (микрокистозная цистаденома/цистаденокарцинома или СППО) (рис. 4).
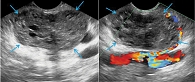
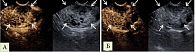
Результаты эндоскопической ультрасонографии: поджелудочная железа – эхогенность паренхимы повышена, структура неоднородная. В проекции хвоста поджелудочной железы определяется кистозно-солидное новообразование размером 40 × 25 мм с четкими ровными контурами (рис. 5). Новообразование неоднородной эхоструктуры с наличием микрокист и кист размерами до 3–4 мм. Новообразование прилежит к селезеночным сосудам. При цветовом доплеровском картировании в проекции опухоли определяются единичные сигналы. Главный панкреатический проток не расширен на всем протяжении, связи с новообразованием не выявлено. При проведении контрастного усиления (внутривенное введение препарата Sonovue) определяется неравномерное накопление контраста новообразованием (изоусиление) с последующим медленным вымыванием в венозную фазу, в проекции новообразования выявляются множественные мелкие кистозные структуры, не накапливающие контрастное вещество (рис. 6).
Проведена тонкоигольная аспирационная пункция новообразования иглой 19g для цитологического исследования.
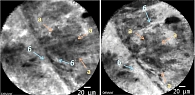
Дополнительно проведена конфокальная лазерная эндомикроскопия, при которой визуализировано скопление множественных мелких клеток вокруг сосудов и ориентированных оппозиционно к ним (рис. 7).
Так как дифференциальную диагностику проводили между микрокистозной серозной цистаденомой и солидной псевдопапиллярной опухолью, а конфокальное изображение не соответствовало серозной цистаденоме, то был выставлен предварительный диагноз: «солидная псевдопапиллярная опухоль». Заключение: Сонографические признаки соответствуют кистозно-солидному новообразованию хвоста поджелудочной железы (вероятнее всего, солидной псевдопапиллярной опухоли).
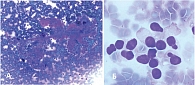
При цитологическом исследовании определяются ветвящиеся структуры из мономорфных овальных клеток с преимущественно центрально расположенными ядрами, сгруппированных вокруг фиброваскулярного стержня, миксоидная оксифильная строма – в виде глобул и тяжей; часть клеток с внутриядерными бороздами – по типу «кофейных зерен» (рис. 8). Заключение: Цитологическая картина соответствует солидной псевдопапиллярной опухоли, категория 7 (WHO Reporting System for Pancreaticobiliary Cytopathology, 2022).
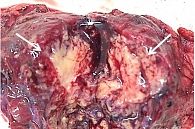
Пациентке была проведена лапароскопическая дистальная корпорокаудальная резекция поджелудочной железы. На рис. 9 представлен макропрепарат новообразования в разрезе.
При гистологическом исследовании опухоль построена из мелких мономорфных клеток, образующих солидные и псевдопапиллярные структуры (рис. 10). Клетки со слабоэозинофильной цитоплазмой, содержат округлое ядро с продольной бороздкой. Строма с кровоизлияниями и многочисленными эозинофильными гиалиновыми тельцами. При иммуногистохимии: позитивная реакция с β-катенином, PR; отрицательная реакция с синптофизином и хромогранином А. Заключение: СППО ПЖ.
В представленном клиническом примере данные конфокальной лазерной эндомикроскопии и анализ материала тонкоигольной пункции позволили исключить у пациентки наличие микрокистозной серозной цистаденомы и поставить диагноз солидной псевдопапиллярной опухоли, что изменило тактику ведения пациента.
Через 12 месяцев после оперативного вмешательства состояние пациентки было удовлетворительное, при повторной МСКТ органов брюшной полости признаков рецидива и метастазирования выявлено не было.
Заключение
Несмотря на значительные достижения в области лучевых методов исследования, такое редкое и сложное в диагностике новообразование поджелудочной железы, как СППО, сложно дифференцировать от других солидных/кистозно-солидных/кистозных новообразований, которые зачастую имеют схожие визуальные критерии, что затрудняет предоперационную диагностику.
Традиционно компьютерная томография и магнитно-резонансная томография считались ключевыми предварительными диагностическими инструментами визуализации для СППО. Однако на современном этапе все более весомое значение в диагностике этой редкой опухоли занимает эндоскопическое ультразвуковое исследование, при котором можно детально оценить структуру новообразования, накопление контраста в режиме реального времени и провести тонкоигольную аспирационную пункцию с получением материала для цитологического и гистологического исследований.
Собственный клинический опыт позволяет продемонстрировать возможности применения контрастного усиления, тонкоигольной пункции и конфокальной лазерной эндомикроскопии под контролем эндоскопической ультрасонографии в дифференциальной диагностике солидно-кистозных новообразований поджелудочной железы.
D.D. Kovalenko, E.V. Parfenchikova, PhD, V.V. Shchadrova, K.K. Noskova, PhD, L.Y. Rakhmetova, M.V. Orlova, O.A. Gusarova
A.S. Loginov Moscow Clinical Scientific Center
Contact person: Elena V. Parfenchikova, 3043062@mail.ru
Solid pseudopapillary tumor (SPPT) accounts for approximately 0.17–2.7% of all pancreatic tumors and is a rare and difficult to diagnose epithelial tumor with unknown etiopathogenesis. The clinical symptoms of the disease are nonspecific, and the wide range of criteria for radiological diagnostics is due to the diversity of the macroscopic picture, due to which SPPT is difficult to differentiate from other solid/cystic-solid/cystic neoplasms, which often have similar visual criteria.
The article describes the accumulated experience of diagnosing SPP and presents a clinical case, as a result of which a solid pseudopapillary tumor was successfully identified in a patient. Since differential diagnostics in the presented case was carried out with microcystic serous cystadenoma, an accurate diagnosis was important for determining further management tactics.
At the present stage, endoscopic ultrasound examination is becoming increasingly important in the diagnosis of this rare tumor. Our own clinical experience allows us to demonstrate the possibilities of using contrast enhancement, fine-needle puncture and confocal laser endomicroscopy under the control of endoscopic ultrasonography in the differential diagnosis of pancreatic pseudopapillary tumor.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.