Возможности неинвазивной оценки раннего фиброза поджелудочной железы с помощью методов лучевой и лабораторной диагностики
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – определить возможности неинвазивной оценки выраженности фиброза ПЖ с помощью постобработки результатов мультиспиральной компьютерной томографии (КТ) и измерения концентрации потенциальных биомаркеров фиброза.
Материал и методы. В исследовании приняли участие 165 пациентов в возрасте 57,91 ± 13,5 года, находившихся на хирургическом лечении с апреля 2022 по февраль 2024 г. по поводу хронического панкреатита и рака ПЖ. Всем больным проводили КТ с внутривенным контрастированием и измеряли концентрацию фибронектина, гиалуроновой кислоты, матриксных металлопротеиназ-1 и -9. При обработке результатов КТ измеряли нормализованные коэффициенты контрастирования ткани ПЖ в панкреатическую и венозную фазы, а также коэффициент соотношения контрастирования (КК). Патоморфологическую оценку фиброза проводили в тканях резецированной части ПЖ, не включающих новообразование или десмопластическую реакцию. Степень фиброза оценивали по шкале Kloppel и Maillet.
Результаты. Средние значения показателей постобработки результатов КТ и уровней биомаркеров сравнивали в группах, разделенных по степени фиброза. Средние значения КК оказались статистически значимо выше (p = 0,001) у пациентов с выраженной степенью фиброза ПЖ (1,16 ± 0,65 единиц Хаунсфилда (ед. Х)), чем у пациентов со слабой степенью фиброза ПЖ (0,78 ± 0,31 ед. Х). Обнаружен статистически значимо (p = 0,029) пониженный уровень фибронектина у пациентов с выраженной степенью фиброза ПЖ (74,9 ± 32,8 мкг/мл) по сравнению с группой пациентов со слабой степенью фиброза (110,7 ± 72,7 мкг/мл).
Заключение. При выраженной степени фиброза ПЖ концентрация фибронектина в сыворотке крови ниже, а значение коэффициента соотношения контрастирования выше, чем при легкой степени фиброза. Таким образом, обнаружена взаимосвязь между данными МСКТ и морфологическими признаками фиброза ПЖ, что может использоваться для неинвазивной диагностики фиброза ПЖ и выявления дополнительных признаков раннего хронического панкреатита.
Цель исследования – определить возможности неинвазивной оценки выраженности фиброза ПЖ с помощью постобработки результатов мультиспиральной компьютерной томографии (КТ) и измерения концентрации потенциальных биомаркеров фиброза.
Материал и методы. В исследовании приняли участие 165 пациентов в возрасте 57,91 ± 13,5 года, находившихся на хирургическом лечении с апреля 2022 по февраль 2024 г. по поводу хронического панкреатита и рака ПЖ. Всем больным проводили КТ с внутривенным контрастированием и измеряли концентрацию фибронектина, гиалуроновой кислоты, матриксных металлопротеиназ-1 и -9. При обработке результатов КТ измеряли нормализованные коэффициенты контрастирования ткани ПЖ в панкреатическую и венозную фазы, а также коэффициент соотношения контрастирования (КК). Патоморфологическую оценку фиброза проводили в тканях резецированной части ПЖ, не включающих новообразование или десмопластическую реакцию. Степень фиброза оценивали по шкале Kloppel и Maillet.
Результаты. Средние значения показателей постобработки результатов КТ и уровней биомаркеров сравнивали в группах, разделенных по степени фиброза. Средние значения КК оказались статистически значимо выше (p = 0,001) у пациентов с выраженной степенью фиброза ПЖ (1,16 ± 0,65 единиц Хаунсфилда (ед. Х)), чем у пациентов со слабой степенью фиброза ПЖ (0,78 ± 0,31 ед. Х). Обнаружен статистически значимо (p = 0,029) пониженный уровень фибронектина у пациентов с выраженной степенью фиброза ПЖ (74,9 ± 32,8 мкг/мл) по сравнению с группой пациентов со слабой степенью фиброза (110,7 ± 72,7 мкг/мл).
Заключение. При выраженной степени фиброза ПЖ концентрация фибронектина в сыворотке крови ниже, а значение коэффициента соотношения контрастирования выше, чем при легкой степени фиброза. Таким образом, обнаружена взаимосвязь между данными МСКТ и морфологическими признаками фиброза ПЖ, что может использоваться для неинвазивной диагностики фиброза ПЖ и выявления дополнительных признаков раннего хронического панкреатита.






Введение
Фиброз поджелудочной железы (ПЖ) является закономерным результатом естественного течения хронического панкреатита независимо от этиологии заболевания и характеризуется заменой железистых элементов жировой и фиброзной тканью, приводя к атрофии ПЖ [1]. Клинически фиброз проявляется развитием внешнесекреторной недостаточности ПЖ и сахарного диабета, что негативно сказывается на процессе пищеварения, углеводном обмене и, соответственно, ухудшает качество жизни пациентов.
Согласно современному международно признанному определению хронического панкреатита (ХП), патофизиологической основой этого заболевания является фиброзно-воспалительный синдром. При этом одним из ключевых аспектов развития ХП является фиброз ПЖ [2]. Прогрессирующий при ХП фиброз существенно нарушает функционирование ПЖ, вызывая деформацию протоков, кальцификацию и гипотрофию, что приводит к тяжелой хронической боли и снижению внешней и внутренней секреции ПЖ [3]. Внешнесекреторная недостаточность ПЖ развивается у 30–90% больных ХП, что приводит к нарушению нутритивного статуса, гиповитаминозам, остеопорозу и другим тяжелым осложнениям вплоть до кахексии, а также оказывает существенное негативное влияние на качество и продолжительность жизни таких пациентов [4, 5]. Сахарный диабет развивается у 83% пациентов более чем с 25-летним анамнезом ХП [6].
Диагностика ХП на поздних его стадиях, когда имеются явные признаки прогрессирующего процесса с грубыми морфологическими проявлениями, как правило, не вызывает особых затруднений, но для ранней диагностики и эффективного лечения ХП остается одним из самых сложных заболеваний [5, 7].
Для улучшения клинических результатов и предупреждения осложнений на поздних стадиях ХП необходимы его диагностика и лечение на ранней стадии [8]. Исходя из современных представлений, наряду с поздним ХП, отличающимся тяжелым необратимым течением, в последние годы выделяют ранний ХП, который отличает потенциальная обратимость патологических изменений ПЖ [5, 9, 10].
Ранний ХП диагностируется на основе сочетания факторов высокого риска развития ХП, низкого риска развития других заболеваний с признаками, схожими с ХП, соответствующего клинического контекста и результатов лабораторной диагностики [5, 8]. Основная проблема заключается в том, что данные лучевой диагностики, имеющие ведущее значение при других вариантах ХП, не коррелируют с выраженностью патологического процесса и активностью заболевания, а исключительно морфологическая диагностика невыполнима ввиду высокого риска потенциальных осложнений [11, 12].
Своевременная неинвазивная диагностика фиброзных изменений в ПЖ имеет существенное значение в связи со значительной ролью фиброза в прогрессировании ХП, в т.ч. раннего [13]. Для количественной оценки тяжести фиброза ПЖ может применяться магнитно-резонансная томография (МРТ), в частности сочетание Т1, Т2 и карты по измеряемому коэффициенту диффузии повышают диагностическую эффективность распознавания раннего ХП по сравнению со стандартной МРТ с МР-холангиопанкреатографией [14]. Важное значение в диагностике фиброза ПЖ и раннего ХП имеет эндоскопическое ультразвуковое сканирование, при котором описаны ряд признаков, частично отражающих морфологические изменения при этом состоянии [15, 16]. Однако широкому применению мультимодальной МРТ и эндоскопического ультразвукового исследования для диагностики фиброза ПЖ и ХП препятствует относительно высокая стоимость, меньшая доступность и в случае эндоскопического ультразвукового исследования инвазивность.
Мультиспиральная компьютерная томография (КТ) является более распространенным и достаточно эффективным методом диагностики заболеваний ПЖ. Чувствительность КТ для распознавания ХП составляет 75% (95%-ный доверительный интервал (95% ДИ): 66–83), специфичность – 91% (95% ДИ: 81–96) [17, 18]. Однако применение КТ в диагностике раннего ХП ограничено отсутствием достоверных визуально определяемых признаков фиброза ПЖ [19, 20]. Для устранения данной проблемы предложены способы постобработки результатов КТ. Первоначально эти подходы разрабатывались c целью прогнозирования развития панкреатической фистулы в раннем послеоперационном периоде у пациентов после операций на ПЖ, риск развития которой связан со степенью выраженности фиброза ПЖ [21]. В основу способа оценки связи развития панкреатической фистулы с фиброзом ПЖ легла математическая обработка результатов денситометрического анализа результатов КТ с внутривенным контрастированием [20, 22, 23].
Фиброз ПЖ представляет собой дисбаланс между продукцией и деградацией белков межклеточного вещества, которые могут использоваться как биомаркеры ранних этапов фиброза [24]. Наибольший интерес представляет изучение активности веществ, играющих определенную роль в развитии ХП [25–27].
Матриксные металлопротеиназы (ММП) участвуют в деградации белков межклеточного вещества, в частности матриксная металлопротеиназа-1 (ММП-1) – наиболее активная в отношении коллагенов I, II и III типов, а матриксная металлопротеиназа-9 (ММП-9) – в отношении коллагенов IV и V типов [28, 29]. В ряде работ представлены данные о повышении уровня ММП-9 и снижении концентрации ММП-1 при ХП [27, 30].
Гиалуроновая кислота (ГК) является важным компонентом межклеточного вещества, хотя встречается и во внутриклеточном матриксе. Высокая концентрация в веществе микроокружения рака ПЖ и эффективное применение ГК в качестве биомаркера фиброза печени обусловливают перспективность изучения ее уровня для оценки наличия и выраженности фиброза ПЖ [31, 32].
Важный компонент межклеточного вещества белок фибронектин (ФН) в большом количестве обнаруживается в фиброзных изменениях различных локализаций и влияет на неоангиогенез. Кроме того, повышение его концентрации выявлено при исследовании экспериментального фиброза ПЖ в животных моделях, что может свидетельствовать в пользу участия ФН в развитии фиброза ПЖ при ХП [25, 33, 34].
Таким образом, в настоящее время остро стоит проблема неинвазивной, доступной и морфологически обоснованной диагностики фиброза ПЖ, которая в итоге приведет к улучшению качества своевременного распознавания и лечения раннего ХП.
Цель исследования – определить возможности неинвазивной оценки выраженности фиброза ПЖ с помощью постобработки результатов мультиспиральной КТ и измерения концентрации потенциальных биомаркеров фиброза (ММП-1, ММП-9, ГК и ФН).
Материал и методы
Проведено наблюдательное одноцентровое проспективное исследование в высокопотоковом медицинском центре третьего уровня оказания медицинской помощи – Московском клиническом научно-практическом центре им. А.С. Логинова в рамках реализации научно-практического проекта в сфере медицины «Оценка степени фиброза ПЖ как фактора прогноза течения ее патологии» (соглашение № 2412-21/22 от 21.03.2022 г.).
В исследование включено 165 пациентов в возрасте 57,91 ± 13,5 года, в т.ч. 69 (41,8%) мужчин и 96 (58,2%) женщин. Все включенные в исследование пациенты были обследованы с апреля 2022 по февраль 2024 г. и подверглись хирургическому лечению новообразований ПЖ и ХП. К критериям включения относились возраст пациентов – 18–99 лет, запланированное хирургическое лечение в виде резекционного вмешательства на ПЖ, а также согласие пациента на участие в исследовании. В исследование не включались пациенты с нерезектабельными опухолями ПЖ, а также те, кто не мог подписать информированное добровольное согласие на момент включения в исследование. Критерием исключения была невозможность получения клинических, лабораторных, инструментальных данных и морфологического исследования материала, полученного в ходе оперативного лечения. В рамках предоперационного обследования за три дня до операции всем пациентам проводили мультиспиральную КТ с внутривенным контрастированием. Окончательный диагноз устанавливали по данным патоморфологического исследования удаленного препарата. Результаты мультиспиральной компьютерной томографии (МСКТ) с внутривенным контрастированием и патоморфологического исследования фиксировали в электронной базе данных для последующего анализа.
Проведение мультиспиральной КТ
Все исследования КТ с внутривенным контрастированием проводили на аппарате Aquilion CXL 128 (Toshiba, Tokyo, Japan) с толщиной среза 1 мм с шагом реконструкции 0,5 мм для получения изотропной реконструкции, подходящей для дальнейшего сопоставления с результатами патоморфологического исследования. Применяли неионные рентгеноконтрастные препараты (КП) с содержанием йода 350 мг/мл. КП вводили со скоростью 3,5 мл/с, в объеме до 100 мл в зависимости от массы тела пациента из расчета 1 мл/кг. Использовали стандартный мультифазный протокол КТ, включающий бесконтрастную фазу (БФ), раннюю артериальную – 15–20 с от начала введения КП, позднюю артериальную или панкреатическую (ПФ) – 35–40 с от начала введения КП, венозную (ВФ) – 60–80 с от начала введения КП и отсроченную фазу – 5–7 мин от начала введения КП.
Постобработка результатов МСКТ
Все исследования и их постобработка проанализированы с помощью лицензионного программного обеспечения RadiAnt DICOM-viewer (версия 2023.1) специалистом рентгенологом с опытом работы 14 лет.
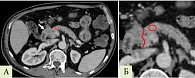
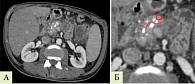
Значения рентгеновской плотности по общепринятой шкале в единицах Хаунсфилда (ед. Х) измеряли в участке ткани ПЖ площадью 0,2–0,8 см2 в области, подлежащей удалению в ходе операции, что в каждом случае согласовывалось с оперирующим хирургом и сопоставлялось с удаленным макропрепаратом. В случае новообразований при измерении отступали на расстояние 20 мм от края новообразования для исключения из измерения зоны потенциальной десмопластической реакции (рис. 1). У пациентов с ХП измерения проводили в участке тканей, которые планировалось удалить в ходе резекционно-дренирующей операции (рис. 2). При этом участок для измерения выбирали таким образом, чтобы в него не входили кровеносные сосуды, патологические включения и образования, панкреатический проток и его боковые ветви, а также кальцинаты.
В качестве постобработки измеряли нормализованные коэффициенты контрастирования ткани ПЖ в панкреатическую (НКПФ) и венозную фазу (НКВФ), а также коэффициент соотношения контрастирования (КК). За основу методики расчета взяты подходы, использованные для оценки структуры ткани ПЖ и опухолевой ткани по данным КТ [35, 36]. Формулы для расчета указанных показателей приведены в табл. 1. В измеренных, по данным МСКТ, участках при патоморфологическом исследовании оценивали степень фиброза ПЖ.
Измерение уровня биомаркеров
Концентрации ФН, ГК, ММП-1 и ММП-9 измеряли в сыворотке крови методом иммуноферментного анализа с помощью следующих наборов реактивов: Technozym Fibronectin reagents (Technoclone, Австрия) – для оценки уровня ФН, Corgenix hyaluronic acid reagents (Corgenix Headquarters, США) – для измерения концентрации ГК и RayBio human MMP-1 and MMP-9 reagents (RayBiotech, США) – для изучения уровня ММП-1 и ММП-9. Согласно рекомендациям производителя, референсные значения концентрации ФН составляли 70–148 мкг/мл, значения концентрации ГК – 28,5–75 нг/мл, для ММП-1 – 88–106 нг/мл, для ММП-9 – 84–103 нг/мл. Регистрацию данных проводили на полуавтоматическом анализаторе типа Sunrise (Tecan, Австрия).
Патоморфологическое исследование
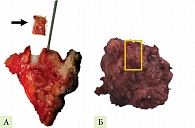
Патоморфологическое исследование удаленных препаратов проводили два опытных врача-патологоанатома с помощью световой микроскопии микропрепаратов, окрашенных по стандартной гистологической методике гематоксилином и эозином. Оценку фиброза ПЖ проводили в интактных тканях ПЖ, исключающих наличие новообразования и возникновение десмопластической реакции (рис. 3).
Образец тканей обрабатывали на автоматическом гистологическом процессоре Leica ASP6025S и микротоме Leica RM 2125 RTS (Leica Biosystems, Wetzlar, Germany) с последующей окраской гематоксилином и эозином (Mayer’s hematoxylin and eosin staining). Для морфометрии и микрофотографии микропрепаратов использовали световой микроскоп Olympus BX51 (Olympus, Beijing, China).
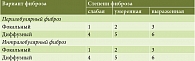
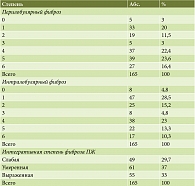
Степень фиброза оценивали по шкале Kloppel и Maillet, впервые предложенной для оценки состояния тканей ПЖ у пациентов с ХП с исследовательскими целями и рекомендованной для научных исследований консенсусом Международной ассоциации панкреатологов, Американской панкреатологической ассоциации, Японским панкреатологическим обществом и Европейским панкреатологическим клубом [37]. Согласно данной шкале, различают фокальный и диффузный фиброз, а также пери- и интралобулярную его формы (табл. 2), на основании чего оценивают интегративную степень фиброза по группам – слабая, умеренная и выраженная [16].
Статистическую обработку проводили при помощи Microsoft Office Excel 2013 и IBM SPSS Statistics 23.0. Для анализа распределения значений использовали тест Колмогорова – Смирнова. С целью определения достоверности и оценки значимости межгрупповых различий между значениями результатов постобработки данных МСКТ, разделенных согласно результатам патоморфологической оценки степени фиброза ПЖ, применяли непараметрические тесты для независимых выборок Манна – Уитни (при попарном анализе групп) и Краскела – Уоллиса (при сравнении значений более чем в двух группах). Парный корреляционный анализ проводили с вычислением коэффициента корреляции Спирмена (rho). Доверительный интервал составил 95%, различия считали статистически значимыми при р < 0,05.
Результаты
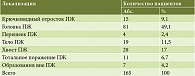
По результатам патоморфологического исследования удаленных препаратов РПЖ диагностирован у 114 (69,1%) пациентов, тяжелый ХП – у 7 (4,2%) пациентов, нейроэндокринные опухоли и кистозные образования – у 13 (7,9%) и 27 (16,4%) пациентов соответственно. Злокачественные новообразования внепеченочных желчных протоков, не сопровождающиеся дилатацией главного панкреатического протока, без необходимости резекции участка ПЖ диагностированы у 4 (2,4%) пациентов. Распределение пациентов по локализации новообразования и степени фиброза представлено в табл. 3 и 4 соответственно.
Значения показателей постобработки результатов КТ сравнивали между группами пациентов с разными значениями степеней пери- и интралобулярного фиброза, а также между группами пациентов, разделенных по интегративной степени фиброза ПЖ. Средние значения плотности ткани ПЖ в БФ и ПФ статистически значимо отличались при различных степенях перилобулярного фиброза (р = 0,024 и р = 0,023 соответственно). Обнаружены статистически значимые отличия значений КК (р = 0,007) в группах пациентов, разделенных по различным степеням перилобулярного фиброза. Значения плотности ткани ПЖ в ПФ и КК статистически значимо отличались у пациентов с разной степенью интралобулярного фиброза (р = 0,021 и p = 0,018 соответственно).
По группами пациентов, сформированным по интегративной степени фиброза ПЖ, зафиксированы статистически значимые отличия между средними значениями плотности ткани ПЖ в БФ и ПФ (р = 0,004 и р = 0,012), а также КК (р = 0,001). Статистически значимых отличий значений НКПФ и НКВФ при различной степени пери- и интралобулярного фиброза, а также интегративных степенях выраженности фиброза не зафиксировано (р > 0,05). Средние значения показателей постобработки результатов КТ в группах пациентов с различной интегративной степенью фиброза представлены в табл. 5. Соотношение средних значений статистически значимых показателей представлено в виде диаграмм размаха (рис. 4). Представленный способ постобработки результатов КТ наиболее эффективен для дифференциации слабой и выраженной степени фиброза ПЖ, в то время как различия с умеренной степенью выраженности фиброза ПЖ проявляются не так явно.
Значения концентрации исследованных биомаркеров сравнивали в группах с разными значениями степеней пери- и интралобулярного фиброза, а также между группами пациентов, разделенных по интегративной степени фиброза ПЖ. Обнаружены статистически значимые отличия только между значениями уровня ФН у пациентов, разделенных по разной интегративной степени фиброза с различными степенями (р = 0,029), и при сравнении групп с различной степенью интралобулярного фиброза (р = 0,017). Статистически значимых отличий значений концентраций ММП-1, ММП-9 и ГК при различной степени пери- и интралобулярного фиброза, а также интегративных степенях выраженности фиброза не зафиксировано (р > 0,05). Средние значения показателей концентрации исследованных биомаркеров в группах пациентов с различной интегративной степенью фиброза представлены в табл. 6. Соотношение средних значений статистически значимых показателей представлено в виде диаграмм размаха (рис. 4). Из представленных таблиц и диаграмм размаха видно, что только уровень ФН может рассматриваться в качестве эффективного биомаркера для неинвазивной оценки степени выраженности фиброза ПЖ.
Корреляционный анализ
Значения плотности тканей ПЖ в БФ и ПФ, а также КК статистически значимо слабо отрицательно коррелируют со степенью перилобулярного и интралобулярного фиброза ПЖ, а также с интегральной степенью фиброза ПЖ (p < 0,05). КК статистически значимо слабо положительно коррелирует со степенью перилобулярного и интралобулярного фиброза ПЖ (p < 0,05). Признаков статистически значимых корреляционных связей между уровнями НКПФ и НКВФ и степенью панкреатического фиброза не получено (p > 0,05). Уровень ФН статистически значимо слабо отрицательно коррелирует со степенью интралобулярного фиброза ПЖ (р = 0,018), а также с интегральной степенью фиброза ПЖ (р = 0,007). Cтатистически значимые корреляционные связи между уровнями ГК, ММП-1 и ММП-9 и выраженностью фиброза ПЖ отсутствуют (p > 0,05). Результаты анализа корреляционных зависимостей представлены
в табл. 7 и 8.
Обсуждение
Проведенное нами исследование заключалось в сопоставлении результатов КТ и уровня биомаркеров с патоморфологической оценкой степени фиброза ПЖ. Обнаружена статистически значимая зависимость между выраженной интегративной степенью фиброза ПЖ и более высокими значениями показателя постобработки результатов КТ – КК, а также более низкими значениями плотности тканей ПЖ в БФ и ПФ. Для слабой степени фиброза ПЖ были характерны более низкие значения показателя КК и более высокие значения плотности тканей ПЖ в БФ и ПФ. Концентрация ФН в сыворотке крови была статистически значимо выше у пациентов со слабой степенью фиброза ПЖ и ниже при выраженной интегративной степени фиброза, что может быть использовано для неинвазивной диагностики фиброза ПЖ.
Для оценки панкреатического фиброза могут применяться различные методы лучевой диагностики, в т.ч. КТ с проведением измерения плотности тканей ПЖ, и различные подходы к постобработке ее результатов, что показано в ряде работ, в т.ч. опубликованных нами ранее [20, 22, 36, 38, 39]. Наряду с измерениями параметров контрастирования непосредственно ПЖ, альтернативным способом обработки результатов КТ является сравнение плотности тканей ПЖ и других органов, чаще всего в селезенке, однако большинство авторов приводят противоречивые результаты [40−43].
Для неинвазивной оценки фиброза ПЖ также используют МРТ и эндоскопическую ультрасонографию (ЭУС). В исследовании MINIMAP с помощью комплексного анализа МРТ проанализированы паренхиматозные и протоковые признаки фиброза ПЖ. В результате выделены три количественных параметра (время продольной релаксации, объем внеклеточной фракции и сигнал от жировой фракции), позволяющие повысить эффективность МР-диагностики фиброза ПЖ [44]. В работе Е. Bieliuniene с соавт. панкреатический фиброз оценивали по продольному времени релаксации и картам измеряемого коэффициента диффузии в сочетании с коэффициентом интенсивности T1-взвешенного сигнала при бесконтрастной МРТ [45]. Сочетание ЭУС с эластографией сдвиговой волны обладает наиболее высокой чувствительностью для диагностики фиброза ПЖ [46, 47], но имеет ограничения ввиду инвазивности и невысокой распространенности.
Плотность тканей ПЖ, измеряемая путем денситометрического анализа результатов КТ, зависит от состава измеряемого участка тканей и состояния микроциркуляторного русла в нем [48]. В работах K. Ohgi и S. Sano с соавт., посвященных прогнозированию формирования панкреатической фистулы во время послеоперационного периода после резекции ПЖ, описана корреляционная зависимость между снижением показателя рентгенологической плотности тканей ПЖ и выраженностью фиброза, что напрямую влияет на вероятность формирования панкреатической фистулы после резекции ПЖ [20, 22]. В работе K. Ohgi и соавт. значение плотности ПЖ > 30 ед. Х является независимым фактором риска формирования панкреатической фистулы и показателем меньшей выраженности фиброза ПЖ [20]. Полученные нами результаты соответствуют результатам, полученным S. Sano и соавт., которые показали, что для рентгенологически более плотной ткани ПЖ характерна более высокая степень фиброза, определенная патоморфологически, и меньший риск развития панкреатической фистулы [22]. Однако авторами получена более сильная отрицательная корреляционная связь между значением рентгенологической плотности тканей ПЖ по данным КТ и степенью фиброза (rho = -0,609, p < 0,001), чем в нашем исследовании (rho = -0,26, p = 0,001). Нами отдельно проанализировано наличие зависимости значений рентгенологической плотности в различных фазах контрастирования от степени фиброза ПЖ, что отличается от данных, приведенных в работах K. Ohgi и S. Sano и соавт. При этом статистически значимые отличия при разных степенях фиброза ПЖ получены нами только для значений рентгенологической плотности тканей ПЖ в БФ и ПФ (р = 0,004 и р = 0,012 соответственно). Отсутствие статистически значимых связей между значениями рентгенологической плотности тканей ПЖ в другие контрастные фазы может быть связано с неодинаковыми объемом и скоростью введения контрастного препарата, а также с особенностями гемодинамики у разных пациентов, как это отмечено в работе K. Ohgi и соавт. [20].
Для устранения потенциальных искажений, сопровождающих прямой денситометрический анализ данных КТ, используются методики постобработки результатов КТ [48]. Принципиально схожий с использованным нами КК-критерий применяли в работе Y. Hashimoto и соавт. Для определения прогностического фактора панкреатической фистулы, риск которой связан с фиброзом ПЖ, авторы рассчитывали отношение плотности тканей ПЖ в позднюю и раннюю контрастные фазы [36]. В нашем исследовании значения КК были статистически значимо (р = 0,001) выше у пациентов в группе с выраженной степенью фиброза ПЖ (КК = 1,16 ± 0,65 ед. Х), чем в группе со слабой степенью панкреатического фиброза (КК = 0,78 ± 0,31 ед. Х). Более того, нами были обнаружены статистически значимые положительные корреляционные связи между значением КК и степенью пери- и интралобулярного фиброза (rho = 0,3; p = 0,0001 и rho = 0,23; p = 0,003 соответственно). Таким образом, полученные нами результаты соотносились с данными, представленными Y. Hashimoto и соавт. [36]. Схожий с использованным нами подход применен в работе S. Gnanasekaran и соавт. для прогноза развития панкреатической фистулы. При этом для вычисления КК использовали значения плотности тканей ПЖ в раннюю отсроченную фазу и АФ. Значение полученного показателя охарактеризовано авторами как эффективный прогностический признак развития панкреатической фистулы [40].
В нашем исследовании не обнаружено статистически значимых различий между группами пациентов с различными степенями фиброза ПЖ и значениями НКПФ и НКВФ (р > 0,05) при использовании методики оценки плотности рентгеновской тканей, предложенной в работе R. Torphy и соавт. Это может быть связано с тем, что в работе R. Torphy и соавт. оценивали плотность опухолевой ткани, а не самой панкреатической ткани [35]. В опубликованных нами ранее промежуточных результатах исследования обнаружены статистически значимые отличия между значениями НКВФ и интегративной степенью фиброза ПЖ [38]. Это расхождение обусловлено уточнением полученных данных на более крупной когорте обследованных пациентов (165 пациентов) по сравнению с промежуточными результатами, полученными
на 74 пациентах.
В нашем исследовании обнаружены статистически значимые межгрупповые различия в средних значениях концентрации ФН у пациентов с различной интегративной степенью фиброза (р = 0,029) и между группами, разделенными по степеням интралобулярного фиброза (р = 0,017). При этом средняя концентрация ФН в сыворотке крови пациентов со слабой интегративной степенью фиброза ПЖ была выше, чем в группе пациентов с выраженной степенью фиброза ПЖ (110,7 в сравнении
с 74,9 мкг/мл). Наиболее вероятно, это объясняется более высокой активностью звездчатых клеток, секретирующих ФН, на ранних стадиях фиброза ПЖ [49, 50]. Полученные данные согласуются с результатами экспериментальных исследований на животных моделях [30, 50].
Статистически значимых различий в концентрации ГК в сыворотке крови у пациентов с разной степенью выраженности фиброза ПЖ не выявлено (p > 0,05), что отличает полученные нами результаты от экспериментальных данных, полученных при индуцированном ХП [30]. Кроме того, из полученных нами результатов следует, что затруднительно экстраполировать успешный опыт применения биомаркеров для оценки фиброза других локализаций, в частности ГК, эффективность измерения концентрации которой описана при фиброзе печени [31]. Также в проведенном нами исследовании не получено статистически значимых различий между значениями уровней ММП-1 и ММП-9 в зависимости от выраженности фиброза ПЖ (p > 0,05). Эти результаты соотносятся с результатами эксперимента, в котором не было получено достоверных взаимосвязей между уровнями ММП-1 [30, 51] и ММП-9 [49]. Тем не менее в научной литературе существуют работы с описанием повышения уровня ММП-9 у пациентов с ХП и, следовательно, фиброзом ПЖ [27, 51].
Наше исследование имеет ряд ограничений. Оно представляет собой одноцентровое исследование, в которое включено большое количество пациентов с РПЖ и другими опухолями ПЖ, поскольку это была единственная возможность разработать патоморфологически обоснованную методику оценки фиброза ПЖ с помощью постобработки результатов КТ и измерения уровня биомаркеров. Кроме того, проведение денситометрического анализа сопровождалось сложностями в связи с необходимостью исключения участков десмопластической реакции из зоны интереса. Это затруднение удалось преодолеть благодаря сопоставлению КТ-изображений с результатами патоморфологического исследования и корректировке выбора измеряемой зоны при анализе данных КТ. Несмотря на эти ограничения, в исследовании получены статистически значимые результаты, которые позволяют судить об эффективности применения использованных подходов для неинвазивной оценки степени фиброза ПЖ и возможности получения дополнительных критериев при диагностике раннего ХП.
Для дальнейшего изучения возможностей неинвазивной диагностики панкреатического фиброза с помощью КТ и измерения уровня ФН сыворотки крови, а также для улучшения диагностики раннего ХП планируется масштабирование методики на более крупную группу пациентов с включением новых лечебно-диагностических центров, а также использование дополнительных иммуногистохимических маркеров для анализа фиброза ПЖ.
Заключение
Постобработка результатов КТ с внутривенным контрастированием с расчетом показателя КК и измерением рентгенологической плотности ткани ПЖ в бесконтрастную и панкреатическую фазу позволяют дифференцировать выраженную и легкую степени фиброза ПЖ, что подтверждается морфологическим анализом интегративной степени фиброза ПЖ.
При тяжелой степени фиброза, подтвержденной по данным морфологического исследования, значение КК повышается, а значения рентгенологической плотности ткани ПЖ в бесконтрастную и панкреатическую фазу снижаются по сравнению с таковыми у пациентов с легкой интегративной степенью фиброза ПЖ. Уровень ФН в сыворотке крови снижается у пациентов с выраженной интегративной степенью фиброза ПЖ и повышается при легкой интегративной степени.
Значения показателей постобработки, заключающихся в измерении нормализованных коэффициентов контрастирования (НКПФ и НКВФ), а также измерение концентрации ГК, ММП-1 и ММП-9 в сыворотке крови не позволяют дифференцировать степень фиброза ПЖ.
Таким образом, обнаружена взаимосвязь между данными КТ, концентрацией ФН и морфологическими признаками фиброза ПЖ, что может быть использовано для неинвазивной диагностики фиброза ПЖ и выявления дополнительных признаков раннего ХП.
Cтатья подготовлена в рамках реализации научно-практического проекта в сфере медицины: «Оценка степени фиброза поджелудочной железы как фактора прогноза течения ее патологии» (соглашение № 2412-21/22 от 21 марта 2022 г.).
I.E. Khatkov, PhD, Prof., Academician of the RAS, K.A. Lesko, PhD, E.A. Dubtsova, PhD, S.G. Khomeriki, PhD, Prof., N.S. Karnaukhov, PhD, L.V. Vinokurova, PhD, N.V. Makarenko, R.E. Izrailov, PhD, Prof., I.V. Savina, D.A. Salimgereeva, D.S. Bordin, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Russian University of Medicine, Moscow
Tver State Medical University
Contact person: Elena A. Dubtsova, dubtsova@mail.ru
Pancreatic fibrosis is a natural outcome of chronic pancreatitis. Clinically, fibrosis is manifested by the development of exocrine pancreatic insufficiency and diabetes mellitus, which negatively affects the digestion process, carbohydrate metabolism and worsens the quality of life of patients. Non-invasive diagnostics of pancreatic fibrosis at the initial stages is extremely difficult due to the absence of its obvious manifestations according to imaging techniques.
Objective – to determine the possibilities of non-invasive assessment of the severity of pancreatic fibrosis using post-processing of multispiral computed tomography (CT) results and measuring the concentration of potential fibrosis biomarkers.
Material and methods. The study included 165 patients aged 57.91 ± 13.5 years who underwent surgical treatment from April 2022 to February 2024 for chronic pancreatitis and pancreatic cancer. All patients underwent CT with intravenous contrast and measured concentrations of fibronectin (FN), hyaluronic acid (HA), matrix metalloproteinase-1 (MMP-1) and -9 (MMP-9). When processing CT results, normalized contrast coefficients of pancreatic tissue in the pancreatic (PF) and venous phases, as well as the contrast ratio coefficient (CR), were measured. Pathomorphological assessment of fibrosis was performed in the tissues of the resected part of the pancreas, not including the neoplasm or desmoplastic reaction. The degree of fibrosis was assessed using the Kloppel and Maillet scale.
Results. The average values of post-processing CT results and biomarker levels were compared in groups divided by the degree of fibrosis. The average values of CC were statistically significantly higher (p = 0.001) in patients with severe pancreatic fibrosis (1.16 ± 0.65 X units) than in patients with mild pancreatic fibrosis (0.78 ± 0.31 X units). A statistically significantly (p = 0.029) lower level of fibronectin was found in patients with severe pancreatic fibrosis (74.9 ± 32.8 μg/ml) compared to the group of patients with mild fibrosis (110.7 ± 72.7 μg/ml).
Conclusion. In patients with severe pancreatic fibrosis, the values of pancreatic tissue radiographic density in the non-contrast and pancreatic phases, as well as the concentration of fibronectin in the blood serum are lower, and the value of the contrast ratio coefficient is higher than in patients with mild fibrosis. Thus, a relationship was found between MSCT data and morphological signs of pancreatic fibrosis, which can be used for non-invasive diagnosis of pancreatic fibrosis and detection of additional signs of early chronic pancreatitis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.