Ацинарная кистозная трансформация головки поджелудочной железы
- Аннотация
- Статья
- Ссылки
- English


Кистозные образования (КО) поджелудочной железы (ПЖ) характеризуются различными этиологическими, морфологическими и клиническими особенностями, представляя сложную клинико-диагностическую задачу для специалистов различных профилей: гастроэнтерологов, хирургов, инструменталистов. Данные изменения ПЖ хорошо визуализируются при ультразвуковом исследовании органов брюшной полости (УЗИ), мультиспиральной компьютерной томографии с внутривенным контрастированием (МСКТ), эндоскопической ультрасонографии (ЭУС), магнитно-резонансной холангиопанкреатографии (МРХПГ), что впоследствии определяет тактику ведения пациентов. Большинство истинных кистозных опухолей представлено образованиями с муцинозной и серозной дифференцировкой эпителия, на долю которых приходится почти 70% [1]. Остальную часть составляют опухоли с эндокринной, смешанной и неопределенной (солидно-псевдопапиллярная опухоль) дифференцировкой.
Кистозные образования ПЖ с ацинарной дифференцировкой чрезвычайно редки и составляют менее 2% случаев всех КО ПЖ. Впервые данный гистологический тип был описан в 1981 г. G. Klöppel как кистозная трансформация ацинусов [2]. Спустя 21 год, в 2002 г. J. Albores-Saavedra предложил термин «ацинарно-клеточная цистаденома» [3]. Позднее, в 2010 г. ацинарно-клеточная цистаденома была включена как отдельная нозологическая форма в классификацию опухолей желудочно-кишечного тракта (ЖКТ) Всемирной организации здравоохранения (ВОЗ) (ICD-O 8551/0) [4]. Однако спустя 16 лет в последнем пересмотре классификации опухолей ЖКТ ВОЗ в 2019 г. термин «ацинарно-клеточная цистаденома» вновь был заменен термином «ацинарная кистозная трансформация» ПЖ без присвоения ICD-O кода заболевания, то есть исключена из группы истинных опухолей ПЖ [5]. Согласно классификации, ацинарная кистозная трансформация (АКТ) представляет собой неопухолевое кистозное повреждение (именно повреждение) ПЖ, стенка которого выстлана как ацинарным, так и протоковым эпителием.
В большинстве описанных случаев АКТ не имеет клинических симптомов и случайно обнаруживается при обследовании больных. При больших размерах АКТ может проявляться билиарной и панкреатической гипертензией и обструкцией, являясь причиной механической желтухи и абдоминального болевого синдрома [6]. Размер кист колеблется от 1,5 до 20,0 см (средний размер – 5,8 см), они могут быть как однокамерными, так и многокамерными. Встречаются варианты с мультицентрическим тотальным поражением ПЖ. Один из редких вариантов КО описан в данной статье.
Клинический случай
Пациентка 65 лет обратилась в Московский клинический научно-практический центр (МКНЦ) им. А.С. Логинова в июне 2019 г. с жалобами на кожный зуд, потемнение мочи, осветление кала. Из анамнеза известно, что больной в 2010 г. выполнена левосторонняя мастэктомия по поводу рака левой молочной железы рТ1N0M0. Химиотерапия, лучевая терапия, гормонотерапия не проводились. В 2017 г. выполнена радикальная мастэктомия по поводу рака правой молочной железы T4bN0M0, и проведено восемь курсов полихимиотерапии. В настоящее время больная получает гормонотерапию анастрозолом. В феврале 2019 г. при амбулаторном обследовании, по данным МСКТ органов брюшной полости без внутривенного контрастирования, выявлена кистозно-солидная опухоль головки ПЖ. В мае 2019 г. амбулаторно выполнено биохимическое исследование крови: впервые выявлен цитолиз (аланинаминотрансфераза (АЛТ) – 669 Ед/л, аспартатаминотрансфераза (АСТ) – 555 Ед/л), холестаз (гамма-глутамилтранспептидаза (ГГТП) – 945 Ед/л, щелочная фосфатаза (ЩФ) – 123 Ед/л), гиперхолестеринемия – до 7,68 мкмоль/л. Данными ультразвукового исследования органов брюшной полости подтверждено наличие очагового образования головки ПЖ, диагностирована билиарная гипертензия (внутрипеченочные желчные протоки расширены до 5 мм), вирсунгэктазия. Для уточнения характера изменений в ПЖ выполнена МРХПГ: кистозное новообразование головки поджелудочной железы до 22 мм в диаметре с обструкцией общего желчного и панкреатического протоков и развитием билиарной и панкреатической гипертензии. Связь с протоковой системой ПЖ не определяется.
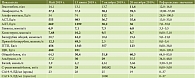
В июле 2019 г. пациентка была госпитализирована в МКНЦ им. А.С. Логинова для дообследования и выполнения пункции кистозного образования головки ПЖ. При динамическом биохимическом анализе крови (16 июня 2019 г.) отмечались нарастание цитолиза (АЛТ – 1299 Ед/л, АСТ – 983 Ед/л) и холестаза (ГГТП – 1343 Ед/л, ЩФ – 931 Ед/л), появление гипербилирубинемии – 61,2 ммоль/л преимущественно за счет прямой фракции, гиперхолестеринемии – 10,2 мкмоль/л. Онкомаркеры СА19-9, РЭА в пределах референсных значений (табл. 1).
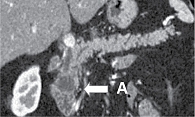
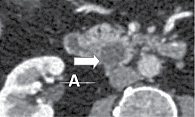
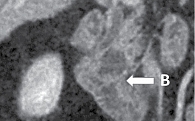
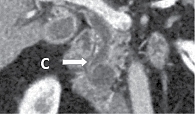
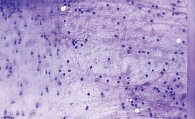
МСКТ с внутривенным контрастированием: КТ-картина кистозного образования головки ПЖ, вероятно цистаденома (рис. 1–3), компримирующая холедох с формированием билиарной гипертензии (рис. 4, 5). Дифференциальный диагноз проведен между муцинозной (наиболее вероятно) и серозной цистаденомами ПЖ, а также метастазом рака молочной железы с кистозной трансформацией. С целью уточнения диагноза пациентке выполнена тонкоигольная пункция опухоли под контролем ЭУС с цитологическим, иммунологическим и биохимическим исследованием пунктата. При пункции получено вязкое прозрачное отделяемое, по физическим характеристикам соответствующее муцину. По данным цитологического исследования, обнаружен муцин без эпителиального компонента (рис. 6). Уровень онкомаркера СА19-9 в отделяемом – 1000 Ед/мл при норме до 37 Ед/мл. Уровень амилазы в отделяемом материале не повышен.
Пациентке рекомендована консервативная терапия полиферментными препаратами в суточной дозе 75 000 Ед липазы, ингибиторами протонной помпы, урсодезоксихолевой кислотой по 250 мг три раза в день и повторная госпитализация в МКНЦ им. А.С. Логинова для проведения оперативного лечения кистозного образования головки ПЖ. В октябре 2019 г. больная была повторно госпитализирована в МКНЦ им. А.С. Логинова.
Предварительный диагноз: Основной: Муцинозная цистаденома головки поджелудочной железы.
Осложнение основного: Вторичный холестатический гепатит. Механическая желтуха.
Сопутствующий: Рак левой молочной железы T1N0M0, оперативное лечение в 2010 г. Рак правой молочной железы T4bN0M0, комбинированное лечение в 2017–2018 гг. (радикальная мастэктомия справа + восемь курсов химиотерапии). Гормонотерапия анастрозолом с 2018 г. по настоящее время.
С учетом полученных результатов обследования – наличия пристеночного солидного компонента (по данным МСКТ), муцина в содержимом кистозного образования, повышения в нем уровня онкомаркера СА19-9 до 1000 Ед/мл онкологический консилиум принял решение провести радикальное оперативное лечение в объеме панкреатодуоденальной резекции.
В октябре 2019 г. пациентке выполнена лапароскопическая пилорус-сохраняющая панкреатодуоденальная резекция. В послеоперационном периоде отмечалось развитие панкреатической фистулы класса B [7], потребовавшей дополнительного чрескожного дренирования под ультразвуковым контролем. Дренаж удален на десятые сутки. Пациентка выписана в удовлетворительном состоянии.
Данные патологоанатомического исследования операционного материала: макропрепарат представлен гастропанкреатодуоденальным комплексом; головка ПЖ размером 5,0 × 5,0 см; главный панкреатический проток проходим, диаметр 0,3 см, открывается на ампуле большого дуоденального сосочка (БДС); общий желчный проток в области радиального перидуктального края расширен до 1,1 см, проходим, открывается на ампуле БДС; вариант взаимоотношения протоков – V-тип. При раскрытии головки ПЖ на переднюю и заднюю поверхности обнаружена однокамерная киста диаметром 23 мм, расположенная ближе к передней поверхности стенки общего желчного протока и стенки двенадцатиперстной кишки, без связи с протоками (рис. 7). Киста тонкостенная, гладкостенная, заполнена прозрачным серозно-муцинозным содержимым. На остальном протяжении железа дольчатая, архитектоника сохранена.
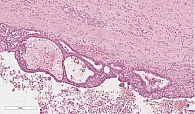
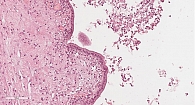
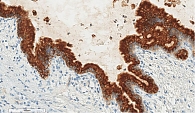
Микроскопически внутренняя поверхность стенки кисты на большом протяжении выстлана ацинарноподобным кубическим эпителием с образованием небольших железистых и солидных структур. Эпителий с эозинофильной цитоплазмой и округлым ядром, ядрышки не выражены (рис. 8). В эпителиальной выстилке в области сосочковых структур просматриваются участки, представленные однорядным одно- или двуслойным муцин-продуцирующим цилиндрическим эпителием (рис. 9). Фигуры митоза и ядерная атипия отсутствуют. Подэпителиальная строма кисты малоклеточная с гиалинозом.
При иммуногистохимическом исследовании отмечалась выраженная положительная реакция с трипсином и муцином 6-го типа (рис. 10). В муцинозном эпителии позитивная реакция с цитокератином 7. Реакции с хромогранином А, синаптофизином и бета-катенином негативные.
Заключение: гистологическая и иммуногистохимическая картина соответствует ацинарной кистозной трансформации поджелудочной железы.
Таким образом, у пациентки диагностирована редкая форма кистозного образования ПЖ – ацинарная кистозная трансформация ПЖ.
Обсуждение
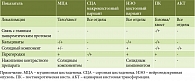
Представленный случай редкого кистозного образования ПЖ отражает все трудности предоперационной диагностики кистозных новообразований ПЖ. Несмотря на проведение комплексного предоперационного обследования, окончательный клинический диагноз был установлен только по результатам патологоанатомического исследования. Предоперационная диагностика новообразований ПЖ основывается на сочетании клинических, рентгенологических и серологических данных. При КО ПЖ неспецифические отклонения лабораторных показателей обусловлены обструкцией билиарного дерева, а уровень онкомаркеров не превышает нормальных значений [8, 9]. Лучевая диагностика затруднительна ввиду сходства МСКТ-картины с некоторыми другими КО, особенно с муцинозной кистозной опухолью. В таблице 2 представлен ряд параметров для дифференциальной МСКТ-диагностики кистозных новообразований поджелудочной железы [7, 10, 11].
В некоторых ситуациях клиническое значение имеет диагностическая пункция образований. Повышенный уровень ракового эмбрионального антигена (РЭА) в пунктате – диагностический признак муцинозной цистаденомы [12]. Вывод о наличии муцина был сделан на основании субъективных данных – вязкого прозрачного отделяемого, полученного при пункции.
При интраоперационном гистологическом исследовании трудности возникают при изучении криостатного среза из-за наличия двойного протокового и ацинарного типов эпителия в данных кистозных образованиях [13]. Протоковый эпителий обычно цилиндрический однорядный, с минимальными признаками ядерного полиморфизма. Напротив, ацинарный эпителий, особенно на криостатных срезах, имитирует фокусы тяжелой дисплазии за счет ядерной гипертрофии, свойственной данному методу исследования, что может привести к ошибочной интерпретации результатов в сторону более злокачественного процесса [14]. Плановое исследование при соблюдении патологом четкого протокола диссекции не вызывает каких-либо диагностических сложностей.
В литературе не описаны случаи рецидива или малигнизации АКТ [9, 15]. Этот факт объясняется гистогенезом данного образования. Анализ гистологических исследований описанных в мировой литературе случаев, включая представленное выше клиническое наблюдение, показывает, что дифференцировка ацинарных клеток в АКТ возникает как результат метаплазии протокового эпителия. Ацинарная метаплазия достаточно редкий вид метаплазии в ПЖ и, как правило, затрагивает протоки мелкого калибра с частичной или полной заменой эпителия. В норме ацинарные клетки ПЖ не экспрессируют цитокератин 7, который является основой цитоскелета клеток протокового эпителия. Однако во всех случаях при иммуногистохимическом исследовании отмечалась положительная реакция с данным маркером, что подтверждает первоначальный протоковый фенотип клеток.
Согласно литературным данным, наиболее частым этиологическим фактором является механическая обструкция протоков ПЖ. Однако в представленном клиническом примере паренхима ПЖ вне образования была интактна, без признаков хронического панкреатита или обструкции главного и боковых панкреатических протоков. Вероятно, у данной пациентки решающую роль в развитии ацинарной трансформации бокового протока с дальнейшим кистозным его расширением сыграла предшествующая химиотерапия по поводу рака молочной железы. В результате этого изменились реологические свойства (плотность и вязкость) панкреатического сока, приведшие к функциональной внутрипротоковой обструкции, кистозной трансформации и ацинарной метаплазии. Кроме того, отсутствие в ацинарной кистозной трансформации мутаций KRAS, GNAS, RNF43, TP53, CDKN2A и SMAD4, характерных для протокового рака и/или панкреатической интраэпителиальной неоплазии поджелудочной железы, еще раз подчеркивает ее доброкачественный характер (по данным ВОЗ).
Выводы
Отсутствие четких диагностических критериев затрудняет предоперационную диагностику ацинарной кистозной трансформации поджелудочной железы. Показания к хирургическому лечению, а также объем последнего должны определяться индивидуально с участием специалистов различного профиля. Предпочтение следует отдавать органосохраняющим операциям, поскольку данные образования являются доброкачественными и лишь имитируют кистозные опухоли поджелудочной железы.
V.V. Shchadrova, G.R. Setdikova, PhD, O.V. Paklina, PhD, M.E. Baychorov, Yu.V. Kulezneva, PhD, K.A. Nikolskaya, PhD, D.S. Bordin, PhD, Prof., I.Ye. Khatkov, RASci Corr. Mem., PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Botkin City Clinical Hospital
Scientific-Research Institute of Health Organization and Medical Management
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Contact person: Viktoriya V. Shchadrova, vikashhadrova@yandex.ru
Acinar cystic transformation of the head of the pancreas, which is a non-tumor cystic lesion, in the most described in the literature cases does not have clinical symptoms and is being accidentally detected during the examination of patients. Indications for surgical treatment, as well as its scope, are determined individually with the participation of specialists in various fields. Prefered the organ-preserving operations, since this formation is benign.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.