Взгляд на лечение воспалительных заболеваний глотки с позиции разумной медикаментозной политики
- Аннотация
- Статья
- Ссылки
- English
Введение
Острые респираторные инфекции относятся к одним из самых распространенных причин обращения к врачу, их постоянный рост регистрируется во многих странах мира независимо от климатической зоны и уровня социально-экономического развития. Это обусловлено в том числе снижением естественной резистентности населения к инфекциям под влиянием неблагоприятных факторов, угнетающих адаптационные возможности организма. Стрессовое воздействие и неблагоприятное экологическое влияние, частота которых в настоящее время резко возросла, сопровождаются глубокими нарушениями микробного биоценоза организма. Как следствие – формируются дисбиоз слизистой оболочки и вторичные иммунодефицитные состояния, при которых резко снижается резистентность к экзогенной инфекции и эндогенным очагам [1].
В структуре заболеваний верхних дыхательных путей до 30% приходится на острые тонзиллофарингиты (ОТФ) [2]. Возбудителями ОТФ могут быть как вирусы (аденовирусы, риновирусы и др.), так и бактерии (бета-гемолитический стрептококк группы A (БГСА), стрептококки серогрупп С и G, атипичные бактерии), грибы. В большинстве случаев ОТФ имеет вирусную этиологию, но в 15–25% случаев заболевание вызывают патогенные бактерии. Наиболее значимым бактериальным возбудителем ОТФ считается БГСА [3].
Проблема дифференциальной диагностики вирусных и бактериальных поражений лимфоглоточного кольца остается крайне актуальной. Принято считать, что вирусная инфекция способствует присоединению бактериальной. Тем не менее ряд исследователей указывают на обратную зависимость: бактериальный дисбиоз и преобладание условно-патогенной флоры приводят к нарушению целостности эпителия и тем самым создают благоприятные условия для активации вирусных патогенов [4].
Назначение антибактериальной терапии при вирусных и грибковых поражениях ошибочно, поскольку нарушается микробный пейзаж, сапрофитная флора приобретает свойства патогенности, вырабатывается антибиотикорезистентность патогенными и условно-патогенными микроорганизмами. До уточнения этиологии заболевания при неосложненном течении острой патологии глотки рекомендовано местное и системное патогенетическое, а также симптоматическое лечение [5].
Эффективность комбинации лизоцима и пиридоксина
В настоящее время в арсенале врача имеется множество лекарственных средств, воздействующих на слизистую оболочку. В состав этих лекарственных форм входят активные антисептические вещества в комбинации с микроэлементами, вкусовыми добавками [2]. Несмотря на такое многообразие, появление новых видов лекарственных средств местного действия всегда вызывает определенный интерес как у врачей, так и у пациентов.
В 1922 г. Александром Флемингом (Alexander Fleming) был открыт лизоцим. Лизоцим (мурамидаза/гидролаза N-ацетилмураминовой кислоты) представляет собой белок, который проявляет свою ферментативную активность посредством гидролиза бета-1,4-гликозидной связи между N-ацетилмураминовой кислотой (NAM) и N-ацетилглюкозамидом (NAG) в полисахаридном остове пептидогликанов клеточной стенки бактерий.
В медицине лизоцим применяют при острых и хронических воспалительных состояниях, гнойных процессах, ожогах, отморожениях, конъюнктивитах, стоматитах и многих других инфекционных заболеваниях.
Основная функция лизоцима – разрушение внешней оболочки грамположительных бактерий, так называемого муреинового мешка. Благодаря бактериостатическому эффекту снижается активность воспалительного процесса при инфекционных заболеваниях. Лизоцим является естественным неспецифическим иммуномодулятором: в результате расщепления стенки бактерий высвобождается мурамилдипептид – мощный стимулятор иммунитета, который входит в состав пептидогликана клеточной стенки практически всех известных грамположительных и грамотрицательных бактерий [6].
Лизоцим обеспечивает защиту слизистой оболочки ротовой полости от патогенов. Необходимо отметить, что активность лизоцима в слюне детей несколько ниже, чем в слюне подростков и взрослых. При дефиците лизоцима снижается выработка противовоспалительных цитокинов, в частности интерлейкина [7, 8]. Главными продуцентами лизоцима в организме являются околоушные и поднижнечелюстные слюнные железы.
Антибактериальные свойства лизоцима реализуются за счет двух механизмов – ферментативного (разрушение клеточной стенки бактерии (гидролиз бета-1,4-гликозидной связи между N-ацетилмурамилом и N-ацетилглюкозаминилом пептидогликана)) и катионного (молекулы лизоцима встраиваются в клеточную мембрану бактерий, образуя в ней дефекты и тем самым вызывая гибель бактериальной клетки). Благодаря увеличению проницаемости мембран бактерий усиливается эффект других антимикробных препаратов [9].
В основе противовирусного механизма действия лизоцима лежит способность к подавлению репликации ДНК и РНК различных вирусов. Лизоцим играет важную роль в противовирусной защите и лечении во время беременности, когда использование препаратов ограничено из-за вероятного неблагоприятного воздействия на плод [10].
В последние годы отмечаются рост активности грибковой микрофлоры, увеличение микотических поражений слизистых оболочек. Важно, что лизоцим оказывает фунгицидное действие в отношении Candida albicans и Сoccidioides immitis путем ферментативного гидролиза N-гликозидных связей, которые связывают полисахариды и структурные гликопептиды клеточной стенки грибков и приводят к повреждению цитоплазматической мембраны по катионному механизму [8].
Часто неэффективность монотерапии ОТФ обусловлена наличием биопленок. Биопленки представляют собой заключенные в матрицу скопления микроорганизмов, таких как бактерии, грибы, простейшие и вирусы. Они редко состоят из клеток одного типа. Биопленки являются причинами снижения реакции бактерий на антибиотики и ослабления бактерицидного действия противомикробных и дезинфицирующих средств.
Уникальность лизоцима обусловлена способностью разрушать биопленки патогенных бактерий и грибов [11]. Лизоцим разрушает биопленку Staphylococcus aureus и потенцирует противобиопленочный эффект левофлоксацина в низких концентрациях, а в диапазоне концентраций 5–50 мкг/мл подавляет рост биопленок Escherichia coli и Klebsiella pneumoniae [12].
Лизоцим непосредственно связывает и нейтрализует экстрацеллюлярные прооксидантные медиаторы, а также способствует увеличению продукции секреторного иммуноглобулина A – важнейшей адаптивной составляющей мукозального иммунитета [10]. Эффективностью лизоцима как антимикробного и иммуномодулирующего средства объясняется его широкое применение при ряде заболеваний.
Витамины – неотъемлемая часть нормального гомеостаза. Пиридоксин – витамин В6 является стимулятором обмена веществ. Он участвует в превращениях аминокислот, метаболизме триптофана, липидов и нуклеиновых кислот, поддержании иммунного ответа. Кроме того, пиридоксин задействован в производстве кровяных телец и их красящего пигмента – гемоглобина, равномерном снабжении клеток глюкозой, синтезе большинства нейромедиаторов, а также способствует улучшению памяти и настроения.
Комбинация лизоцима и пиридоксина весьма эффективна – они активно потенцируют действие друг друга. Указанные компоненты являются действующими веществами лекарственного средства ЗОТТ. Препарат нетоксичен, не раздражает ткани, хорошо переносится. ЗОТТ предотвращает повреждение слизистой оболочки полости рта, потенцирует ее регенерацию, оказывая в том числе выраженный антиафтозный эффект [10]. Важный момент: препарат может быть рекомендован как в качестве монотерапии, так и в комплексном лечении детей, подростков, беременных и кормящих женщин, иммунокомпрометированных больных и пациентов с подтвержденным наличием нескольких патогенных штаммов в значимой концентрации.
На клинических базах нашей кафедры широко применяемый препарат ЗОТТ демонстрирует хороший клинический эффект. Нежелательных реакций и побочных явлений не зарегистрировано.
Клинический случай
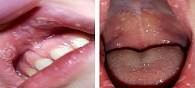
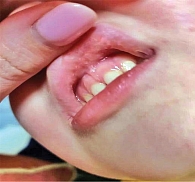
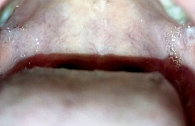
На кафедру оториноларингологии обратилась мать пятилетнего ребенка по поводу его жалоб на боль в горле, налетов на слизистых оболочках полости рта, затруднение глотания. При поступлении взят клинический анализ крови, выполнены стрептотест, забор биологического материала с поверхности слизистой оболочки ротоглотки на микробиологическое и микологическое исследование. При мезофарингоскопии: мягкое небо симметрично, небные миндалины за небными дужками, на слизистой оболочке щек, внутренней поверхности губ картина распространенного афтозного стоматита (рис. 1). Небные миндалины без признаков воспаления. Задняя стенка глотки рыхлая, сосуды инъецированы, имеются лимфоидные гранулы. Подчелюстные лимфоузлы безболезненны, не увеличены. Результаты дообследования: клинический анализ крови – получены референсные значения, стрептотест отрицательный, данные микробиологического исследования (получен через пять суток) – Staphylococcus aureus 103 КОЕ/мл, микологическое исследование – Candida albicans 102 КОЕ/мл. Назначено лечение: препарат ЗОТТ (одна таблетка три раза в день, медленно рассасывать до полного растворения), обработка афт антисептиком. Положительная динамика наблюдалась к третьим суткам (рис. 2). На пятые сутки отмечались нормализация объективной картины в ротоглотке, купирование жалоб (рис. 3).
Заключение
Применение препарата ЗОТТ обосновано в качестве стартовой патогенетической терапии при воспалительных заболеваниях ротоглотки различной этиологии как в виде монотерапии, так и в составе комплексного лечения. Топические препараты, демонстрирующие эффективность при патологии верхних дыхательных путей, широко используются в практике педиатров, терапевтов и оториноларингологов. Своевременное применение препаратов, содержащих лизоцим и пиридоксин, позволяет добиться быстрого облегчения состояния пациентов, сохранить нормальную микрофлору ротоглотки, обеспечить активизацию репаративных процессов.
A.Yu. Ovchinnikov, PhD, Prof., N.A. Miroshnichenko, PhD, Prof., V.A. Yekaterinchev, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Andrey Yu. Ovchinnikov, lorent1@mail.ru
The article presents the biological and pharmacological properties of lysozyme and pyridoxine. Their antibacterial, antifungal, antiviral, immunomodulatory and anti-inflammatory mechanisms of action are described. The expediency of widespread use of topical drugs that enhance the protective functions of the mucous membrane in inflammatory pathology of the oropharynx is emphasized. Such drugs include the drug ZOTT. Its use is associated with an increase in the oropharynx of innate protection against pathogenic bacteria, fungi and viruses, as well as an increase in the effectiveness of systemic antibiotic therapy in the presence of biofilms.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.