Современная агрегометрия в оценке эффективности двойной антитромботической терапии у пациентов с сахарным диабетом, перенесших эндоваскулярное лечение
- Аннотация
- Статья
- Ссылки
![Рис. 1. Механизмы, влияющие на индивидуальную чувствительность к клопидогрелу (адаптировано по [25])](/upload/resize_cache/iblock/3e6/195_350_1/3e6ff6760b8a911b2afbad11400a6ba9.png)

![Таблица 1. Функции рецепторов тромбоцитов и препараты, влияющие на них (адаптировано по [46])](/upload/resize_cache/iblock/10a/195_350_1/10a109d8e3625f2891222bd4be1178f9.png)
![Рис. 4. Строение рецепторного аппарата тромбоцита (адаптировано по [45])](/upload/resize_cache/iblock/072/195_350_1/072df6a42d7d61fe9320753194bad3cb.png)
Сердечно-сосудистые заболевания справедливо называют «эпидемией XXI века». В популяции больных сахарным диабетом (СД) на момент выявления нарушения углеводного обмена 50% пациентов страдают ишемической болезнью сердца (ИБС). Почти 80% из них умирают от сердечно-сосудистых заболеваний [1]. В 2007 г. Европейское общество кардиологов и Европейское общество по изучению СД рекомендовали чрескожное вмешательство на коронарных артериях (ЧКВ) в качестве метода выбора реваскуляризации миокарда у больных СД и ИБС. На основании анализа крупного регистра Рабочая группа по изучению исходов двух видов лечения ИБС у больных СД (Northern New England Сardiovascular Disease Study Group) также призывала шире использовать эндоваскулярное лечение с применением стентов с лекарственным покрытием [2].
У больных с СД и острым коронарным синдромом (ОКС) без подъема сегмента ST ранняя инвазивная стратегия не менее эффективна, чем в общей популяции: результаты исследований FRISC II (Fast Revascularisation during InStability in Coronary artery disease) и TACTICS TIMI 18 (Treat Angina with Aggrastat and Determine Cost of Therapy with an Invasive or Conservative Strategy – Thrombolysis in Myocardial Infarction 18) свидетельствуют о более выраженном снижении частоты развития инфаркта миокарда (ИМ) или смерти у таких пациентов по сравнению с пациентами без СД [3]. Преимущества раннего интервенционного лечения пациентов, страдающих СД, подтверждены и материалами проводящегося в США регистра острых коронарных синдромов CRUSADE [4].
Ранее результаты исследования CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischemic Events), проведенного методом стратификации риска, выявили преимущества длительной терапии препаратом группы антагонистов аденозиновых рецепторов (АДФ) клопидогрелом у больных с СД по сравнению с терапией ацетилсалициловой кислотой (АСК). В группе клопидогрела у 21 из 1000 пациентов в течение года не развились неблагоприятные сердечно-сосудистые события, а в подгруппе клопидогрела, получавшей инсулинотерапию, – у 38 из 1000 [5].
Сегодня интервенционная кардиология является одной из основных сфер применения клопидогрела, входящего, наряду с АСК, в состав стандартной двойной антитромботической терапии (ДАТ), сопровождающей ЧКВ. Но, несмотря на успехи эндоваскулярного лечения, сердечно-сосудистые осложнения после ЧКВ встречаются у больных СД достоверно чаще. При этом в клинических исследованиях, посвященных изучению исходов экстренного и планового лечения ИБС, неоднократно воспроизводилась их сниженная чувствительность к антитромботической терапии по сравнению с лицами без СД [6], а больные с длительным анамнезом хронической гипергликемии, особенно с потребностью в инсулинотерапии, имели самую высокую агрегационную активность тромбоцитов [7].
Нарушения в системе тромбоцитарного гемостаза являются ключевым фактором в развитии острых ишемических расстройств у пациентов с СД в сочетании с сердечно-сосудистой патологией. В данной ситуации происходит вовлечение в патогенез тромбообразования механизмов, ассоциированных с нарушением углеводного обмена: гипергликемии, дефицита инсулина и инсулинорезистентности, метаболических и клеточных нарушений. Претерпевают изменения и другие звенья гемостаза: чрезмерно повышается концентрация факторов коагуляции в плазме крови – фактора VII, тромбина, тканевого фактора, одновременно снижается уровень эндогенных антикоагулянтов – протеина С и тромбомодулина, а также усиливается синтез ингибитора фибринолиза. Эти процессы увеличивают риск тромбообразования и вероятность развития ОКС, причем прогноз последнего ухудшается за счет снижения эффективности ДАТ [8].
ДАТ считается относительно безопасной, не требующей регулярного лабораторного контроля. Она эффективна, если в ближайшие сроки после ЧКВ не развиваются обусловленные тромбообразованием сердечно-сосудистые осложнения, действенная профилактика которых в значительной степени зависит от индивидуальной чувствительности к антиагрегантной терапии. В этой связи в популяции больных СД возможность оценки ДАТ приобретает особое медико-социальное значение.
Механизм действия клопидогрела
Дезагрегантная эффективность клопидогрела обеспечивается окислением пролекарства и превращением его ферментами системы CYP в активный метаболит, который селективно и необратимо ингибирует связывание АДФ с рецепторами тромбоцита и участвует в активизации гликопротеинового рецепторного комплекса IIb/IIIa, что приводит к утрате способности тромбоцитов «отвечать» на стимуляцию АДФ. Уже в течение нескольких часов после приема клопидогрела происходит значительное торможение агрегации тромбоцитов. Ингибирующий эффект нарастает постепенно, достигая максимума через 3–7 дней. После прекращения приема клопидогрела агрегация тромбоцитов постепенно увеличивается и возвращается к исходному уровню через 5–7 дней [9, 10].
Пути метаболизма клопидогрела
Проблема резистентности к клопидогрелу
В литературе приведено достаточно много доказательств того, что высокая резидуальная активность тромбоцитов, определенная in vitro у пациентов, получающих ДАТ, сопровождается риском таких нежелательных явлений, как тромбоз стента и смерть от сердечно-сосудистых событий [23]. В исследовании RECLOSE (Low Responsiveness to Clopidogrel and Sirolimus – or Paclitaxel-Eluting Stent Thrombosis) у лиц с лабораторной резистентностью к проводимой ДАТ частота тромбоза стента оказалась значительно выше (5/45; 11,1%), чем у больных, чувствительных к антиагрегантной терапии (12/570; 2,1%; р < 0,0001). При многофакторном анализе резистентность к компонентам антитромботической терапии (как к АСК, так и к клопидогрелу) оказалась независимым предиктором тромбоза покрытых стентов (отношение рисков (ОР) 3,18; 95% доверительный интервал (ДИ) 1,14–8,83; р = 0,027) и комбинированной вторичной конечной точки (ОР 2,94; 95% ДИ 1,16–7,41; р = 0,022) [24]. Причиной индивидуальной резистентности к клопидогрелу могут служить как генетические, так и иные предпосылки (рис. 1) [25].
Одним из путей решения проблемы преодоления резистентности к клопидогрелу рассматривалось увеличение его дозы. Так, в исследовании OPTIMUS (Results of the Optimizing Antiplatelet Therapy in Diabetes Mellitus Study) изучалось влияние удвоенной дозы клопидогрела (150 мг) по сравнению со стандартной (75 мг) у пациентов с СД 2 типа на фоне стабильных форм ИБС. Оценивалась АДФ-индуцированная агрегация тромбоцитов последовательно через 3 и 30 суток in vitro. По результатам исследования отмечалось значительное снижение активности тромбоцитов в группе пациентов, получавших клопидогрел в дозе 150 мг, по сравнению с группой стандартной терапии [25]. Изучение эффективности и безопасности антиагрегантной терапии с высокими поддерживающими дозами проводилось в многоцентровом исследовании GRAVITAS (Gauging Responsiveness with A VerifyNow assay – Impact on Thrombosis And Safety), где с июля 2008 г. по апрель 2010 г. было скринировано 5429 пациентов из 83 центров США и Канады (из них 45% – больные СД).
Реактивность тромбоцитов по отношению к P2Y12 (РСТ) определялась с помощью теста VerifyNow через 12–24 часов после ЧКВ [26]. РСТ измерялась в единицах PRU (P2Y12 reaction units). Пациенты с высокой РСТ (PRU ≥ 230), составившие 40,8%, рандомизировались в отношении 1:1 на получение клопидогрела в нагрузочной дозе 600 мг в первые сутки после ЧКВ, затем по 150 мг в сутки в течение 6 месяцев или 300 мг с последующей дозой 75 мг в сутки. Дополнительную группу исследования составили случайно отобранные пациенты с нормальной РСТ. Все участники принимали АСК в дозе 75–162 мг в сутки. Это крупнейшее на сегодняшний день исследование, проведенное с участием резистентных к клопидогрелу пациентов, показало, что удвоение дозы препарата не привело к улучшению клинических исходов эндоваскулярного лечения. Частота массивных и умеренных кровотечений в зависимости от дозы препарата достоверно не различалась. Результаты GRAVITAS позволили сделать следующие выводы:
- эффективная стратегия преодоления резистентности к клопидогрелу пока не установлена;
- коррекция оптимальной дозы клопидогрела возможна после лабораторной оценки индивидуальной агрегации тромбоцитов.
Таким образом, проблема индивидуальной оценки функции тромбоцитов у лиц с СД, нуждающихся в эндоваскулярном лечении, очевидна еще и потому, что отдаленные результаты новых поколений антитромботических препаратов, таких как прасугрел и тикагрелол, пока не известны.
Агрегометрия: история и методы
В 1960-х гг. была разработана оптическая агрегометрия (light transmission aggregometry – LTA), использование данного метода позволило диагностировать основные дефекты гемостаза [31, 32]. Метод LTA был признан «золотым стандартом» оценки функциональной активности тромбоцитов [33]. Суть теста такова: в обогащенную тромбоцитами плазму добавляют агонист агрегации. Если агрегация тромбоцитов происходит, степень прохождения света через плазму возрастает. Увеличение прохождения световых лучей при агрегометрии у лиц, получающих антиагрегантную терапию, свидетельствует о степени активности тромбоцитов. Недостатками данного вида агрегометрии являются необходимость лабораторного оборудования и специально обученного медицинского персонала, трудоемкость и длительность исследования, что ограничивает его рутинное использование в клинической практике.
В последние годы на рынке медицинской техники появились устройства, позволяющие оценивать агрегацию тромбоцитов непосредственно на месте лечения пациента. Действие этих так называемых прикроватных агрегометров основано на методе импедансной агрегометрии. Их результаты хорошо коррелируют с данными, полученными при световой агрегометрии [34]. Импедансная агрегометрия, оценивающая функцию тромбоцитов в цельной крови in vitro, была открыта Кардиналом и Фловером в 1980-х гг. В основе метода лежит принцип, согласно которому тромбоциты без влияния определенных факторов находятся в неактивном состоянии. При воздействии стимулирующих агентов-индукторов на специфические рецепторы тромбоцитов происходят их активация и адгезия в месте повреждения сосуда. Когда активированные тромбоциты прикрепляются к электродам, электрическое сопротивление между ними возрастает. Степень плотности тромбоцитов на поверхности электродов сопровождается ростом сопротивления последних.
Главное отличие данного метода состоит в том, что агрегация происходит не в жидкой среде, а на поверхности электродов, моделируя сосудистое повреждение атероматозной бляшки. Метод максимально приближен к условиям in vivo. Исследование агрегации тромбоцитов с различными индукторами проводят не только для выявления нарушений агрегационных функций тромбоцитов: оно также позволяет оценивать эффективность терапии антиагрегантами, подбирать индивидуальные дозы препаратов и проводить лекарственный мониторинг.
Агрегатограмма при оценке функциональной активности тромбоцитов на цельной крови
На рынке медицинской техники представлено большое количество различных агрегометров, однако вследствие использования разных протоколов и индукторов агрегации существуют затруднения в согласовании получаемых результатов. Стандартизированного параметра, по которому можно было бы однозначно судить о гиперактивности тромбоцитов и степени ее изменения на фоне антиагрегантных препаратов, в настоящее время не существует. Изначально большинство тестов по оценке функции тромбоцитов использовалось в целях диагностики и лечения состояний, сопровождающихся развитием кровотечений, а не тромбозов [35].
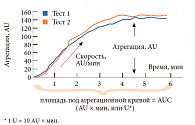
Изменение сопротивления выражается в условных единицах, называемых агрегационными – AU (aggregation unit); повышение импеданса, возникающее в результате прикрепления тромбоцитов к сенсорам, выражается в виде условных агрегационных единиц (AU), соотнесенных ко времени (мин). По данным агрегационной кривой рассчитываются три параметра, основным из которых является площадь под агрегационной кривой (area under curve – AUC) – показатель, наиболее полно отражающий тромбоцитарную активность. На AUC оказывают влияние высота кривой и степень ее наклона. Величина AUC определяется как произведение двух переменных – агрегации (AU) и времени агрегации (мин). Переменная AUC может быть представлена в виде условных единиц (U), пересчет осуществляется следующим образом: 1 U = 10 AU × мин (рис. 3). Два других параметра (агрегация, представленная высотой агрегационной кривой, и скорость агрегации – максимальный наклон кривой) вычисляются во время теста.
Влияние состава крови исследуемого образца на агрегацию тромбоцитов
При исследовании цитратной крови (концентрация 3,2% или 3,8%) было отмечено, что у пациентов без признаков коагулопатии, а также у здоровых добровольцев не происходило агрегации тромбоцитов в должной степени, особенно в случаях использования в качестве ее агониста АДФ. Более того, была получена значимая вариабельность агрегационного ответа при использовании одних и тех же образцов крови при повторных определениях. Причиной данного феномена был признан низкий уровень кальция, так как производные лимонной кислоты связывают кальций в образце крови, что предотвращает ее свертывание. Однако кальций является важным посредником, необходимым для агрегации тромбоцитов, и для полной трансформации и экспозиции рецепторов на поверхности тромбоцита, необходимых для адгезии и агрегации, требуется его высвобождение из внутриклеточного запаса [38].
Во время проведения агрегации по методу Борна формирование нестойких конгломератов приводит к повышению прозрачности в образце крови, что выражается ростом агрегационной кривой. При использовании системы PFA-100 агрегация зависит от степени присоединения фактора Виллебранда к тромбоцитарным рецепторам GP Ib, присутствующим на поверхности неактивированных тромбоцитов. В системе Accumetrics® Verifynow® агрегация тромбоцитов происходит на поверхности латексных шариков, покрытых фибриногеном. В тесте Multiplate® для возникновения сигнальной реакции необходимо плотное прикрепление тромбоцитов к поверхности, что, по сравнению с другими функциональными тестами, имеет большую зависимость от физиологического уровня кальция. В данном методе используется гирудин, прямой ингибитор тромбина, не влияющий на концентрацию свободного кальция в образце крови [38].
Вещества, влияющие на агрегацию тромбоцитов
Мембраны тромбоцитов содержат рецепторы для многих индукторов их активации, а также ее ингибиторов. У тромбоцитов человека выявлено около 30 участков рецепторного связывания биологически активных соединений разнообразной химической природы (рис. 4). Функции рецепторов тромбоцитов и препараты, влияющие на них, представлены в таблице 1. Условно индукторы агрегации можно разделить на две группы:
- слабые индукторы (АДФ в низких концентрациях, адреналин, вазопрессин, серотонин);
- сильные индукторы (коллаген, тромбин, высокие дозы АДФ, тромбоксан А2, фактор активации тромбоцитов).
Индуцированная агрегация тромбоцитов и ее клиническое значение
В интервенционной кардиологии исследования агрегации тромбоцитов (тесты) с различными индукторами позволяют не только выявить нарушения их функциональной активности, но и оценить эффективность терапии антиагрегантами и осуществить подбор их индивидуальной дозы, что немаловажно для клиницистов. В клинической практике применяются различные индукторы, механизмы действия которых приведены ниже.
Аденозина дифосфат (АДФ) АДФ – основной индуктор, рекомендованный для оценки антитромботической эффективности клопидогрела. Степень агрегации тромбоцитов при добавлении АДФ зависит от его концентрации. Действие АДФ в качестве индуктора опосредуется через связывание с рецептором P2Y12. При взаимодействии тромбоцитов с АДФ происходит изменение их формы, экспозиция на мембране комплекса GPIIb–IIIa (рецептор для фибриногена) и первичная кальций-зависимая агрегация.
Если первичный ответ на АДФ не будет поддержан вторичной агрегацией, то в отсутствие фибриногена происходит десенситизация рецепторов, приводящая к дезагрегации тромбоцитов. Вторичная агрегация опосредована внутриклеточной передачей сигнала через G-белки с повышением внутриклеточной концентрации Са2+. В результате активации простагландин-тромбоксановой системы происходит секреция фактора Виллебранда (vWF), Р-тромбоглобулина, тромбоспондина, фибронектина и других активных компонентов из альфа-гранул, что запускает процесс вторичной агрегации. Степень АДФ-индуцированной агрегации также зависит от уровня экспрессии генов GP IIb, P2Y12 и P2Y1 [39].
Тест с использованием АДФ в качестве индуктора может показывать заниженные значения при одновременном приеме других лекарств, влияющих на агрегацию тромбоцитов, или при тромбоцитопении. Следует отметить, что АСК существенно не влияет на результаты АДФ-теста [40].
АДФ и простагландин E1 Данный тест обладает большей чувствительностью и меньшей специфичностью к клопидогрелу и другим блокаторам рецептора P2Y12 по сравнению с использованием только АДФ [41]. Связывание АДФ с рецептором P2Y12 снижает в тромбоцитах уровень циклического аденозинмонофосфата (цАМФ), что способствует увеличению высвобождения кальция из внутриклеточных запасов. Рост уровня кальция приводит к активации и агрегации тромбоцитов. В свою очередь, простагландин Е1 снижает высвобождение кальция и замедляет агрегацию тромбоцитов, следовательно, клопидогрел в этом тесте действует как синергист простагландина [38].
Коллаген Коллагеновый тест рекомендуется в качестве дополнительного при оценке индивидуальной эффективности АСК. Коллаген-индуцированная агрегация тромбоцитов имеет достаточно выраженную латентную фазу, во время которой происходит активация фосфолипазы С. Продолжительность этой фазы может составлять 5–7 мин. После завершения этого периода в тромбоцитах происходят процессы, вследствие которых начинается секреция тромбоцитарных гранул и синтез тромбоксана А2, что сопровождается резким усилением межтромбоцитарного взаимодействия.
Пептид TRAP-6 Данный тест отражает потенциальную способность тромбоцитов к агрегации. В качестве индуктора выступает пептид, активирующий рецептор тромбина Thrombin Receptor Agonist Peptide (TRAP-6). Тромбин является мощным физиологическим индуктором агрегации, его влияние не ингибируется АСК и клопидогрелом, но может подавляться блокаторами рецепторов GP IIb/IIIa [38]. Воздействие тромбина на тромбоцит опосредовано собственным рецептором и GP Iba. Стимуляция тромбинового рецептора сопровождается активацией тромбоцитов через G-белок, фосфолипазу С и включение фосфоинозитольного механизма активации.
Этот путь сопровождается быстрым увеличением концентрации цитозольного Са2+, секрецией aльфа-гранул и электронно-плотных 5-гранул. Секретируемый из 5-гранул АДФ необходим для образования агрегатов, а выделяемые aльфа-гранулами фибриноген, vWF, тромбоспондин – для их стабилизации. Оккупация молекулами тромбина высокоаффинных рецепторов GP Iba приводит к перестройке фосфолипидной мембраны, стимуляции ее прокоагулянтной активности и повышению аффинности GP IIb/Ша. В результате действия тромбина практически не наблюдается двухволновой агрегации. Зависимость функциональной активности тромбоцитов от количества рецепторов GP IIb/IIIa, преимущественно у пациентов с сердечно-сосудистой патологией, отмечали многие исследователи [42–44].
Арахидоновая кислота и ТRAP-6 Этот тест наиболее часто используется в системе Multiplate для мониторирования эффективности АСК. У пациентов, не принимающих АСК, результаты тестов с применением TRAP-6 и арахидоновой кислоты достоверно не различаются, для получающих АСК больных характерна более слабая агрегация тромбоцитов.
Выводы
Внедрение в клиническую практику стентирования артерий, пораженных атеросклерозом, дает новые возможности в лечении кардиологических пациентов с сопутствующим СД. При сопровождении ЧКВ антиагрегантной терапией клопидогрелом и АСК существенно снизилась частота развития атеротромбоза в стенте и повторных стенозов. Однако вероятность возникновения резистентности к антиагрегантным препаратам, особенно к клопидогрелу, снижает эффективность эндоваскулярного вмешательства. Для изучения подобных осложнений с целью выработки превентивных мер против их возникновения наиболее часто клиницисты анализируют неблагоприятные исходы у пациентов, получающих ДАТ, реже – ограничиваются анализом агрегации тромбоцитов in vitro.
Очевидно, что такого подхода недостаточно, особенно для больных СД. Целесообразным является определение резистентности к составляющим ДАТ и проведение индивидуального лабораторного контроля ее эффективности. В связи с этим представляется необходимым развитие современных методов исследования, в частности агрегометрии. В будущем, с развитием персонифицированной медицины, для определения степени риска возникновения осложнений у пациентов, получающих антиагрегантную терапию, особенно с сопутствующим СД, может стать необходимым проведение комплексных генетических и фармакогенетических исследований, в том числе с использованием современных молекулярных технологий.
