количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Практика
Современная диагностика заболеваний молочных желез
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" №1 (11)
- Аннотация
- Статья
- Ссылки
- English
В статье представлены современные взгляды на диагностику заболеваний молочных желез у женщин. Подчеркивается необходимость проведения комплексного обследования, включающего в себя осмотр и пальпацию, рентгенографию, ультразвуковое исследование, радиотермометрию. Рассматривается взаимосвязь гинекологических заболеваний и заболеваний молочных желез. Отмечается, что у женщин с заболеваниями молочных желез нет противопоказаний для применения гормональных средств, содержащих половые стероидные гормоны.
Выбор гормонального препарата у женщин, имеющих фиброзно-кистозную болезнь или входящих в группу риска рака молочной железы, должен базироваться на существующих в настоящее время доказательствах влияния эстрогенного и прогестагенного компонента на молочную железу.

Рис. 1. Поле внутренних температур и термограмма пациентки К., 25 лет
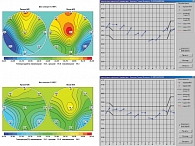
Рис. 2. Поле внутренних температур и термограмма до и после лечения у пациентки А., 46 лет, с диагнозом «диффузная фиброзно-кистозная мастопатия»
Введение
Подавляющее число заболеваний молочной железы относятся к неопухолевым процессам, опухоли встречаются в десятки раз реже. Однако рак молочной железы является ведущей онкологической патологией у женщин. По данным Всемирной организации здравоохранения, раком молочной железы ежегодно заболевают свыше
1 млн женщин во всем мире; прогнозируется, что данный показатель к 2016 г. достигнет 1,45 млн. Следует отметить, что низкая выявляемость злокачественных образований на ранних стадиях зачастую обусловлена недостатком знаний в области клинической маммологии у врачей акушеров-гинекологов, к которым женщины обращаются чаще всего. Дело в том, что акушер-гинеколог при профилактическом приеме далеко не всегда включает в схему осмотра и сбора анамнеза пациентки изучение состояния молочных желез. В этой связи важной задачей представляется организация взаимодействия врачей гинекологов и онкологов-маммологов. Врачи первичного звена должны направлять женщин на маммологический скрининг – массовое периодическое обследование здорового населения с целью выявления скрыто протекающего хронического заболевания. Важнейшей частью скрининга считается выявление доброкачественных и злокачественных опухолей, предраковых состояний, дисгормональных и воспалительных заболеваний молочной железы, а также оказание и контроль своевременной медицинской помощи.
Изучение физиологических процессов, происходящих в молочных железах здоровых женщин, показало, что эти процессы тесно связаны с функциональными циклическими изменениями органов репродуктивной системы. Высокая чувствительность структур молочных желез к гормональным факторам, а также динамическая нестабильность морфо-функционального состояния желез предопределяют склонность к развитию различных патологических дисгормональных процессов. Среди множества факторов, провоцирующих развитие заболеваний молочных желез, не последнее место отводится отягощенному акушерскому анамнезу.
Анализ эпидемиологических и экспериментальных данных позволяет высказать предположение о прямой зависимости возникновения заболеваний молочной железы от кумулятивного количества регулярных овуляторных циклов. Известно, что риск развития нераковых и раковых заболеваний молочных желез в 3,4–4 раза выше у женщин, которые перенесли 3 и более искусственных аборта, по сравнению с пациентками, не имеющими преждевременного прерывания беременности. Искусственное прерывание беременности на ранних сроках из-за резкой гормональной перестройки нарушает пролиферативные процессы и вызывает выраженную перестройку молочной железы. Эти резкие регрессивные изменения происходят неравномерно, могут приобрести деструктивный характер и явиться пусковым моментом для формирования диффузных и узловых форм мастопатии [1].
Методы диагностики заболеваний молочных желез
Доступность молочных желез для обследования и кажущаяся простота диагностики часто приводят к неправильной интерпретации результатов клинического исследования, которое зачастую проводится малоподготовленными в этом вопросе специалистами. Все это ведет как к гипо-, так и к гипердиагностике. В этой связи мануальное обследование должно дополняться комплексным рентгенологическим, ультразвуковым (УЗИ), радиотермометрическим (РТМ) и другими видами инструментальных исследований.
Мануальное обследование
Осмотр и пальпация – основные и доступные методы исследования состояния молочной железы. Во время осмотра женщина находится сначала в вертикальном (с опущенными, а затем поднятыми вверх руками), а потом горизонтальном положении. Врач учитывает аномалии (добавочные молочные железы), изменение формы и объема молочных желез, изменение цвета кожных покровов (наличие и степень выраженности венозного рисунка, кожные симптомы). Пальпаторно обследуется последовательно вся железа по квадрантам и область субмаммарной складки. При пальпации молочных желез определяются участки болезненных уплотнений без четких границ в виде тяжей, а также грубые железистые дольки в виде «булыжной мостовой». Довольно часто встречается локальная болезненность. Указанные изменения характерны для верхненаружных квадрантов, которые в функциональном отношении являются наиболее активными.
Рентгенография
Маммография – рентгенография молочной железы без применения контрастных веществ – простой, безопасный для обследуемых метод, который отличается высокой диагностической значимостью. Женщинам старше 40 лет рекомендуется проходить маммографический скрининг 1 раз в 2 года. Маммографию проводят в двух проекциях (прямой – краниокаудальной – и боковой) на 5–10-й день менструального цикла, когда паренхима молочной железы менее отечна и болезненна, а при отсутствии менструаций – в любой день. Можно также использовать дополнительную боковую проекцию с медиолатеральным ходом луча (косая проекция).
При маммографии могут быть обнаружены первичные и вторичные признаки злокачественности. Первичным и основным рентгенологическим признаком рака молочной железы является наличие опухолевой тени и микрокальцинатов. К вторичным (косвенным) рентгенологическим признакам рака молочной железы относят симптомы со стороны кожи, соска, окружающей ткани молочной железы, усиленную васкуляризацию и т.д. По данным большинства авторов, процент достоверности маммографического исследования в диагностике рака составляет от 75 до 95%.
Широкое распространение маммографического скрининга позволило накопить и проанализировать опыт по рациональному использованию скрининговых программ:
- индентификация многих инвазивных раков молочной железы низкой степени злокачественности. Такие опухоли характеризуются хорошим прогнозом, однако они медленно прогрессируют, поэтому очень поздно проявляются клинической симптоматикой;
- обнаружение инвазивного рака высокой степени злокачественности, когда опухоль еще не определяется пальпацией, что позволяет снизить смертность от рака молочной железы;
- вероятность выявления рака при скрининге зависит от продолжительности времени доклинического обнаружения опухоли: чем продолжительнее это время, тем больше шанс обнаружения опухоли.
Следует пояснить, что модель допускает существование периода нераспознаваемого заболевания, когда ранние ступени малигнизации уже имеются, происходит деление клональных клеток, их дифференциация и пролиферация, но опухоль еще не может быть обнаружена при скрининге. С точки отсчета, когда опухоль может быть обнаружена с помощью скрининга, начинается так называемое «временное пребывание» или «выявляемая доклиническая фаза». Время «опережения» означает временной отрезок между фактическим обнаружением опухоли при скрининге и клиническим ее выявлением, если бы не было скрининга. Среднее «время опережения» в уже проведенных программах скрининга составляет 3–4 года, чем это время короче, тем меньше оснований надеяться на успех скрининга и сокращение смертности от рака молочной железы.
Таким образом, основные преимущества маммографии, используемые при диагностике заболеваний молочной железы, следующие:
- возможность получения позиционного изображения молочной железы;
- высокая информативность при обследовании;
- возможность визуализации непальпируемых образований;
-
возможность сравнительного анализа снимков в динамике.
Среди недостатков метода, ограничивающих его применение, можно отметить дозовую нагрузку, хотя она и очень мала, и невозможность диагностики рентгенонегативного рака, который имеет место, по данным литературы, в 1,8–16% случаев. Кроме того, эффективность данного метода, визуализирующего структурные изменения тканей, снижается при наличии опухолей малых размеров на фоне плотных железисто-фиброзных структур. Средний размер образования, выявляемого при маммографии, составляет 13 мм, а частота обнаружения опухолей менее 10 мм составляет около 15%.
Ультразвуковая диагностика
Ультразвуковая диагностика постоянно наращивает свой потенциал благодаря совершенствованию уже имеющихся и разработке новых методик. Сканирование выполняется на ультразвуковых аппаратах линейным датчиком с частотой 7,5–10 МГц при коэффициенте увеличения изображения 1,5 и с использованием иммерсии (наличие слоя геля на соприкасающихся поверхностях кожи и датчика для уменьшения содержания между ними воздуха).
Преимуществами УЗИ молочных желез являются:
- отсутствие дозовой нагрузки (возможно обследование беременных и кормящих женщин);
- высокая разрешающая способность, что важно при плотном фоне молочной железы у молодых женщин (возможность визуализации рентгенонегативных опухолей, образований, расположенных вблизи грудной стенки);
- дифференциальная диагностика солидного и полостного образования (практически 100%-ная диагностика кист любого размера);
- оценка состояния силиконовых имплантатов молочных желез, особенно при их разрывах и утечке содержимого;
-
обследование молочных желез в острый период травмы или воспаления.
Указанные преимущества позволяют использовать УЗИ самостоятельно у женщин до 40 лет и в сочетании с рентгенологическим методом в группе после 40 лет. Совместное их применение позволяет повысить точность диагностики заболеваний молочных желез до 97%. Среди недостатков УЗИ следует отметить отсутствие визуализации органа в целом (только томографический срез), субъективность интерпретации полученного изображения и отсутствие стандартизации.
Таким образом, ультразвуковую и рентгенологическую маммографию целесообразно считать не альтернативными, а взаимодополняющими методиками, которые должны широко использоваться в диагностическом алгоритме заболеваний молочных желез.
Радиотермометрия
Все имеющиеся в литературе данные базируются в основном на анализе и выявлении структурных элементов и относительного риска развития заболеваний молочных желез. Причина – отсутствие объективного метода оценки функционального состояния молочных желез. Новой технологией измерения температуры тканей молочной железы и ее цифрового изображения является метод микроволновой РТМ (РТМ-исследование) с использованием компьютеризированного диагностического комплекса. Суть метода заключается в измерении интенсивности собственного электромагнитного излучения внутренних тканей пациента в диапазоне сверхвысоких частот, которое пропорционально температуре тканей.
В настоящее время на кафедре радиологии РМАПО проводится работа по определению диагностических возможностей метода РТМ. Главная задача исследований – проанализировать изменения показателей внутренней температуры ткани молочной железы в зависимости от возраста, различного акушерского анамнеза, приема различных препаратов, в том числе и гормональных, и, как результат, подтвердить или опровергнуть значимость ряда факторов, прямым или косвенным образом влияющих на состояние молочных желез.
По полученным данным, у женщин в возрасте 21–45 лет железистые дольки хорошо развиты. Средняя температура колеблется от 34,0 до 35,5 °С. Температура молочной железы, как правило, ниже температуры тела на 1 °С. Разница температуры между соседними квадрантами и одноименными квадрантами противоположной молочной железы составляет не более 0,5 °С. При РТМ-исследовании нормальным считается неравномерное повышение температур по направлению от ареолы к верхним квадрантам, максимальное значение температуры отмечается, как правило, в верхненаружном квадранте.
Исследования внутренней температуры молочной железы показали, что во вторую фазу менструального цикла происходит симметричное повышение температуры на 1 °С во всей молочной железе, что отражает пролиферативные процессы в структурах стромы, усиление кровенаполнения и проявляется в виде предменструального напряжения. Симметричность повышения температуры в обеих молочных железах характеризует физиологические процессы, что наглядно демонстрируют графики и цветные диаграммы (рис. 1). В то же время в первую фазу цикла происходит симметричное снижение внутренней температуры, это время является оптимальным для проведения РТМ-обследования. Таким образом, физиологические процессы в молочных железах имеют свои специфические особенности, которые определяются РТМ-методом и, как правило, не фиксируются другими диагностическими методами.
Описываемый метод диагностики оптимален для наблюдения за женщинами, имеющими фиброзно-кистозную мастопатию, и для выявления группы риска на фоне приема гормональных препаратов с целью предохранения от беременности или лечения различных гинекологических заболеваний.
В силу абсолютной безвредности РТМ-диагностики ее можно использовать для контроля лечения различных форм мастопатии и оценки функционального состояния молочных желез при назначении гормональной терапии. При дисгормональной гиперплазии происходит изменение температурной активности тканей молочной железы. В результате изменяется температурное поле пациентки. В процессе лечения температурное поле нормализуется, что может являться объективным критерием правильности выбранной тактики лечения.
Приведем пример использования РТМ-диагностики для контроля лечения. Пациентка А., 46 лет. Имеются признаки мастопатии, однако пальпаторно узловые образования не определяются. Заключение онколога: «диффузная фиброзно-кистозная мастопатия». Заключение рентгенолога: «выраженная диффузная фиброзно-кистозная мастопатия». Пациентке была проведена РТМ-диагностика, до начала лечения определялся дисфункциональный тип термограммы, на фоне лечения наблюдалась позитивная динамика, что подтверждалось результатами РТМ-диагностики (рис. 2).
Таким образом, РТМ можно использовать для контроля лечения различных форм мастопатии, оценки воздействия гормональной терапии на состояние молочных желез. Критериями эффективности назначенной терапии являются нормализация температурного поля, субъективное улучшение состояния пациентки.
Гормональная терапия у женщин с заболеваниями молочных желез
Влияние гормональных средств на молочные железы разнообразно и неоднозначно. Одним из самых обсуждаемых классов препаратов в этой связи являются комбинированные оральные контрацептивы (КОК). Мастопатия не считается противопоказанием для использования КОК. Более того, применение гормональной контрацепции снижает риск развития пролиферативной формы фиброзно-кистозной болезни без атипии и не влияет на риск развития атипичных форм гиперплазии [2–4]. В некоторых исследованиях установлен положительный эффект гормональной контрацепции в отношении клинического течения мастопатии, в частности, интенсивности и продолжительности масталгии [2].
Однако вопрос о приеме КОК как факторе риска развития рака молочной железы по-прежнему не снят, поскольку эпидемиологические исследования то выявляют, то опровергают эту взаимосвязь [5]. Точку в дискуссии мешает поставить относительно низкая частота рака молочной железы у молодых женщин и, соответственно, крайне незначительное повышение абсолютного риска у пользователей КОК, если таковой существует [5]. Если же допустить, что прием КОК повышает риск развития рака молочной железы, этот риск все равно нивелируется в течение 10 лет по окончании использования гормональной контрацепции, а в большинстве случаев рак возникает гораздо позже под действием главного фактора риска – возраста.
Есть еще одно обстоятельство, которое следует учитывать, обсуждая возможные риски применения КОК. Препараты для гормональной контрацепции постоянно совершенствуются, и было бы неправильным отождествлять влияние относительно старых и новых поколений КОК. КОК, существовавшие до 1975 г., действительно повышали риск развития рака молочной железы (относительный риск (ОР) 1,47; 95% доверительный интервал (ДИ) 1,06–2,04) [5]. Влияние «старых» КОК на риск заболевания раком молочной железы обусловливалось двумя факторами: высокой (50 мкг) дозой этинилэстрадиола и фармакологическими свойствами применявшихся в то время прогестинов.
В современных КОК доза эстрогенного компонента снижена, что является залогом большей безопасности препаратов. Недавно проведенные исследования не выявили повышения риска рака молочной железы (ОР 1,17; 95% ДИ 0,74–1,86) у женщин, принимающих низкодозированные препараты, это относилось и к носителям полиморфизма BRCA 1/2 (ОР 1,13; 95%
ДИ 0,88–1,45) [6].
Эффекты синтетических прогестагенов в отношении молочной железы до известной степени уникальны и могут значительно отличаться от действия эндогенного прогестерона. В этой связи необходимо оценивать риск и пользу применения не только комбинированных препаратов, но и чистых прогестагенов, которые также часто используются в клинической практике.
Среди современных прогестагенов различают производные прогестерона, производные 17-гидроксипрогестерона (прегнаны), производные 19-норпрогестерона (норпрегнаны), производные 19-нортестостерона (эстраны и гонаны), производные
17-спиролактона. Производные 19-нортестостерона представлены тремя поколениями: I – норэтинодрел; II – норэтистерон, левоноргестрел; III – дезогестрел, гестоден, норгестимат; и производное 19-нортестостерона, лишенное этинильного радикала, – диеногест. В клинических исследованиях были выделены прогестины, применение которых, вероятно, может повысить риск рака молочной железы: медроксипрогестерона ацетат (группа прегнанов) и норэтистерон (группа эстранов) [7]. В отличие от них, использование натурального прогестерона является более безопасным, что подтверждено в исследовании Е3N [8] и др. [9]. Результаты некоторых экспериментов свидетельствуют о возможном позитивном эффекте современных прогестинов в отношении молочных желез. Так, было показано, что гонаны не влияют на активность ферментов синтеза эстрогенов в молочной железе. Более того, дезогестрел и гестоден угнетают эстроген-индуцированную пролиферативную активность клеток рака молочной железы (линия MCF-7), а левоноргестрел не влияет на нее [2].
Отдельно следует рассмотреть препараты, содержащие в своем составе вместо этинилэстрадиола синтетический аналог натурального 17-бета-эстрадиола. Один из таких препаратов представляет собой уникальное сочетание 17-бета-эстрадиола и номегэстрола ацетата, производного 19-норпрогестерона, в монофазном режиме 24 + 4 (Зоэли, МСД) [10]. Номегэстрола ацетат оказывает сильное воздействие на эндометрий, обладает высокой антигонадотропной активностью и имеет длительный период полувыведения (около 50 часов). Эти свойства препарата позволяют обеспечить стабильность цикла при приеме таблеток с эстрадиолом [11]. В то же время номегэстрола ацетат демонстрирует отсутствие влияния на пролиферацию клеточной линии рака молочной железы, как и прогестерон [12]. Номегэстрола ацетат может изменить метаболизм эстрогена посредством воздействия на активность сульфатазы в нормальных или злокачественных клетках молочной железы таким образом, что количество эстрадиола в ткани уменьшается [11, 13]. Кроме того, номегэстрола ацетат может уменьшить активность 17-бета-гидроксистероид-дегидрогеназы типа 2, что позволяет блокировать превращение эстрона в эстрадиол [13], а в клеточной линии, выделяющей стабильную ароматазу, номегэстрола ацетат подавляет активность ароматазы [14]. Так как присутствие эстрогена в молочной железе усиливает прогестагензависимый процесс пролиферации клеток, то понижение активности эстрогена в результате влияния номегэстрола ацетата может привести к уменьшению риска развития рака молочной железы [13, 15].
Таким образом, у женщин с доброкачественными заболеваниями молочных желез применение гормональных лекарственных средств, содержащих половые стероидные гормоны, не противопоказано. Выбор гормонального препарата у женщин, имеющих фиброзно-кистозную болезнь или входящих в группу риска рака молочной железы, должен базироваться на существующих в настоящее время доказательствах влияния эстрогенного и прогестагенного компонента на молочную железу.
Заключение
В настоящее время продолжается внедрение в практику различных методик скрининга женщин на рак молочной железы. Усилия по совершенствованию ранней диагностики будут более успешны, если первый этап скрининга будет проходить в рамках поликлинической службы практического здравоохранения. Неудивительно, что в этой работе важная роль отводится смотровым кабинетам в лечебно-профилактических учреждениях. Перед врачами ставится задача не только выявлять самые ранние формы заболевания, но и проводить профилактическую работу по его предупреждению, определять женщин из группы риска. К сожалению, знания по проблеме патологии молочных желез у терапевтов, гинекологов, эндокринологов, хирургов, врачей ультразвуковой диагностики, рентгенологов и других специалистов зачастую оказываются недостаточными для эффективного решения организационно-диагностических задач.
В настоящее время высока потребность в доступных неинвазивных методах, обеспечивающих регистрацию клинических изменений в молочных железах и динамическое наблюдение за их состоянием. Для адекватного мониторинга температурных изменений молочной железы обоснован новый клинико-биологический параметр – внутренняя температура ткани молочной железы. РТМ-метод – чувствительный инструмент, фиксирующий малейшее изменение тепловой активности тканей, сопряженной с целым рядом патологических процессов, и позволяющий объективно следить за изменениями в молочной железе в течение времени или в процессе проводимой терапии. Повышение температуры, наличие температурной асимметрии молочных желез являются свидетельством нарастания патологического процесса, неадекватности терапевтического воздействия. Снижение температуры до нормы, отсутствие разницы температур симметричных зон молочной железы свидетельствуют о нормализации состояния молочной железы.
Таким образом, только комплексное обследование пациенток, осуществляемое в специализированных лечебных учреждениях, где наряду с опытными клиницистами-маммологами имеются возможности проведения различных исследований (рентгенологического, УЗИ, РТМ, цитологического и др.), позволяет квалифицированно оказать женщинам необходимую медицинскую помощь.
1. 1. Хайленко В.А., Легков А.А., Бурдина Л.М. и др. Дисплазия молочной железы (фиброзно-кистозная болезнь). Методическое пособие для врачей. М., 1999.
2. 2. Чайка В.К., Сергиенко М.Ю., Желтоноженко Л.В. Лечение дисгормональных заболеваний молочных желез с позиций эндокринной гинекологии // Российский вестник акушера-гинеколога. 2009. № 1. С. 71–75.
3. 3. Burkman R., Schlesselman J.J., Zieman M. Safety concerns and health benefits associated with oral contraception // Am. J. Obstet. Gynecol. 2004. Vol. 190. № 4. Suppl. P. 5–22.
4. 4. Noncontraceptive health benefits of combined oral contraception / The ESHRE Capri Workshop Group // Hum. Reprod. Update 2005. Vol. 11. № 5. P. 513–525.
5. 5. Martin K.A., Douglas P.S. Risk and side effects associated with estrogen-progestin contraceptives // www.utdol.com.
6. 6. Hormones and breast cancer / ESHRE Capri Workshop Group // Hum. Reprod. Update. 2004. Vol. 10. № 4. P. 281–293.
7. 7. Seeger H., Mueck A.O. Are the progestins responsible for breast cancer risk during hormone therapy in the postmenopause? Experimental vs. clinical data // J. Steroid Biochem. Mol. Biol. 2008. Vol. 109. № 1–2. P. 11–15.
8. 8. Fournier A., Berrino F., Clavel-Chapelon F. Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study // Breast Cancer Res. Treat. 2008. Vol. 107. № 1. P. 103–111.
9. 9. Krämer E.A., Seeger H., Krämer B. et al. The effect of progesterone, testosterone and synthetic progestogens on growth factor- and estradiol-treated human cancerous and benign breast cells // Eur. J. Obstet. Gynecol. Reprod. 2006. Vol. 129. № 1. P. 88–83.
10. 10. Mueck A.O., Sitruk-Ware R. Nomegestrol acetate, a novel progestogen for oral contraception // Steroids. 2011. Vol. 76. № 6. P. 531–539.
11. 11. Chetrite G.S., Tomas J.L., Shields-Botella J. et al. Control of sulfatase activity by nomegestrol acetate in normal and cancerous human breast tissues // Anticancer Res. 2005. Vol. 25. № 4. P. 2827–2830.
12. 12. Ruan X., Schneck H., Schultz S. et al. Nomegestrol acetate sequentially or continuously combined to estradiol did not negatively affect membrane-receptor associated progestogenic effects in human breast cancer cells // Gynecol. Endocrinol. 2012. Vol. 28. № 11. P. 863–866.
13. 13. Shields-Botella J., Chetrite G., Meschi S. et al. Effect of nomegestrol acetate on estrogen biosynthesis and transformation in MCF-7 and T47-D breast cancer cells // J. Steroid Biochem. Mol. Biol. 2005. Vol. 93. № 1. P. 1–13.
14. 14. Chetrite G.S., Pasqualini J.R. Nomegestrol acetate is an anti-aromatase agent in human MCF-7aro breast cancer cells // Horm. Mol. Biol. Clin. Invest. 2010. Vol. 3. № 2. P. 417–424.
15. 15. Mueck A.O., Ruan X. Benefts and risks during HRT: main safety issue breast cancer // Horm. Mol. Biol. Clin. Invest. 2011. Vol. 5. № 2. P. 105–116.
Current methods of diagnosis of breast diseases
Ch.N. Mustafin
I.V. Kuznetsova
Russian Medical Academy of Postgraduate Education, Radiology Department, Mammology Course
I.M. Sechenov First Moscow State Medical University, Research and Educational Center of Women’s Health
Contact person: Chingis Nikolayevich Mustafin, chingis.x@gmail.com
The article addresses current approaches to the diagnosis of breast diseases in women. In such patients, thorough examination should include inspection, palpation, x-rays, ultrasound examination and radiothermometry. Interdependence between gynecologic disorders and breast diseases has been analyzed. Benign breast diseases should not be deemed as limiting the prescription of hormonal preparations containing sex steroids. In women with fibrocystic breast disease or those with increased risk of breast cancer, evidence-based effects of estrogens and progestogens on the breast should be taken into account during hormone therapy choice.
Новости на тему
26.08.2022 01:00:00
19.09.2013
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.