Взаимосвязь молекулярных подтипов метастатических подмышечных лимфатических узлов с радиоморфологическими параметрами у больных раком молочной железы, не получавших неоадъювантную химиотерапию
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – изучить взаимосвязь показателей УЗИ подмышечных лимфатических узлов и молекулярных подтипов у первичных больных РМЖ, которые не получали неоадъювантную ХТ.
Материал и методы. В исследование были включены 184 женщины с РМЖ в возрасте 24–75 лет (53,9 ± 0,8), которые проходили обследование и лечение в Онкологической клинике Азербайджанского медицинского университета в 2021–2022 гг. Из них 110 (59,8%) больных были первичными пациентами, не получавшими ХТ, а остальные 74 (40,2%) получили более четырех курсов неоадъювантной ХТ. УЗИ подмышечных лимфатических узлов оценивали на приборе LOGIQ C5-Premium (2012 г.). Молекулярные подтипы опухолей у больных определяли на основании иммуногистологического исследования опухолевой ткани, полученной методом биопсии.
Результаты. Не выявлено статистически значимой разницы между группами пациентов, получавших неоадъювантную ХТ, и пациентов, не получавших ее, в отношении наличия гормональных рецепторов (ER – p = 504; PR – p = 895), HER2 (p = 0,592) и подтипов РМЖ (p = 0,411). Однако индекс пролиферативной активности Ki-67 (Ki-67 < 14) первичной опухоли оказался статистически значимо ниже порогового уровня (р = 0,042) у больных, получавших неоадъювантную ХТ, по сравнению с пациентами, ее не получавшими (69,1% против 82,4%). Выявлена статистическая взаимосвязь между уровнем пролиферативной активности первичной опухоли (Ki-67 ≥ 14) и экспрессией HER2+. При подтипе «трижды негативный рак молочной железы» (ТНРМЖ) наблюдались овальные подмышечные лимфатические узлы с неравномерно утолщенным корковым слоем (< 3,0 мм), а при подтипе HER2+ подмышечные лимфатические узлы имели округленную форму с нарушенным нормальным строением коркового слоя.
Заключение. Проведенная неоадъювантная ХТ приводит к уменьшению метастазов подмышечных лимфатических узлов у больных РМЖ, в частности у больных с подтипом HER2+. Определение молекулярных подтипов по подмышечным лимфатическим узлам, а также радиоморфологических особенностей опухоли у больных РМЖ имеет большое практическое значение при принятии решения о лечении, когда не удается определить гормональные рецепторы.
Цель исследования – изучить взаимосвязь показателей УЗИ подмышечных лимфатических узлов и молекулярных подтипов у первичных больных РМЖ, которые не получали неоадъювантную ХТ.
Материал и методы. В исследование были включены 184 женщины с РМЖ в возрасте 24–75 лет (53,9 ± 0,8), которые проходили обследование и лечение в Онкологической клинике Азербайджанского медицинского университета в 2021–2022 гг. Из них 110 (59,8%) больных были первичными пациентами, не получавшими ХТ, а остальные 74 (40,2%) получили более четырех курсов неоадъювантной ХТ. УЗИ подмышечных лимфатических узлов оценивали на приборе LOGIQ C5-Premium (2012 г.). Молекулярные подтипы опухолей у больных определяли на основании иммуногистологического исследования опухолевой ткани, полученной методом биопсии.
Результаты. Не выявлено статистически значимой разницы между группами пациентов, получавших неоадъювантную ХТ, и пациентов, не получавших ее, в отношении наличия гормональных рецепторов (ER – p = 504; PR – p = 895), HER2 (p = 0,592) и подтипов РМЖ (p = 0,411). Однако индекс пролиферативной активности Ki-67 (Ki-67 < 14) первичной опухоли оказался статистически значимо ниже порогового уровня (р = 0,042) у больных, получавших неоадъювантную ХТ, по сравнению с пациентами, ее не получавшими (69,1% против 82,4%). Выявлена статистическая взаимосвязь между уровнем пролиферативной активности первичной опухоли (Ki-67 ≥ 14) и экспрессией HER2+. При подтипе «трижды негативный рак молочной железы» (ТНРМЖ) наблюдались овальные подмышечные лимфатические узлы с неравномерно утолщенным корковым слоем (< 3,0 мм), а при подтипе HER2+ подмышечные лимфатические узлы имели округленную форму с нарушенным нормальным строением коркового слоя.
Заключение. Проведенная неоадъювантная ХТ приводит к уменьшению метастазов подмышечных лимфатических узлов у больных РМЖ, в частности у больных с подтипом HER2+. Определение молекулярных подтипов по подмышечным лимфатическим узлам, а также радиоморфологических особенностей опухоли у больных РМЖ имеет большое практическое значение при принятии решения о лечении, когда не удается определить гормональные рецепторы.
Введение
Рак молочной железы (РМЖ) является одним из злокачественных онкологических заболеваний с высокой заболеваемостью и смертностью среди женщин. В большинстве случаев при ранней диагностике РМЖ осложняется метастазами в подмышечных (аксиллярных) лимфатических узлах [1]. Метастазы в подмышечных лимфатических узлах являются важным прогностическим фактором и имеют решающее значение в местном и системном комплексном лечении [2]. В настоящее время у больных РМЖ выполнение лимфодиссекции или биопсии «сторожевого» (сигнального) лимфатического узла является «золотым стандартом» для выявления метастазов в подмышечных лимфатических узлах [3].
Однако подобные хирургические вмешательства инвазивны и сопровождаются болью в верхних конечностях, гематомой, лимфедемой и инфекцией [4].
Ежегодно разрабатываются новые концепции с целью сокращения объемов хирургического лечения РМЖ. К ним относятся такие процедуры, как удаление подмышечных лимфатических узлов, в особенности биопсия «сторожевых» лимфатических узлов на ранней стадии. Новые диагностические критерии могут привести к уменьшению лимфодиссекции подмышечных лимфатических узлов и улучшению качества жизни пациентов. Для изучения морфологических особенностей подмышечных лимфатических узлов применяются радиологические методы исследования. Среди радиологических методов обследования больных РМЖ более широкое распространение получило ультразвуковое исследование (УЗИ), имеющее высокую чувствительность, информативность, являющееся малоинвазивным и безопасным методом, обладающее низкой ионизирующей радиационной нагрузкой и финансовой доступностью [5, 6].
G. Ferroni и соавт. определили, что УЗИ подмышечных лимфатических узлов имеет чувствительность 90% и специфичность 88%. Они отмечают, что подмышечные лимфатические узлы являются решающим прогностическим фактором отдаленных метастазов и риска рецидива [7].
L. Yang и соавт. в своем исследовании показали, что толщина коры лимфатического узла, соотношение поперечного и продольного сечения, стадия опухоли (Т) и высокая экспрессия Ki-67 являются важными предикторами метастазов в подмышечные лимфатические узлы [8].
И.В. Колядина и соавт. отмечают, что чувствительность УЗИ подмышечных лимфатических узлов напрямую зависит от молекулярных особенностей опухоли. Наименьшую чувствительность УЗИ подмышечных лимфатических узлов имеет люминальный/HER2- подтип (ниже 40%), максимальную чувствительность – трижды негативный рак молочной железы (ТНРМЖ) и ист. HER2+ (68–71%). УЗИ с вероятностью 25% не позволяет обнаружить метастатическое поражение подмышечных лимфатических узлов [9].
Q. Guo и соавт. при исследовании 653 пациентов с РМЖ обнаружили морфологические изменения в метастатических подмышечных лимфатических узлах. Это также снижает чувствительность УЗИ, поскольку увеличение и морфологические изменения подмышечных лимфатических узлов у больных с РМЖ не всегда связаны с метастазированием. Поэтому для улучшения диагностических показателей помимо УЗИ необходимо использовать и другие методы исследования [10].
Изучение связи радиоморфологических показателей подмышечных лимфатических узлов с молекулярными подтипами РМЖ позволит в будущем прогнозировать молекулярные подтипы заболевания без биопсии «сторожевого» лимфатического узла. Определение стадии и молекулярных подтипов РМЖ на основании радиоморфологических особенностей метастатических лимфатических узлов сократит объем оперативного вмешательства и имеет большое практическое значение при разработке протоколов химиотерапии (ХТ) [4].
Молекулярные подтипы РМЖ определяются на основе экспрессии стероидных рецепторов (рецепторов эстрогена-α и прогестерона) и рецепторов эпидермального фактора роста типа 2 (HER2, или HER2/neu, или ERBB2). Экспрессия Ki-67, рецепторы эстрогена (ER), рецепторы прогестерона (PR) и рецептор эпидермального фактора роста (HER2) являются важными маркерами, отражающими биологические характеристики опухолей молочной железы. В 2013 г. эксперты Международной комиссии Санкт-Галлена на основе иммуногистохимической оценки этих рецепторов выделили пять подтипов РМЖ: люминальный А (ER+ и/или PR+/-, HER2-, Ki67 < 14%), люминальный B/HER2- (ER+ или PR+/-, HER2-, Ki-67 ≥ 14%), люминальный B/HER2+ (ER+ или PR+/-, HER2+, любой Ki-67), HER2+ (HER2+, ER-, PR-, любой Ki-67) и ТНРМЖ (ER-, PR-, HER2-, любой Ki-67) [2, 11–13].
Выявлена тесная связь между молекулярными субъединицами РМЖ и радиоморфологическими показателями опухоли [3]. Однако взаимосвязь между радиоморфологическими характеристиками подмышечных лимфатических узлов и молекулярными подтипами РМЖ, а также прогностическое значение терапевтического ответа метастатических подмышечных лимфатических узлов на неоадъювантную ХТ у пациентов с РМЖ полностью не исследованы.
Цель исследования – изучить взаимосвязь показателей УЗИ подмышечных лимфатических узлов и молекулярных подтипов у первичных больных с РМЖ, которые не получали неоадъювантную ХТ.
Материал и методы
В исследование были включены 184 женщины с РМЖ в возрасте 24–75 лет (53,9 ± 0,8), проходившие обследование и лечение в Онкологической клинике Азербайджанского медицинского университета в 2021–2022 гг. 110 (59,8%) больных были первичными пациентами, не получавшими ХТ, а остальные 74 (40,2%) получили более четырех курсов неоадъювантной ХТ. Молекулярные подтипы опухолей у больных определяли на основании иммуногистологического исследования опухолевой ткани, полученной методом биопсии. Клетки с уровнями ER и PR ≥ 1% на поверхности опухоли считали ER+- и PR+-опухолями. Опухоли со значением от 0 до 2 баллов расценивались как гормонально негативные, от 3 до 8 баллов – как гормонально позитивные. Если результаты иммуногистохимического анализа на HER2 вызывали сомнения (HER2++), применяли метод амплификации гена HER2 с помощью метода флуоресцентной гибридизации in situ (FISH). HER2 считался положительным, когда ген HER2 был амплифицирован. Шкалу Оллреда использовали для интерпретации результатов иммуногистохимического анализа рецепторного статуса опухолей молочной железы. Индекс пролиферативной активности определялся как процент окрашенных клеточных ядер в опухолевой паренхиме. Ki-67 ≤ 14% считали низкой экспрессией, а Ki-67 ≥ 14% – высокой [14].
В исследование не включены больные с доброкачественными опухолями молочной железы, лимфаденопатиями различной этиологии.
По количеству ER-, PR- и HER2-рецепторов у 40 (21,7%) пациентов определили люминальный А, у 75 (40,8%) – люминальный B/HER2-, у 30 (16,3%) – люминальный B/HER2+, у 28 (15,2%) – ТНРМЖ и у 11 (6,0%) больных – HER2+-подтип.
УЗИ подмышечных лимфатических узлов оценивали на приборе LOGIQ C5-Premium (CE MEDICAL SYSTEMS; CHINA, 2012 г.). В зависимости от количества метастатических подмышечных лимфатических узлов различали группы с единичными (1–3) метастазами и множественными (> 4). С помощью УЗИ определяли размеры, форму, строение и наличие конгломератов подмышечных лимфатических узлов.
Статистический анализ
Все клинические и лабораторные показатели внесены в общую статистическую карту, путем осуществления требуемых отборов из статистической карты согласно заданным критериям созданы группы, и проверкой гипотезы «0» завершены статистические анализы. Количественные показатели из полученных вариационных рядов выражались средними и среднеструктурными показателями, а качественные показатели выражались долями. Разницы между средними показателями по группам и подгруппам оценены как в процентах, так и в разах. Для сравнения количественных показателей рядов использовали критерии: t (Стьюдента – Бонферрони), U (Манна – Уитни) и H (Краскела – Уоллиса). Дисперсионный анализ, проводимый по количественным показателям, осуществлялся с помощью теста ANOVA (критерия Ф (Фишера)). Для сравнения качественных показателей использовали χ2-критерий. Для оценки зависимости между количественными и качественными показателями использовали непараметрический метод ранговой корреляции р (Спирмена).
Результаты
Среди пациентов, не получавших неоадъювантную ХТ, у 87 (79,1%) пациентов выявлены ER+, у 68 (61,8%) – PR+, у 26 (23,6%) – HER2+-опухоли, у 76 (69,1%) – высокая пролиферативная активность Ki-67 (Ki-67 ≥ 14). У 30 (27,3%) пациентов, не получавших неоадъювантную ХТ, диагностирован люминальный А, у 37 (33,6%) – люминальный B/HER2-, у 20 (18,2%) – люминальный B/HER2+, у 17 (15,5%) – ТНРМЖ, у шести (5,5%) пациентов – HER2+.
Не выявлено статистически значимой разницы между группами, получавшими и не получавшими неоадъювантную ХТ по гормональным рецепторам (ER – p = 504; PR – p = 895), HER2 (p = 0,592) и подтипам (p = 0,411) РМЖ. Однако индекс пролиферативной активности Ki-67 (Ki-67 < 14) первичной опухоли оказался статистически значимо ниже порогового уровня (р = 0,042) у больных, получивших неоадъювантную ХТ, по сравнению с неполучавшими (69,1% против 82,4%). Лимфатические узлы овальной формы преимущественно наблюдались при люминальном А (n = 22; 55%) и ТНРМЖ (n = 17; 60,7%) подтипах. Лимфатические узлы с неровными и нечеткими контурами преимущественно регистрировались при подтипе ТНРМЖ (n = 4; 14,3%). Кроме того, подтип HER2+ (n = 9; 81,8%) имеет больше округленных лимфатических узлов, чем другие подтипы (р = 0,018).
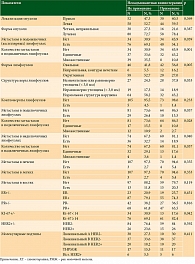
Среди 110 больных РМЖ, к которым не применялась неоадъювантная ХТ, локализация опухоли в молочной железе статистически не различалась с данными другой группы (р = 0,369) (табл.).
Среди больных РМЖ, не получавших неоадъювантную ХТ, у 30 (27,3%) наблюдались опухоли с четкими контурами и неправильной формы, у 80 (72,7%) – лучевые края. У 16 (21,6%) человек, получавших ХТ, контуры опухоли были четкими и неправильной формы, у 58 (78,4%) наблюдались лучевые края (р = 0,387).
У 116 (63,0%) из 184 больных РМЖ, включенных в исследование, выявлены метастазы в подмышечных лимфатических узлах. Среди этих пациентов у 23 (57,5%) выявлен люминальный A, у 47 (62,7%) – люминальный B/HER2-, у 20 (66,7%) – люминальный B/HER2+, у 16 (57,1%) – ТНРМЖ, а у 10 (90,9%) – HER2+. Как видно из результатов, метастазы в подмышечных лимфатических узлах преимущественно регистрировались при подтипе HER2+, а наименьшее количество метастазов выявлялось при подтипе ТНРМЖ, однако эти результаты не были статистически значимыми (р = 0,313). Метастазы в подмышечных лимфатических узлах среди больных, к которым не применялась ХТ, наблюдались у 76 пациентов (69,1%; р = 0,039) (n = 37; 33,6% – единичные, n = 39; 35,5% – множественные; р = 0,001), а в другой группе наблюдались у 40 (54,1%) больных (n = 32; 43,2% – единичные, n = 8; 10,8% – множественные). Кроме того, у 29 (26,4%; р = 0,037) больных, не получавших ХТ, были метастазы в подключичных лимфоузлах, у 36 (32,7%; р = 0,040) – в надключичных лимфатических узлах. У 10 (13,5%) больных, получавших неоадъювантную ХТ, были метастазы в подключичных лимфоузлах, а у 14 (18,9%) – в надключичных лимфатических узлах. Никакой значимой разницы по метастазам в легких (p = 0,353), печени (p = 0,355) и кости (p = 0,119) обнаружено не было.
У больных, не получавших ХТ, форма подмышечных лимфатических узлов была овальной у 46 (41,8%) человек, четкой, неправильной – у шести (5,5%), сферической – у 58 (52,7%). У больных, получающих неоадъювантную ХТ, овальная форма наблюдалась у 42 (56,8%), четкая, неправильная – у 12 (16,2%), округленная – у 20 (27,0%) (р = 0,005). У 27 (24,5%) больных, не получавших ХТ, корковый слой подмышечных лимфатических узлов незначительно или равномерно утолщен, у 19 (17,3%) – неравномерно утолщен, у 64 (58,2%) – нормальная структура коркового слоя была нарушена и трудно было отличить корковый от мозгового слоя. В группе, получавшей неоадъювантную ХТ, у 28 (37,8%) больных корковый слой подмышечных лимфатических узлов незначительно или равномерно утолщен, у 14 (18,9%) – неравномерно утолщен, у 32 (43,2%) – нормальное строение коркового слоя лимфатического узла нарушено (р = 0,033). У пяти (4,5%) пациентов, не получавших ХТ, а в другой группе у одного (1,4%) пациента в подмышечных лимфатических узлах обнаружены конгломераты (р = 0,233).
Во время исследования среди больных, не получавших неоадъювантную ХТ, наблюдалась корреляционная зависимость между радиоморфологическими характеристиками подмышечных лимфатических узлов и уровнем гормональных рецепторов. Результаты показали, что риск метастазирования в подмышечных лимфатических узлах (р = 0,450; р < 0,001), количество метастазов (р = 0,441; р < 0,001), форма подмышечных лимфатических узлов (р = 0,386; р < 0,001) и структура коркового слоя (р = 0,529; р < 0,001), а также количество метастазов в подключичных лимфатических узлах (р = 0,210; р = 0,030) напрямую зависят от размера опухоли. Установлена корреляционная зависимость между формой опухоли и риском метастазирования в подмышечные лимфатические узлы (р = 0,209; р = 0,029), формой (р = 0,215; р = 0,024) и структурой коркового слоя (р = 0,208; р = 0,029) подмышечных лимфатических узлов.
У больных с множественными метастазами в подмышечных лимфатических узлах метастатические лимфоузлы имеют округленную форму (р = 0,745; р < 0,001), утолщенную корковую структуру (р = 0,830; р < 0,001) и конгломераты (р = 0,386; р = 0,001). У таких больных наблюдались множественные метастазы как в подключичных (р = 0,400; р < 0,001), так и в надключичных (р = 0,215; р = 0,024) лимфатических узлах.
Установлена положительная корреляционная связь между формой метастатических подмышечных лимфатических узлов и строением коркового слоя (р = 0,810; р < 0,001), а также наличием конгломератов (р = 0,202; р = 0,034). Другими словами, округленные лимфатические узлы в основном имеют утолщенный корковый слой и образуют конгломераты. У больных с округленными подмышечными лимфатическими узлами наблюдались множественные метастазы в подключичных (р = 0,427; р < 0,001) и надключичных (р = 0,286; р = 0,002) лимфатических узлах.
Не выявлено корреляции между концентрацией ER+ и формой (р = -0,143; р = 0,135) и строением коркового слоя (р = -0,152; р = 0,113) метастатических подмышечных лимфатических узлов.
Аналогично не выявлено корреляции между концентрацией PR+ и формой (р = -0,112; р = 0,289) и структурой коркового слоя (р = -0,086; р = 0,371) метастатических подмышечных лимфатических узлов.
При высокой экспрессии Ki-67 выявлена положительная корреляция между размерами (р = 0,257; p = 0,007) и формой (р = 0,199; p =0,037) опухоли, а также между множественными метастазами (р = 0,246; p = 0,010), формой (р = 0,206; p = 0,031) и структурой коркового слоя (р = 0,200; p = 0,036) подмышечных лимфатических узлов. Как видно из результатов, контуры опухолей Ki-67 ≥ 14 – преимущественно с лучевыми краями, такие опухоли имеют высокий риск множественных метастазов в подмышечных и надключичных лимфатических узлах, у больных наиболее часто регистрировались подмышечные лимфатические узлы округленной формы и с утолщенным корковым слоем.
Не выявлено корреляции между концентрацией ER+ и формой (р = -0,143; р = 0,135) и строением (р = -0,152; р = 0,113) метастатических подмышечных лимфатических узлов.
Аналогично не выявлена корреляция между концентрацией PR+, формой (р = -0,112; р = 0,289) и корковой структурой (р = -0,086; р = 0,371) метастатических подмышечных лимфатических узлов.
Обсуждение
Как видно из полученных результатов, среди пациентов с РМЖ наиболее часто диагностируемыми подтипами в исследуемой группе стал люминальный подтип B/HER2-, а наименее распространенным – подтип HER2+. Высокий риск метастазирования в подмышечных лимфатических узлах зарегистрирован при подтипе HER2+, а самый низкий риск метастазирования — при подтипе ТНРМЖ. Кроме того, при люминальном подтипе B было выявлено больше метастазов в подмышечных лимфатических узлах, чем при люминальном подтипе A. Никакой существенной разницы между двумя группами в наличии отдаленных метастазов в надключичных и подключичных лимфатических узлах и других органах обнаружено не было.
Результаты нашего исследования согласуются с данными, полученными в ряде исследований. A.A. Hashmi и соавт. обнаружили в своем исследовании, что среди пациентов с РМЖ наиболее распространены люминальный B (40,6%) и ТНРМЖ (33,3%) подтипы, за которыми следуют люминальный A (15,8%), ист. HER2+ (10,3%) [15]. HER2+, высокий индекс Ki-67 (Ki-67 ≥ 14) и PR+-опухоли являются одними из важнейших факторов метастазирования в подмышечных лимфатических узлах [16].
S.K. Min и соавт., а также Z. Yang и соавт. обнаружили в своих исследованиях, что множественные метастазы в лимфатических узлах зависят от молекулярных подтипов, поэтому существует статистически значимая корреляция между молекулярными подтипами и метастазами в лимфатических узлах. Изменение радиоморфологических показателей подмышечных лимфатических узлов в зависимости от разных молекулярных подтипов является одним из основных факторов общей и безрецидивной выживаемости [17]. По сравнению с подтипом ТНРМЖ HER2+ имеет более высокую склонность к метастазированию в лимфатических узлах [18]. Люминальные типы имеют более высокую частоту метастазов в лимфатических узлах по сравнению с подтипами HER2 и TNBC [18, 19]. S.K. Min и соавт. показали, что подтипы люминальный A и ТНРМЖ имеют меньший риск метастазирования в подмышечных лимфатических узлах, чем люминальный B и HER2+ [18].
S.M. Yu и соавт. также показали, что пациенты с опухолями подтипа люминальный B имеют больше метастазов в подмышечных лимфатических узлах по сравнению с опухолями подтипа люминальный А [20].
Крупные опухоли неправильной формы с четко выраженным акустическим усилением задней стенки коррелируют с ТНРМЖ, тогда как микрокальцинаты и микрофолликулярные края являются предикторами опухолей, богатых HER2+. Следует отметить, что на УЗИ опухоли с ТНРМЖ часто можно визуально принять за доброкачественные опухоли, что связано прежде всего с наличием четко очерченных границ. В таких случаях размер опухоли можно считать важным предиктором ТНРМЖ [21].
Результаты исследования показали, что количество метастазов в подмышечных лимфатических узлах значительно снижается у пациентов, получающих неоадъювантную ХТ. По результатам корреляционного анализа в группе больных, не получавших неоадъювантную ХТ, крупные опухоли с лучевыми контурами имеют высокий риск метастазирования в подмышечных лимфатических узлах. У больных этой группы форма метастатических подмышечных лимфатических узлов преимущественно округленная, оболочка коры несколько утолщена (> 3,0 мм), нормальная структура коркового слоя нарушена и трудно отличить мозговой слой от коркового. У больных РМЖ с округленными подмышечными лимфатическими узлами наблюдаются множественные метастазы в подключичных и надключичных лимфатических узлах.
В группе больных, которые не получали ХТ, не обнаружено корреляции между формой и структурой коры метастатических подмышечных лимфатических узлов и концентрацией рецепторов эстрогена и прогестерона. Однако у пациентов с РМЖ с высокими концентрациями Ki-67 (Ki-67 ≥ 14) наблюдаются преобладание крупных опухолей с лучевыми контурами и высокий риск множественных метастазов в подмышечных и подключичных лимфатических узлах. В то же время при высокой концентрации Ki-67 (Ki-67 ≥ 14) преобладали подмышечные лимфатические узлы с округленными формами и нарушенным нормальным строением коры. Этот результат свидетельствует о чувствительности опухолей с Ki-67 ≥ 14 к ХТ. Форма подмышечных лимфатических узлов у пациентов, которые получали лечение неоадъювантной ХТ, преимущественно округленная, а корковый слой слегка или равномерно утолщен (< 3,0 мм).
При сравнении двух групп пациентов с РМЖ с HER2+-опухолями, получающих неоадъювантную ХТ, отмечается преобладание подмышечных лимфатических узлов с округленной формой и множественных метастазов в подключичных лимфатических узлах. Результат указывает на то, что подтип HER2+ имеет больший положительный ответ на ХТ, чем другие подтипы, и у этих пациентов значительно снижается количество патологических лимфатических узлов. A.A. Hashmi и соавт. также показали в своем исследовании, что ХТ при подтипах HER2+ и Ki-67 ≥ 14 дает положительные результаты по сравнению с другими подтипами [15].
Y.R. Chung и соавт. в исследовании, охватывавшем 563 пациента с РМЖ, показали регрессию подмышечных лимфатических узлов после неоадъювантной ХТ. Изменения радиоморфологических показателей подмышечных лимфатических узлов после ХТ имеют важное прогностическое значение в течении заболевания [22]. Таким образом, сохранение признаков метастазирования в лимфатические узлы после ХТ приводит к снижению выживаемости больных и высокому риску рецидива. В нашем исследовании наблюдались существенные изменения в форме и строении оболочек подмышечных лимфатических узлов после ХТ [22, 23].
N. Cho и H. Cui и соавт. обнаружили в своем исследовании, что при УЗИ микрокальцинаты, разветвленные или тонкие кальцификации, затвердевшие фиброзные ткани молочной железы и опухоли неправильной формы демонстрируют высокую экспрессию HER2+. У этих больных наблюдаются множественные метастазы в подмышечных лимфатических узлах. Подтип ТНРМЖ характеризуется четкими контурами и акустическим усилением задней стенки [24, 25].
Наши результаты показали положительную корреляцию между ER+ и PR+. При этом зафиксированы отрицательная корреляция между Ki-67, ER+ и PR+ и положительная корреляция с HER2+. S.H. Madani и соавт. в своем исследовании показали высокую корреляционную зависимость между высокой экспрессией Ki-67 и HER2+ [26].
Заключение
Таким образом, высокий риск метастазирования в подмышечных лимфатических узлах наблюдался у больных с подтипом HER2+, а самый низкий риск метастазирования – при подтипе ТНРМЖ. Корреляционные зависимости между показателями УЗИ метастатических подмышечных лимфатических узлов и молекулярно-биологическими показателями опухоли являются важными предикторами прогнозирования подтипов РМЖ в будущем. Нами обнаружена статистически значимая связь между выявлением метастазов в подмышечных лимфатических узлах и подтипом HER2+ у больных, получивших неоадъювантную ХТ. Согласно нашим данным, экспрессия рецепторов эстрогена и прогестерона не влияет на радиоморфологические показатели подмышечных лимфатических узлов. Выявлена статистическая взаимосвязь между уровнем пролиферативной активности первичной опухоли (Ki-67 ≥ 14) и экспрессией HER2+. При подтипе ТНРМЖ наблюдались овальные подмышечные лимфатические узлы с неравномерно утолщенным корковым слоем (< 3,0 мм), а при подтипе HER2+ подмышечные лимфатические узлы имели округленную форму с нарушенным нормальным строением коркового слоя. Определение молекулярных подтипов по подмышечным лимфатическим узлам, а также радиоморфологии опухоли у больных РМЖ имеет большое практическое значение при принятии решения о лечении, когда не удается определить гормональные рецепторы. Проведенная неоадъювантная ХТ приводит к уменьшению метастазов подмышечных лимфатических узлов у больных РМЖ, в частности при подтипе HER2+.
J.N. Akhundova
Oncology Clinic of Azerbaijan Medical University, Baku, Azerbaijan
Contact person: Jalala N. Akhundova, dr.celale@mail.ru
Background. In breast cancer (BC), ultrasonographic examination of axillary lymph nodes is a critical prognostic factor for distant metastases and for recurrence risks. Identification of BC molecular subtype using radiomorphological features of metastatic lymph nodes would lower the volume of surgical interventions and is very important for developing protocols for chemotherapy (CTx).
Purpose. To study the interrelation between ultrasound findings on axillary lymph nodes and molecular subtypes in primary breast cancer patients who did not have any neoadjuvant CTx.
Material and methods. 184 women with BC, aged 24–75 (53.9 ± 0.8), who were examined and treated at the Oncology Clinic of Azerbaijan Medical University in 2021–2022 were enrolled in the study. Of these, 110 (59.8%) were primary patients who did not have any chemotherapy, whereas the other 74 (40.2%) had more than four cycles of neoadjuvant chemotherapy. Device LOGIQ C5-Premium (2012) was used to assess findings of ultrasound examination of axillary lymph nodes. Immunohistological tests of bioptat tissue were used to identify molecular subtypes of malignant tissues taken from the patients.
Results. There was no statistically significant difference between the groups of patients who had neoadjuvant chemotherapy and those who did not have it in terms of hormone receptors (ER – p = 504; PR – p = 895), HER2 (p = 0.592), and breast cancer subtypes (p = 0.411). However, proliferative activity index Ki-67 (Ki-67 < 14) of the primary tumor was statistically significantly lower than threshold limits (p = 0.042) in patients who received neoadjuvant CTx than in patients who did not have it (69.1% versus 82.4%). Statistical correlation between primary tumor proliferative activity (Ki-67 ≥ 14) and HER2+ expression was noted. In TNBC subtype, oval axillary lymph nodes with irregularly thickened cortex (< 3.0 mm) were seen, while in HER2+ subtype, lymph nodes had rounded form with impaired cortical structure.
Conclusion. The performed neoadjuvant chemotherapy reduces axillary lymph node metastases in breast cancer patients, particularly in those with HER2+ subtype. If hormonal receptors cannot be defined, molecular subtypes identified with axillary lymph nodes and tumor radiomorphologic features in breast cancer patients are of a large practical importance for management decision in patients with BC.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.