Результаты массового скрининга и клинико-параклиническая характеристика пациентов с транстиретиновой семейной амилоидной полинейропатией
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – проанализировать случаи ТТР-САП, выявленные в ФГБНУ «Научный центр неврологии» в период 2018–2025 гг.
Материал и методы. С 2018 по 2025 г. в ФГБНУ «Научный центр неврологии» проведен скрининг на ТТР-САП 750 пациентам с хронической полинейропатией неуточненного генеза с применением алгоритма отбора по ключевым диагнозам в комбинации с «красными флажками». У пациентов с верифицированным диагнозом ТТР-САП проанализированы клинические, инструментальные и лабораторные характеристики.
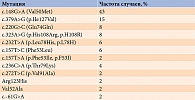
Результаты. Мутация в гене TTR была выявлена у 35 (5%) больных: у 21 (60%) мужчины и 14 (40%) женщин. Дополнительное молекулярно-генетическое обследование 24 родственников пациентов позволило выявить 13 бессимптомных носителей мутантного гена. Наиболее частой оказалась мутация c.148G>A (Val50Met) – 20 (43%) случаев.
Средний возраст пациентов составил 52 года (минимум – 23 года, максимум – 81 год). Среднее время от начала болезни до установления диагноза – 2,8 года. У всех пациентов (35 (100%)) обнаружены полиневритические нарушения в сочетании с симптомами поражения желудочно-кишечного тракта (22 (63%)) и сердечно-сосудистой системы (12 (34%)). У 11 (31%) пациентов взят анализ крови на NT-proBNP. Повышенный уровень (более 125 пг/мл) выявлен у 6 (55%) пациентов. При проведении электронейромиографии периферических нервов у 31 (89%) пациента с ТТР-САП обнаружены нейрофизиологические признаки генерализованного симметричного сенсомоторного неврального поражения. В 27 (87%) случаях из 31 (89%) выявлен аксональный характер поражения периферических нервов, в 4 (13%) случаях – демиелинизирущий. При проведении ультразвукового исследования периферических нервов по протоколу Ultrasound Pattern Sum Score 9 (26%) пациентам у 3 (33%) из них суммарный балл составил девять и более, что соответствует изменениям, характерным для хронической воспалительной демиелинизирующей полирадикулонейропатии. У 6 (67%) больных изменения были мягкими или вовсе отсутствовали. Из 7 (20%) пациентов с ТТР-САП, которым было проведено морфологическое исследование икроножного нерва и подкожно-жировой клетчатки, только у 4 (57%) отмечены морфологические признаки амилоидоза.
Заключение. В эпоху совершенствования таргетной патогенетической терапии ТТР-САП актуальность своевременного выявления заболевания чрезвычайно высока. При наличии «красных флажков» у пациентов с прогрессирующей хронической полинейропатией проведение молекулярно-генетического скрининга на ТТР-САП позволяет подтвердить диагноз. У большинства страдающих ТТР-САП имеет место поздний дебют. Признаки полинейропатии сочетаются с желудочно-кишечными, сердечно-сосудистыми симптомами и непреднамеренной потерей массы тела. Электронейромиография подтверждает характер поражения периферических нервов, чаще всего первично аксональный. Ультразвуковое исследование периферических нервов и биопсия икроножного нерва более чем в трети случаев не дают полезной для диагностики ТТР-САП информации.
Цель исследования – проанализировать случаи ТТР-САП, выявленные в ФГБНУ «Научный центр неврологии» в период 2018–2025 гг.
Материал и методы. С 2018 по 2025 г. в ФГБНУ «Научный центр неврологии» проведен скрининг на ТТР-САП 750 пациентам с хронической полинейропатией неуточненного генеза с применением алгоритма отбора по ключевым диагнозам в комбинации с «красными флажками». У пациентов с верифицированным диагнозом ТТР-САП проанализированы клинические, инструментальные и лабораторные характеристики.
Результаты. Мутация в гене TTR была выявлена у 35 (5%) больных: у 21 (60%) мужчины и 14 (40%) женщин. Дополнительное молекулярно-генетическое обследование 24 родственников пациентов позволило выявить 13 бессимптомных носителей мутантного гена. Наиболее частой оказалась мутация c.148G>A (Val50Met) – 20 (43%) случаев.
Средний возраст пациентов составил 52 года (минимум – 23 года, максимум – 81 год). Среднее время от начала болезни до установления диагноза – 2,8 года. У всех пациентов (35 (100%)) обнаружены полиневритические нарушения в сочетании с симптомами поражения желудочно-кишечного тракта (22 (63%)) и сердечно-сосудистой системы (12 (34%)). У 11 (31%) пациентов взят анализ крови на NT-proBNP. Повышенный уровень (более 125 пг/мл) выявлен у 6 (55%) пациентов. При проведении электронейромиографии периферических нервов у 31 (89%) пациента с ТТР-САП обнаружены нейрофизиологические признаки генерализованного симметричного сенсомоторного неврального поражения. В 27 (87%) случаях из 31 (89%) выявлен аксональный характер поражения периферических нервов, в 4 (13%) случаях – демиелинизирущий. При проведении ультразвукового исследования периферических нервов по протоколу Ultrasound Pattern Sum Score 9 (26%) пациентам у 3 (33%) из них суммарный балл составил девять и более, что соответствует изменениям, характерным для хронической воспалительной демиелинизирующей полирадикулонейропатии. У 6 (67%) больных изменения были мягкими или вовсе отсутствовали. Из 7 (20%) пациентов с ТТР-САП, которым было проведено морфологическое исследование икроножного нерва и подкожно-жировой клетчатки, только у 4 (57%) отмечены морфологические признаки амилоидоза.
Заключение. В эпоху совершенствования таргетной патогенетической терапии ТТР-САП актуальность своевременного выявления заболевания чрезвычайно высока. При наличии «красных флажков» у пациентов с прогрессирующей хронической полинейропатией проведение молекулярно-генетического скрининга на ТТР-САП позволяет подтвердить диагноз. У большинства страдающих ТТР-САП имеет место поздний дебют. Признаки полинейропатии сочетаются с желудочно-кишечными, сердечно-сосудистыми симптомами и непреднамеренной потерей массы тела. Электронейромиография подтверждает характер поражения периферических нервов, чаще всего первично аксональный. Ультразвуковое исследование периферических нервов и биопсия икроножного нерва более чем в трети случаев не дают полезной для диагностики ТТР-САП информации.
Введение
Транстиретиновая семейная амилоидная полинейропатия (ТТР-САП) – редкое, тяжелое, неуклонно прогрессирующее мультисистемное аутосомно-доминантное наследственное заболевание, обусловленное мутацией в гене транстиретина (TTR), приводящей к дестабилизации тетрамерной структуры белка TTR [1]. Клинические проявления заболевания связаны с внеклеточным отложением патологических амилоидных фибрилл в различных органах и тканях, при этом чаще в периферических нервах (ТТР-САП), сердце (транстиретиновая кардиомиопатия), а также в желудочно-кишечном тракте, почках, глазах, реже – в оболочках головного мозга (лептоменингеальный амилоидоз) [2, 3]. Эндемичными странами для данного заболевания считаются Португалия, Швеция и Япония [4, 5]. Однако во всем мире наблюдается рост числа выявленных случаев, нередко возникающих у взрослых и носящих спорадический характер, что, вероятно, связано с лучшей осведомленностью о ТТР-САП и более широким использованием генетического тестирования [6].
Несколько десятилетий назад ТТР-САП считалась неизлечимым фатальным заболеванием. Однако в настоящее время разработана эффективная патогенетическая терапия ТТР-САП, в связи с чем актуальным становится ее выявление на ранней стадии [7, 8].
Цель исследования
Целью настоящего исследования стал анализ случаев ТТР-САП, выявленных в ФГБНУ «Научный центр неврологии» в период с 2018 по 2025 г.
Материал и методы
С 2018 по 2025 г. в ФГБНУ «Научный центр неврологии» проводился молекулярно-генетический скрининг на мутации гена TTR 750 пациентам с хронической полинейропатией (ПНП) неуточненного генеза.
Критерии отбора на скрининг (критерии включения):
- хроническая прогрессирующая сенсорная, сенсомоторная или сенсовегетативная аксональная ПНП неуточненного генеза;
- тонковолоконная болевая ПНП неуточненного генеза;
- рефрактерная к патогенетической терапии первой линии хроническая воспалительная демиелинизирующая полирадикулонейропатия (ХВДП);
- хроническая ПНП неуточненного генеза с сопутствующим карпальным туннельным синдромом.
Кроме того, применялась система «красных флажков», рекомендованная международным сообществом для отбора пациентов на генетический скрининг на ТТР-САП. В дополнение к вышеописанным диагнозам учитывалось наличие желудочно-кишечных расстройств (запоры, диарея или их сочетание), сердечно-сосудистых нарушений (блокада внутрисердечной проводимости, мерцательная аритмия нормосистолической формы, хроническая сердечная недостаточность с сохраненной фракцией выброса, кардиомиопатия, ортостатическая гипотензия, липотимия), карпального туннельного синдрома, наследственного анамнеза в отношении амилоидоза, сердечной недостаточности, полинейропатии [2].
Молекулярно-генетический скрининг проводился с использованием метода «сухого пятна» (секвенирование по методу F. Sanger). Анализ осуществляли сотрудники ФГБНУ «Медико-генетический научный центр им. академика Н.П. Бочкова».
Молекулярно-генетический скрининг также проводился родственникам пациентов с подтвержденной ТТР-САП.
В отношении всех пациентов с ТТР-САП выполнены сбор и анализ жалоб, а также данных анамнеза жизни и заболевания, общий и неврологический осмотр с оценкой силы мышц конечностей по Medical Research Council sum score (MRCss), электронейромиография (ЭНМГ) с исследованием проводящей функции длинных нервов конечностей и общепринятых параметров. Некоторым пациентам (8 (23%)) проводилось ультразвуковое исследование периферических нервов по протоколу Ultrasound Pattern Sum Score (UPSS), согласно которому оценивалась площадь поперечного сечения нервов и интраневральные изменения по классификации L. Pauda в 12 точках исследования с одной стороны [9]. Стадия ТТР-САП определялась по шкале транстиретиновой семейной амилоидной полинейропатии (Stages of Familial Amyloid Polyneuropathy for Locomotion) [10].
Отдельным пациентам (7 (20%)) было проведено морфологическое исследование икроножного нерва, 3 (43%) из них также было проведено морфологическое исследование подкожно-жировой клетчатки околопупочной области.
В ходе обследования были исключены иные причины ПНП (критерии невключения):
- хронические дизиммунные нейропатии;
- хронические соматические заболевания;
- алкоголизм;
- дефицит витаминов группы В;
- прием токсичных лекарственных препаратов.
Результаты
Из 750 пациентов, которые соответствовали критериям включения и которым был проведен молекулярно-генетический скрининг, мутация в гене TTR была выявлена у 35 (5%): у 21 (60%) мужчины и 14 (40%) женщин. Средний возраст больных составил 52 года (минимум – 23 года, максимум – 81 год).
Дополнительное целенаправленное молекулярно-генетическое обследование 24 ближайших прямых родственников пациентов позволило выявить 13 носителей мутаций в гене TTR, у которых отсутствовали клинические признаки заболевания (бессимптомные носители мутантного гена). Наиболее частой мутацией гена TTR, выявленной у пациентов и их родственников, оказалась мутация c.148G>A (Val50Met) – 20 (43%) случаев (таблица).
На основании результатов молекулярно-генетического обследования на базе ФГБНУ «Научный центр неврологии» была сформирована база данных пациентов с ТТР-САП, в которую вошли носители мутаций гена TTR (n = 48), как симптомные (n = 35), так и бессимптомные (n = 13). У пациентов с клиническими проявлениями заболевания (n = 35) проанализированы клинико-параклинические данные.
Характеристика анамнестических данных
В анализируемой выборке (n = 35) среднее время от начала заболевания до установления диагноза составило 2,8 года, в то время как среднее время от обращения в ФГБНУ «Научный центр неврологии» до установления окончательного диагноза при высокой настороженности в отношении заболевания в среднем составило три месяца. Ретроспективный анализ анамнестических данных показал, что в дебюте болезни у всех пациентов первыми симптомами были сенсорные полиневритические нарушения – онемение и парестезии в кистях и стопах.
Направительными диагнозами, с которыми пациенты с ТТР-САП обращались в ФГБНУ «Научный центр неврологии», были ПНП неясного генеза или идиопатическая ПНП (25 (71%) больных), ХВДП (5 (14%)), радикулопатия (2 (6%)), нейродегенеративное заболевание нервной системы (2 (6%)) и болезнь двигательного нейрона (1 (3%)).
Характеристика жалоб, результаты общего и неврологического осмотра
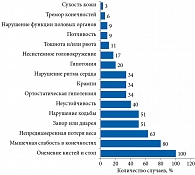
На момент обращения в ФГБНУ «Научный центр неврологии» основными жалобами были онемение кистей и стоп (35 (100%) пациентов), мышечная слабость в конечностях (28 (80%)), непреднамеренное снижение веса (22 (63%)), запор или диарея (18 (51%)) и нарушение ходьбы (18 (51%)) (рисунок).
Медиана, а также верхний и нижний квартили (Q1; Q4) индекса массы тела пациентов составили 21,15 кг/м2 [28,4; 17,4].
При неврологическом осмотре у включенных в исследование пациентов обнаружены полиневритические нарушения разной степени выраженности. Медиана, а также верхний и нижний квартили (Q1; Q4) мышечной силы, оцениваемой по MRCss, в проксимальных отделах рук составили 3,75 [4,00; 3,50] балла, в дистальных отделах рук (кистях) – 3,5 [4,0; 2,0] балла, в проксимальных отделах ног – 3,5 [4,0; 3,0] балла, в дистальных отделах ног (стопах) – 2,0 [4,0; 0,0] балла.
Первой и второй стадиям ТТР-САП соответствовали по 14 пациентов, третьей стадии – 7.
Характеристика системных общесоматических нарушений
Патология желудочно-кишечного тракта встречалась более чем в половине (22 (63%)) случаев, вызывая непреднамеренную потерю веса (22 (63%)), диарею и запоры (18 (51%)), тошноту и рвоту (4 (11%)). Дополнительное общесоматическое обследование показало, что следующим по частоте системным проявлением болезни была патология сердечно-сосудистой системы (12 (34%) случаев), которая включала нарушение ритма сердца (6 (17%)), кардиомиопатию (толщина межжелудочковой перегородки/задней стенки левого желудочка > 11 мм) (5 (14%)), тахикардию (4 (11%)) и блокаду проводящей системы сердца (2 (6%)). Радиочастотная катетерная абляция по поводу пароксизмальной формы фибрилляции предсердий в анамнезе заболевания была проведена 2 (6%) пациентам.
Реже у больных ТТР-САП выявлялось помутнение стекловидного тела и снижение зрения (5 (14%)), а также патология почек (4 (11%)), которая включала микропротеинурию до 0,06 г/л (2 (6%)) и хроническую болезнь почек (4 (11%)).
Анализ результатов лабораторного и инструментального обследования
У 11 (31%) пациентов был взят анализ крови на мозговой натрийуретический гормон (NT-proBNP). Повышенный уровень NT-proBNP (более 125 пг/мл) был выявлен у 6 (55%) пациентов. Уровень тропонина определен у 4 (11%) пациентов, и лишь у 1 (25%) из них отмечалось его повышение до 42 нг/мл.
До обращения в ФГБНУ «Научный центр неврологии» 4 (11%) пациентам была проведена люмбальная пункция с последующим общим анализом ликвора. В 2 (50%) случаях выявлено повышение уровня белка более 0,45 г/л.
При проведении ЭНМГ периферических нервов у 31 (89%) пациента с ТТР-САП регистрировались нейрофизиологические признаки генерализованного симметричного сенсомоторного неврального поражения, более выраженного в нижних конечностях. В подавляющем большинстве (27 (87%)) случаев установлен аксональный характер неврального поражения, в меньшем количестве (4 (13%) случаев – демиелинизирущий характер неврального поражения.
Реже (8 (23%)) при ЭНМГ периферических нервов отмечались нейрофизиологические признаки компрессионных мононейропатий. Так, локальное нарушение проведения возбуждения по срединному нерву на уровне карпального канала обнаружено у 8 (23%) пациентов, сочетание нарушения проведения возбуждения по срединному и локтевому нервам на уровне туннелей (карпальный и кубитальный каналы соответственно) – у 3 (8,5%).
Сочетание нейрофизиологических признаков генерализованного полиневритического поражения с локальным нарушением проведения возбуждения по срединному нерву на уровне карпального канала выявлено у 4 (11%) пациентов.
Ультразвуковое исследование периферических нервов, выполненное по протоколу UPSS, проведено 9 из 35 пациентов с ТТР-САП. У 3 (33%) из них суммарный балл составил девять и более, что соответствует изменениям, характерным для ХВДП. У 6 (67%) пациентов изменения были мягкими или вовсе отсутствовали. Медиана, а также верхний и нижний квартили (Q1; Q4) по протоколу UPSS составили 4 [11; 0] балла.
Из 7 (20%) пациентов с ТТР-САП, которым было проведено морфологическое исследование икроножного нерва и подкожно-жировой клетчатки, только у 4 (57%) выявлены морфологические признаки амилоидоза.
Обсуждение
При проведении молекулярно-генетического скрининга 750 российским пациентам с применением алгоритма поиска по ключевым диагнозам и наличию дополнительных «красных флажков» диагноз ТТР-САП был подтвержден у 35 (5%). Данные зарубежных коллег по выявляемости ТТР-САП варьируются. Так, в исследовании G. Fargeot и соавт. (2024 г.), в котором приняли участие 553 пациента, патогенные мутации гена TTR были обнаружены у 15 (2,7%) [11]. В исследовании V. Di Stefano и соавт. (2023 г.) из 145 пациентов заболевание подтвердилось у 10% [12].
На основании результатов молекулярно-генетического обследования, проведенного на базе ФГБНУ «Научный центр неврологии», была сформирована база данных симптомных (n = 35) и бессимптомных (n = 13) носителей мутаций гена TTR. Такой подход важен для комплексного анализа пациентов с редкими (орфанными) болезнями, а также для сравнения данных по России с данными в других странах. Например, в Бразилии собрана когорта с рассматриваемым заболеванием, которая включает 108 пациентов [13]. Самым крупным считается исследование THAOS, которое включило более 6000 пациентов с транстиретиновым амилоидозом и объединило пациентов с ТТР-САП, транстиретиновой амилоидной кардиомиопатией, а также с диким типом транстиретинового амилоидоза [14].
При клиническом обследовании нашей выборки выявлены нарушения, соответствующие классическому портрету заболевания [15, 16]. Следует отметить, что вегетативные нарушения, сопутствующие ПНП, обнаружены в 34% случаев, непреднамеренное снижение веса – в 63%, признаки системности – в 30% случаев, что было сопоставимо с данными литературы. Наиболее частыми экстраневральными нарушениями оказались желудочно-кишечные расстройства (63%) и сердечно-сосудистая патология (34%), что также соответствует данным литературы [12].
Несмотря на то что поражение глаз выявляется у большинства пациентов с ТТР-САП (синдром сухого глаза – у 70%, заболевания зрачков в виде зубчатой радужной оболочки – у 28%, глаукома – у 20%, помутнение стекловидного тела – у 17%, аномальные сосуды конъюнктивы – у 14%) [17], в нашей когорте поражение глаз было отмечено лишь у 14%. Подобная картина наблюдалась и при анализе частоты встречаемости патологии почек. Так, патология почек верифицируется примерно у 30% пациентов [17]. В нашей выборке вовлечение почек в патологический процесс было зафиксировано лишь в 11% случаев.
Особого внимания заслуживают результаты нейрофизиологического обследования периферических нервов. В 4 (13%) случаях из 31 при проведении ЭНМГ обнаружен демиелинизирующий характер генерализованного неврального поражения и разная степень соответствия электродиагностическим критериям ХВДП, что в ряде случаев привело к неверной постановке диагноза. Полученные нами данные сопоставимы с данными литературы, согласно которым демиелинизирующий характер поражения нервов регистрировался у 15% пациентов с ТТР-САП [18].
Установлено, что при сонографическом исследовании периферических нервов у 18% пациентов с ТТР-САП имело место увеличение поперечного сечения стволов периферических нервов [19]. Мы провели ультразвуковое исследование периферических нервов по протоколу, предназначенному для диагностики и дифференциальной диагностики ХВДП. В нашей выборке в 3 (33%) случаях суммарный балл составил девять и более, что соответствует изменениям, характерным для ХВДП. В 6 (67%) случаях изменения были мягкими или вовсе отсутствовали.
Медиана, а также верхний и нижний квартили (Q1; Q4) по протоколу UPSS составили 4 [11; 0] балла.
Известно, что морфологическое исследование позволяет подтвердить диагноз ТТР-САП в 86% случаев. Однако неравномерное распределение отложений амилоида может ограничивать диагностическую ценность данного метода, потенциально требуя повторных биопсий нервов или других пораженных органов [2]. В нашей выборке 7 (20%) пациентам с ТТР-САП было проведено морфологическое исследование икроножного нерва, которое выявило характерные изменения лишь у 4 (57%) пациентов.
Заключение
В эпоху совершенствования таргетной патогенетической терапии ТТР-САП актуальность своевременного выявления заболевания чрезвычайно высока. При наличии «красных флажков» у пациентов с прогрессирующей хронической полинейропатией проведение молекулярно-генетического скрининга на ТТР-САП позволяет подтвердить диагноз. Описаны клинические и параклинические характеристики 35 симптомных носителей патогенных мутаций в гене транстиретина. Инструментальные методы имеют ограничения для первичной диагностики ТТР-САП ввиду неспецифичности получаемых результатов или ложноотрицательных ответов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование проводилось без спонсорской поддержки.
Информированное согласие. Пациенты подписали информированное согласие на участие в исследовании.
N.A. Suponeva, Corresponding member of the RASci, MD, PhD, Prof., D.A. Grishina, MD, PhD, M.S. Kazieva
FSBSI ‘Research Center of Neurology’
Contact person: Maria S. Kazieva, maria.kazieva555@gmail.com
Hereditary transthyretin familial amyloid polyneuropathy (TTR-FAP) is a rare, severe, steadily progressive, multisystem disease, in which the peripheral and autonomic nervous systems are most often affected. Given the availability of developed pathogenetic therapy, early detection of the pathology is extremely important.
Study objective – to analyze cases of TTR-FAP identified at the Research Center of Neurology in the period 2018–2025.
Material and methods. From 2018 to 2025, the Research Center of Neurology screened 750 patients with chronic polyneuropathy of unspecified genesis for TTR-FAP using a selection algorithm based on key diagnoses in combination with ‘red flags’. In patients with a verified diagnosis of TTR-FAP, clinical, instrumental and laboratory characteristics were analyzed.
Results. Mutation in the TTR gene was detected in 35 patients (5%): 21 (60%) men and 14 (40%) women. Additional molecular genetic testing of 24 relatives of patients revealed 13 asymptomatic carriers of the mutant gene. The most common mutation was c.148G>A (Val50Met) – 20 (43%) cases. The average age of patients was 52 years (minimum – 23 years, maximum – 81 years). The average time from the onset of the disease to diagnosis was 2.8 years. All patients (35 (100%)) were found to have polyneuritic disorders in combination with symptoms of gastrointestinal tract (22 (63%)) and cardiovascular system (12 (34%)) damage. Blood tests for NT-proBNP were taken from 11 (31%) patients. Elevated levels (over 125 pg/ml) were detected in 6 (55%) patients. Electroneuromyography of peripheral nerves revealed neurophysiological signs of generalized symmetric damage to sensory and motor nerves in 31 (89%) patients with TTR-FAP. Axonal damage to peripheral nerves was detected in 27 (87%) of 31 (89%) cases, and demyelinating damage was detected in 4 (13%) cases. Nerve ultrasound of peripheral nerves in 9 (26%) patients using the Ultrasound Pattern Sum Score protocol revealed a total score of nine or more in 3 (33%) patients, which corresponds to changes characteristic of chronic inflammatory demyelinating polyradiculoneuropathy. Changes were mild or absent in 6 (67%) patients. Of the 7 (20%) patients with TTR-FAP who underwent morphological examination of the sural nerve and subcutaneous fat, only 4 (57%) showed morphological signs of amyloidosis.
Conclusion. In the era of improving targeted pathogenetic therapy for TTR-FAP, the relevance of timely detection of the disease is extremely high. In the presence of ‘red flags’ in patients with progressive chronic polyneuropathy, molecular genetic screening for TTR-FAP allows confirming the diagnosis. Most patients with TTR-FAP have a late onset. Signs of polyneuropathy are combined with gastrointestinal, cardiovascular symptoms and unintentional weight loss. Electroneuromyography confirms the nature of the lesion of the peripheral nerves, most often primarily axonal. Ultrasound examination of the peripheral nerves and biopsy of the sural nerve in more than a third of cases do not provide information useful for diagnosing TTR-FAP.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.