количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Теория
Современная гормональная контрацепция: эволюция и тромбофилические риски
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" № 4 (45)
- Аннотация
- Статья
- Ссылки
- English
В статье изложены данные литературы об эволюции гормональной контрацепции, видах и составе современных гормональных препаратов, описаны их режимы и пути введения, данные о безопасности и особенностях влияния приема контрацептивов на здоровье женщины, приведена сравнительная характеристика влияния синтетических гестагенов и эстрогенов на риск развития тромбофилических осложнений.
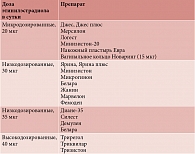
Таблица 1. Классификация комбинированных гормональных контрацептивов в зависимости от дозы этинилэстрадиола
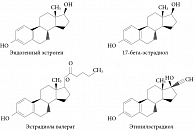
Рис. 1. Химическая структура синтетических эстрогенов, входящих в состав гормональных контрацептивов

Таблица 2. Классификация прогестагенов, входящих в состав гормональных контрацептивов
![Таблица 3. Биологические эффекты прогестагенов [20]](/upload/resize_cache/iblock/662/195_350_1/662fd1967661b03d554202af117eb9d8.jpg)
Таблица 3. Биологические эффекты прогестагенов [20]
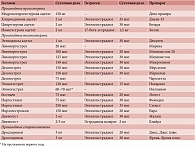
Таблица 4. Состав оригинальных гормональных контрацептивов, зарегистрированных в России

Таблица 5. Пролонгированные гормональные контрацептивы, зарегистрированные в России
![Таблица 6. Сравнительная эффективность различных методов контрацепции [28]](/upload/resize_cache/iblock/957/195_350_1/9578ec1bf093cfcd7e1916e1f994e43d.jpg)
Таблица 6. Сравнительная эффективность различных методов контрацепции [28]
![Рис. 2. Частота развития венозных тромбозов при применении различных методов гормональной контрацепции (количество случаев на 10 тыс. женщин в год) [35, 46, 48–50, 54, 62]](/upload/resize_cache/iblock/848/195_350_1/8482921156d71a23a80d75c238de472a.jpg)
Рис. 2. Частота развития венозных тромбозов при применении различных методов гормональной контрацепции (количество случаев на 10 тыс. женщин в год) [35, 46, 48–50, 54, 62]
![Рис. 3. Частота развития венозных тромбозов у женщин репродуктивного возраста (количество случаев на 10 тыс. женщин в год) [6, 8, 44, 52]](/upload/resize_cache/iblock/f6c/195_350_1/f6c6f38eb8ce169a148578aa9cb01750.jpg)
Рис. 3. Частота развития венозных тромбозов у женщин репродуктивного возраста (количество случаев на 10 тыс. женщин в год) [6, 8, 44, 52]

Таблица 7. Положительные эффекты применения гормональных контрацептивов
Эволюция гормональной контрацепции
На сегодняшний день гормональные контрацептивы, содержащие синтетические аналоги половых стероидов, во всем мире считаются самым эффективным и популярным методом предохранения от нежелательной беременности.
История развития гормональной контрацепции начинается в 1950-х гг. с создания препаратов, содержащих синтетические аналоги гестагенов [1]. Их контрацептивные возможности были открыты при использовании у животных норэтинодрела. Норэтинодрел (первое производное тестостерона) вызывал стойкое подавление овуляции за счет угнетения секреции гормонов гипоталамо-гипофизарно-яичниковой системы, что предупреждало наступление беременности [2]. В дальнейшем было установлено, что добавление к прогестагену синтетического эстрогена потенцирует его антигонадотропное действие и улучшает регуляцию менструального цикла [3].
По сравнению с современными препаратами первые гормональные контрацептивы содержали значительно более высокие дозы синтетических стероидов. В этой связи их прием у многих женщин сопровождался побочными эффектами: чаще всего тошнотой, головной болью, депрессией, болезненностью молочных желез, прибавкой массы тела и появлением акне. Кроме того, среди женщин, использующих гормональные контрацептивы, выросла частота артериальных и венозных тромбозов [4, 5].
За 50 лет произошла значительная эволюция гормональной контрацепции: появились низко- и микродозированные препараты, созданы препараты с компонентами, максимально приближенными к эндогенным гормонам, разработаны новые режимы и пути введения контрацептивов. Все это привело к значительному уменьшению частоты нежелательных эффектов и существенно повысило коплаентность использования гормональной контрацепции [1, 4, 6]. Результаты масштабных эпидемиологических исследований доказали, что современные низкодозированные гормональные контрацептивы не оказывают клинически значимого неблагоприятного воздействия на параметры гомеостаза и являются безопасным методом предохранения от нежелательной беременности у здоровых некурящих женщин моложе 40 лет [6–9].
Механизм действия гормональных контрацептивов заключается в подавлении функции гипоталамо-гипофизарно-яичниковой системы. Под влиянием синтетических стероидов в течение менструального цикла предотвращаются пиковые колебания концентрации эндогенных гормонов: гонадотропин-рилизинг гормона, фолликулостимулирующего, лютеинизирующего гормона, прогестерона и эстрадиола. В результате блокируется созревание яйцеклетки в яичнике, подавляется рост доминантного фолликула и последующая овуляция. Кроме того, отсутствуют циклические изменения эндометрия: пролиферация, секреторная трансформация и отторжение. Его толщина остается относительно постоянной на протяжении всего периода использования контрацептивов.
Эстрогенный и гестагенный компоненты в составе гормональных контрацептивов выполняют разные функции. Так, прогестагенный компонент обеспечивает непосредственную защиту от нежелательной беременности. Связываясь в матке с прогестероновыми рецепторами, он по механизму отрицательной обратной связи подавляет секрецию лютеинизирующего гормона в передней доле гипофиза и предотвращает овуляцию. Прогестагены обладают также дополнительными контрацептивными свойствами: повышают вязкость цервикальной слизи, препятствуя транспорту спермы, и вызывают атрофические изменения эндометрия, обеспечивая защиту от имплантации.
Эстрогенный компонент потенцирует контрацептивный эффект прогестагена. Взаимодействуя с эстрогеновыми рецепторами в матке, также по механизму обратной связи он блокирует выброс фолликулостимулирующего гормона из передней доли гипофиза и предотвращает развитие доминантного фолликула. Однако основная функция эстрогеновой составляющей заключается в стабилизации эндометрия и обеспечении контроля менструального цикла [10].
Необходимо отметить: гормональные контрацептивы не приводят к полному блокированию функции гипоталамо-гипофизарно-яичниковой системы и потому не вызывают симптомы эстрогендефицита. Их применение оказывает стабилизирующее влияние на синтез эндогенных гормонов в течение менструального цикла, пиковые колебания которых могут являться триггерами развития гиперпластических процессов эндометрия, эндометриоидных и фиброматозных гетеропий. Кроме того, предотвращая овуляцию, синтетические стероиды обеспечивают сохранность фолликулярного аппарата яичников [10, 11].
Методы гормональной контрацепции подразделяют на комбинированные средства, содержащие в своем составе эстрогены и гестагены, и некомбинированные, содержащие только гестаген.
Эстрогенный компонент в большинстве комбинированных препаратов представлен этинилэстрадиолом. Это синтетический эстроген, по структуре сходный с эндогенным эстрадиолом, но отличный от него по метаболизму и биологической активности [10].
Эндогенный эстрадиол метаболизируется в печени, где он превращается в низкоактивный эстрон (E1) и неактивный эстрона сульфат (E1S). Оставшийся в небольшом количестве эстрадиол поступает в циркулирующую кровь и образует комплексы с сывороточными белками: альбумином и глобулином, связывающим половые стероиды (ГСПС). Эстрадиол с ГСПС транспортируется к тканям-мишеням, а с альбумином (всего около 5% от исходного) остается биологически активным.
В отличие от эндогенного эстрадиола синтетический этинилэстрадиол за счет наличия у него дополнительной 17-альфа-этинильной группы подвергается длительной рециркуляции в печени: деконъюгируется в желудочно-кишечном тракте, экскретируется в желчь, реабсорбируется в кровь и вновь возвращается в печень в активной форме. В результате происходит длительное взаимодействие этинилэстрадиола с печеночными ферментами, проявляющееся в сотни раз более выраженным влиянием на системные параметры в сравнении с эндогенным эстрадиолом. Кроме того, поступая в кровь, этинилэстрадиол не образует комплексы с ГСПС, а практически полностью связывается с альбуминами плазмы. В результате биодоступность этинилэстрадиола составляет около 45% от исходной, что в несколько раз превышает биодоступность эндогенного эстрадиола [10, 12].
С особенностями метаболизма этинилэстрадиола (длительное взаимодействие с печеночными ферментами, наличие активного синтетического эстрогена в сыворотке крови) связано развитие таких побочных эффектов, как тошнота, головная боль, болезненность молочных желез, прибавка массы тела, появление акне, негативное влияние на свертывающую систему крови, уровень холестерина и инсулинорезистентность [10, 12].
Особенно выраженные эстрогензависимые побочные эффекты имели первые контрацептивные средства, содержащие 150 мкг этинилэстрадиола. С переходом на препараты, содержащие менее 40 мкг этинилэстрадиола, их переносимость значительно улучшилась [1, 4], а также более чем в два раза снизилась частота развития тромбофилических осложнений [13]. Минимальное количество этинилэстрадиола, содержащееся в некоторых контрацептивах, составляет 15–20 мкг в сутки, и дальнейшее снижение его дозы нецелесообразно в связи с ухудшением контроля цикла [1, 4, 6].
В зависимости от поступающей в организм суточной дозы этинилэстрадиола гормональные контрацептивы подразделяют следующим образом:
- высокодозированные (40 мкг/сут этинилэстрадиола);
- низкодозированные (30–35 мкг/сут этинилэстрадиола);
- микродозированные (15–20 мкг/сут этинилэстрадиола) (табл. 1).
В последние годы были созданы контрацептивы с другими синтетическими эстрогенами: эстрадиола валератом и 17-бета-эстрадиолом (рис. 1). Эстрадиола валерат по своей структуре приближен к натуральному эстрогену, но наличие остатка валериановой кислоты несколько изменяет его метаболизм. После приема внутрь он расщепляется на эстрадиол и валериановую кислоту. Валериановая кислота быстро метаболизируется, а эстрадиол в ходе всасывания в слизистой оболочке желудочно-кишечного тракта и первого пассажа через печень расщепляется на малоактивные метаболиты: эстрон, эстрона сульфат и эстрона глюкуронид [14].
17-бета-эстрадиол имеет такую же структуру, что и эндогенный эстрадиол, поэтому метаболизируются они в организме одинаково. Другими словами, после приема внутрь 17-бета-эстрадиол подвергается метаболизму уже при первом прохождении через печень и затем почти наполовину связывается в крови с ГСПС.
Биодоступность 17-бета-эстрадиола и эстрадиола валерата эквивалентна эндогенному эстрадиолу и составляет 3–5%, что обеспечивает клинически незначимое влияние на метаболические параметры в организме и низкую частоту развития побочных реакций [10, 12, 15].
17-бета-эстрадиол и эстрадиола валерат длительное время использовались в составе заместительной гормональной терапии у женщин в климактерии, но попытки создать контрацептивные средства на их основе оставались безуспешными. Основной проблемой являлся неадекватный контроль цикла при их монофазном приеме [4]. В результате для эстрадиола валерата был найден оптимальный четырехфазный режим применения в сочетании с производным тестостерона диеногестом, а для 17-бета-эстрадиола оказалось удачным сочетание с производным прогестерона – номегэстрола ацетатом. Это позволило создать два новых гормональных контрацептива, содержащих в своем составе эстрогеновый компонент, близкий по своим свойствам к эндогенному эстрадиолу. Оба обладают высокой степенью надежности предохранения от нежелательной беременности, надежно контролируют цикл, вызывая при этом минимальное количество системных побочных эффектов [14–19].
В отличие от почти постоянной эстрогенной составляющей, прогестагенный компонент в гормональных контрацептивах представлен целям рядом синтетических производных прогестерона, тестостерона и спиронолактона (табл. 2) [20, 21].
К производным прогестерона относятся производные 17-альфа-гидроксипрогестерона – прегнаны (медроксипрогестерона ацетат, мегестрола ацетат, хлормадинона ацетат, ципротерона ацетат) и производные 19-норпрогестерона – норпрегнаны (номегестрола ацетат, демегестон, промегестон и тримегестон).
Производные тестостерона или 19-нортестостерона также подразделяются на две группы: эстраны (норэтистерон, норэтинодрел, линестренол) и гонаны (норгестрел, левоноргестрел, дезогестрел, этоногестрел, гестоден и норгестимат). Дезогестрел обладает высокой селективностью, высокой прогестагенной активностью и сродством к прогестероновым рецепторам. Дезогестрел способствует уменьшению объема кровопотери и защите эндометрия от пролиферативного действия эстрогенов. Этоногестрел представляет собой активный метаболит дезогестрела и обладает всеми его свойствами. Этоногестрел входит в состав современных гормональных контрацептивов пролонгированного действия – влагалищного кольца НоваРинг и подкожного имплантата Импланон НКСТ. В последние годы были созданы два гибридных прогестагена: производное тестостерона – диеногест и производное спиронолактона – дроспиренон.
Все синтетические прогестагены, входящие в состав современных гормональных контрацептивов, обладают антигонадотропным действием, надежно подавляют овуляцию, обеспечивая высокий контрацептивный эффект, и блокируют эстрогенное влияние на эндометрий, предотвращая его пролиферацию. Однако они имеют различия по другим биологическим эффектам, в зависимости от которых гормональные контрацептивы приобретают дополнительные свойства (табл. 3) [20].
Синтетические прогестагены ввзаимодействуют в организме не только с прогестероновыми рецепторами, но и с рецепторами других стероидов: эстрогенов, андрогенов, глюкокортикоидов и минералокортикоидов. Идеальный прогестаген в составе гормональных контрацептивов не должен обладать иной активностью, кроме прогестагенной и антигонадотропной. На сегодняшний день самым высокоселективным является номегэстрола ацетат (производное 19-норпрогестерона), входящий в состав препарата Зоэли. Он обладает только необходимыми для предохранения от беременности антигонадотропными свойствами и не имеет других клинически значимых эффектов [15, 22, 23].
Производные 17-альфа-гидроксипрогестерона (прегнаны) не являются высокоселективными стероидами: кроме антигонадотропного эффекта они оказывают еще антиандрогенное и глюкокортикоидное воздействие. Глюкокортикоидный эффект гормональных контрацептивов считается нежелательным, поскольку он может стать причиной увеличения массы тела и снижения минеральной плотности костной ткани. В то же время дополнительное антиандрогенное действие широко используется в лечебных целях у женщин с проявлениями гиперандрогении. Антиандрогенные эффекты максимально выражены у ципротерона ацетата, умеренно – у хлормадинона ацетата и отсутствуют у медроксипрогестерона ацетата [20, 21].
Наиболее многочисленную группу синтетических прогестагенов в составе гормональных контрацептивов представляют производные тестостерона. Ранние их представители – эстраны, к которым относятся норэтистерон, линестренон и норэтинодрел, – обладают добавочными эстрогенными и андрогенными свойствами. С андрогенной активностью связывают появление акне, гирсутизм, задержку жидкости в организме, изменение липидного спектра крови в сторону увеличения липопротеинов низкой плотности. Дополнительное эстрогенное действие усиливает проявление эстрогензависимых побочных эффектов у контрацептивов, содержащих этинилэстрадиол.
Следующие производные тестостерона – гонаны (левоноргестрел, дезогестрел, гестоден и норгестимат), в отличие от эстранов, не потенцируют эстрогенный эффект и не оказывают клинически выраженного андрогенного влияния. Наиболее изучен среди всех синтетических прогестинов левоноргестрел. Его свойства и особенности влияния подтверждены многочисленными исследованиями, поэтому его используют в качестве эталона сравнения при оценке эффективности и безопасности всех имеющихся и создающихся новых гормональных контрацептивных средств.
Диеногест, также производное тестостерона, является гибридным гестагеном и обладает свойствами не только гонанов, но и прогестерона, что обусловливает наличие у него антиандрогенного действия, в отличие от левоноргестрела, дезогестрела, гестодена и норгестимата, имеющих остаточный андрогенный потенциал [20, 21].
Еще один гибридный гестаген – дроспиренон является производным спиронолактона. Он объединяет в себе свойства прогестерона (антигонадотропный и антиандрогенный эффект) и антиминералокортикоидов (свойства клинически выражаются в уменьшении задержки жидкости и натрия в организме). Сочетание антиандрогенного и антидиуретического действия положительным образом влияет на здоровье женщин с синдромом поликистозных яичников, предменструальным синдромом, а также доброкачественными заболеваниями молочных желез. В последние годы появились дроспиренонсодержащие комбинированные препараты с добавлением 400 мкг фолатов (Джес плюс, Ярина плюс), позволяющие избежать возможного возникновения дефицита фолиевой кислоты при длительном приеме комбинированных гормональных контрацептивов и особенно у женщин с дефицитом фолатов.
Состав оригинальных гормональных контрацептивов, зарегистрированных в России, представлен в таблице 4.
Традиционно гормональные контрацептивы принимаются по одной таблетке в течение 21 дня с последующим семидневным перерывом, во время которого происходит менструальноподобное кровотечение. Одним из путей эволюции гормональной контрацепции стало создание новых режимов с укороченным перерывом между приемами препарата. Было доказано, что при применении 24 активных таблеток, содержащих этинилэстрадиол/дроспиренон (Джес) или 17-бета-эстрадиол/номегэстрола ацетат (Зоэли), в монофазном режиме и таблеток плацебо в последующие четыре дня значительно уменьшается объем кровопотери и частота межменструальных кровотечений. Сходные данные получены для режима 26 + 2, который имеет пероральный контрацептив, содержащий эстрадиола валерат и диеногест (Клайра) [18, 24, 25].
В последние годы контрацептивы стали назначаться в лечебных целях на более длительный период без перерыва на менструальноподобное маточное кровотечение. Это обеспечивается непрерывным приемом двух-трех-четырех упаковок препарата подряд с последующим семидневным перерывом: режимы 42 + 7, 63 + 7, 84 + 7 [26]. В 2012 г. были опубликованы результаты рандомизированного многоцентрового исследования, которые продемонстрировали безопасность еще более длительного непрерывного режима приема комбинированных гормональных контрацептивов с одним перерывом на менструальноподобное кровотечение в течение пяти месяцев [27]. Убеждение в том, что менструации необходимы для профилактики злокачественных заболеваний эндометрия, ошибочно.
Известно, что при менструальном кровотечении удаляется только верхний функциональный слой эндометрия, не затрагивающий более глубокого базального, из которого развивается большинство опухолей.
Известно, что при менструальном кровотечении удаляется только верхний функциональный слой эндометрия, не затрагивающий более глубокого базального, из которого развивается большинство опухолей.
По данным международных социологических исследований, наиболее популярными среди пользователей гормональной контрацепции являются пролонгированные методы – средства, которые необходимо принимать реже чем один раз в месяц или за один цикл [28–30]. К ним относятся обратимые контрацептивы пролонгированного действия и обратимые контрацептивы короткого действия. Все они вводятся трансдермально, подкожно, внутримышечно, внутриматочно или интравагинально.
Среди них выделяют комбинированные эстроген-гестагенные средства и некомбинированные (гестагенные) (табл. 5). К комбинированным контрацептивам пролонгированного действия относят вагинальное кольцо Новаринг и накожный пластырь Евра. Чисто гестагенными методами являются внутримышечные инъекции Депо-провера, внутриматочная гормональная система Мирена и подкожные имплантаты Импланон и Импланон НКСТ.
Все пролонгированные контрацептивы являются гормональными рилизинг-системами и имеют ряд преимуществ перед ежедневными пероральными средствами. При применении гормональных рилизинг-систем обеспечивается:
- стабильное выделение малых доз гормонов по биологическому градиенту;
- длительная контрацепция;
- точность дозирования;
- отсутствие суточных колебаний экскреции гормонов;
- отсутствие необходимости ежедневного самоконтроля;
- отсутствие эффекта первого прохождения препарата через печень;
- отсутствие желудочно-кишечного взаимодействия с другими лекарственными средствами [31].
Для оценки эффективности методов предохранения от беременности используется индекс Перля, показывающий количество беременностей, наступивших у 100 женщин в течение года использования определенного вида контрацепции. Существует понятие эффективности метода при правильном использовании, отражающем, насколько эффективен метод при точном соблюдении инструкции по применению, и фактическом, учитывающем непостоянное или неправильное использование (табл. 6) [28]. При правильном использовании методов гормональной контрацепции индекс Перля всегда составляет меньше 1, но при фактическом – он значительно отличается и доходит до 8 [9]. По данным социологических исследований, такое расхождение обусловлено нарушением режима использования метода (пропуск таблеток или очередной инъекции, нерегулярная замена вагинального кольца или пластыря), что происходит у 70% женщин [32]. Наиболее эффективными являются методы, не зависящие от организованности пользователя: внутриматочная рилизинг-система Мирена, устанавливаемая на пять лет, и подкожные имплантаты Импланон и Импланон НКСТ, действующие в течение трех лет. Индексы Перля при их прогнозируемом и фактическом использовании одинаковы и составляют 0,2 и 0,05 соответственно [28, 31, 33].
Тромбофилические риски гормональных контрацептивов
Известно, что на фоне применения гормональных контрацептивов повышается риск тромбофилических осложнений, как венозных, включая тромбоз глубоких вен и тромбоэмболию легочной артерии, так и артериальных, включая острый инфаркт миокарда и инсульт [9, 34–36].
В настоящее время доказано, что артериальные тромбозы при применении современных низкодозированных гормональных контрацептивов встречаются крайне редко. Риск их возникновения ассоциирован только с увеличением дозы этинилэстрадиола более 40 мкг в сутки. У молодых здоровых женщин не выявлено повышения частоты острого инфаркта миокарда и ишемического или геморрагического инсульта при длительном применении низкодозированных эстроген-гестагенных препаратов по сравнению с теми, кто не применяет методы гормональной контрацепции [37, 38].
Значимое влияние на риск развития артериальных тромботических осложнений оказывают такие факторы, как курение, возраст старше 40 лет, гипертония, дислипидемия, ожирение и сахарный диабет. Все они, будучи независимыми факторами риска сердечно-сосудистых заболеваний, могут увеличивать риск развития инсульта и инфаркта у женщин, использующих контрацептивы с этинилэстрадиолом [39–43].
Так, курение помимо негативного влияния на дыхательную систему и организм в целом обсусловливает высокий риск развития артериальных тромботических осложнений [44]. По данным Всемирной организации здравоохранения [37, 45], количество случаев развития инфаркта миокарда у некурящих женщин моложе 35 лет, как принимающих, так и не принимающих гормональные контрацептивные препараты, составляет 4 на 10 тыс. женщин в год. У молодых курящих женщин, не использующих методы гормональной контрацепции, показатель артериальных тромбозов в два раза выше и увеличивается с возрастом еще в 20 раз. При приеме комбинированных контрацептивов у женщин молодого возраста курение повышает частоту артериальных тромботических осложнений в 10 раз (около 40 случаев на 10 тыс. женщин в год), а у женщин после 35 лет – в сотни раз (485 случаев на 10 тыс. женщин в год).
В отличие от артериальных тромботических осложнений частота венозных тромбозов на фоне приема гормональных контрацептивов увеличивается. В этой связи большинство исследований, посвященных изучению влияния синтетических аналогов половых гормонов на систему свертывания крови, ограничивается областью венозных тромбоэмболических осложнений – тромбоэмболией легочной артерии и тромбозом глубоких вен.
Было проведено несколько крупный исследований, оценивающих возможный риск венозных тромбоэмболий при применении различных видов гормональных контрацептивов [34, 46–48, 49–51]. В целом вероятность осложнений на фоне гормональной контрацепции повышается (преимущественно в виде тромбозов глубоких вен), но она значительно меньше, чем при беременности и в послеродовом периоде.
Так, среди женщин репродуктивного возраста, некурящих и не принимающих гормональные контрацептивы, относительный риск развития венозных тромбозов составляет, по разным данным, от 2,1 до 4,7 случаев на 10 тыс. женщин в год. Во время беременности этот риск возрастает в среднем в шесть раз – до 9,5–30 случаев на 10 тыс. женщин в год. В первые шесть – восемь недель послеродового периода частота венозных тромбозов увеличивается еще более значимо – в 14 раз и оценивается разными авторами от 19,4 до 50 случаев на 10 тыс. женщин в год [34, 49, 51–53].
При использовании современных низкодозированных гормональных контрацептивов частота венозных тромбоэмболий составляет 6–9,9 случаев на 10 тыс. женщин в год, что в полтора-два раза выше, чем у не применяющих гормональные контрацептивы женщин репродуктивного возраста [34, 46, 49, 53, 54]. При этом данный показатель значительно варьирует в зависимости от дозы и вида эстрогенного компонента, вида прогестагена, пути введения и наличия дополнительных факторов риска венозных тромбоэмболий [36, 45, 47, 49, 54, 55].
Наибольший вклад в развитие сосудистых венозных осложнений вносит патология свертывающей системы крови, причем как приобретенная (антифосфолипидный синдром), так и наследственная (мутация V фактора Лейдена в гене протромбина, дефицит протеинов С, S и антитромбина III). Самым неблагоприятным, увеличивающим риск венозных тромбоэмболий в 10–30 раз, является прием комбинированных гормональных контрацептивов у женщин с наследственной мутацией V фактора Лейдена и/или гена протромбина [36, 53, 56]. При этом варикозная болезнь не относится к дополнительным факторам риска развития как венозных, так и артериальных тромбозов при использовании методов гормональной контрацепции [19, 57].
Созданные в последние годы контрацептивы, в состав которых вместо этинилэстрадиола входят другие синтетические производные эстрогенов – эстрадиола валерат или 17-бета-эстрадиол, не оказывают неблагоприятного влияния на факторы свертывания крови. Риск тромбофилических осложнений при их приеме такой же, как у женщин репродуктивного возраста, не использующих гормональные методы контрацепции [15, 18, 19]. Но в связи с отстутствием длительных масштабных исследований, подтверждающих их безопасность (в составе гормональных контрацептивов они применяются сравнительно недавно), в рекомендациях Всемирной организации здравоохранения [9] пероральные контрацептивы с новыми эстрогенами объединены в общую группу с этинилэстрадиолсодержащими средствами.
Этинилэстрадиол, в отличие от эстрадиола валерата и 17-бета-эстрадиола, дозозависимо увеличивает коагуляционный потенциал свертывающей системы крови. Низкодозированные средства, содержащие менее 40 мкг синтетического эстрогена, слабо воздействуют на свертывающую систему, изменения ее показателей происходят на 10–15% и, как правило, не выходят за нормативные значения [5, 35].
Возможный механизм тромботического влияния этинилэстрадиола заключается в его повышенной резистентности к активированному протеину С, отвечающему за антикоагулянтное звено гемостаза [58]. В качестве косвенного маркера нарушения антикоагулянтного потенциала расценивается сывороточный уровень ГСПС [47, 59]. В отличие от «натуральных» эстрогенов – эстрадиола валерата и 17-бета-эстрадиола этинилэстрадиол дозозависимо увеличивает выработку в печени данного транспортного белка, при этом практически не связываясь с ним в циркулирующей крови, что приводит к увеличению сывороточного уровня ГСПС [10, 12].
Входящие в состав контрацептивов прогестагены оказывают антагонистическое влияние на уровень ГСПС, стимулированный этинилэстрадиолом [35, 47]. Наибольшей антиэстрогенной активностью в отношении ГСПС обладает левоноргестрел. При приеме комбинированных препаратов, содержащих этинилэстрадиол и левоноргестрел, сывороточный уровень ГСПС не отличается от такового у женщин, не использующих гормональные контрацептивы. Сочетание этинилэстрадиола с другими гестагенами приводит к повышению концентрации ГСПС в крови. Так, контрацептивы, содержащие этинилэстрадиол с дезогестрелом, гестоденом, норгестиматом или дроспиреноном, увеличивают этот показатель в три раза, с диеногестом или ципротерона ацетатом – в четыре-пять раз [47, 59]. При применении пролонгированных методов комбинированной гормональной контрацепции сывороточный уровень ГСПС также повышается. Наибольшее неблагоприятное влияние на уровень ГСПС оказывает трансдермальный пластырь с этинилэстрадиолом и норэлгестромином (рис. 2) [35, 46, 48–50, 54, 60–62].
Контрацептивы, содержащие только гестаген, в отличие от эстрогенсодержащих средств, не оказывают неблагоприятного влияния на сывороточный уровень ГСПС [47, 59]. По данным многочисленных исследований, любые синтетические гестагены без эстрогенной составляющей не увеличивают риск тромбофилических осложнений [62]. При применении таблетированных форм, содержащих только гестагены [63], внутримышечных инъекций медроксипрогестрона ацетата [64], подкожных имплантатов, содержащих этоногестрел [65, 66], а также внутриматочной рилизинг-системы с левоноргестрелом [64] риск венозных и артериальных тромбофилических осложнений остается на таком же уровне, как и у женщин, не использующих методы гормональной контрацепции. Кроме того, не установлено повышения риска тромбозов при приеме контрацептивов, содержащих комбинации гестагенов с 17-бета-эстрадиолом или эстрадиола валератом [14, 16, 22].
При сочетании этинилэстрадиола с синтетическими гестагенами частота тромбофилических осложнений повышается, составляя в среднем 6–14 случаев на 10 тыс. женщин в год, и напрямую зависит от гестагенной составляющей. Наименьший риск венозных тромбозов среди комбинированных пероральных контрацептивов с этинилэстрадиолом имеют средства, содержащие в качестве прогестагенного компонента левоноргестрел и норгестимат. Частота развития венозных тромбоэмболий при их применении составляет 6–8 случаев на 10 тыс. женщин в год [38, 46, 49]. Препараты с дезогестрелом, гестоденом, диеногестом и ципротероном ассоциируются с более высокой частотой развития венозных тромбозов: 9–12 случаев на 10 тыс. женщин в год [48, 49].
Этинилэстрадиолсодержащие препараты с дроспиреноном имеют наивысший тромбофилический риск, показатель которого превышает аналогичный у средств с левоноргестрелом в полтора-два раза [35, 46, 49, 50] (однако это подтверждается не всеми исследованиями [51, 54]).
Этинилэстрадиолсодержащие препараты с дроспиреноном имеют наивысший тромбофилический риск, показатель которого превышает аналогичный у средств с левоноргестрелом в полтора-два раза [35, 46, 49, 50] (однако это подтверждается не всеми исследованиями [51, 54]).
Применение трансдермального пластыря, содержащего этинилэстрадиол и норэлгестромин, сопровождается 9–14 случаями венозных тромбозов на 10 тыс. женщин в год, что в два раза выше, чем при применении перорального препарата с аналогичным составом. У вагинального кольца, в состав которого входят этинилэстрадиол и этоногестрел, в сравнении с таблетированными препаратами, содержащими дезогестрел, метаболитом которого является этоногестрел, и этинилэстрадиол в той же дозе, риск венозных осложнений в полтора раза ниже и составляет 6–11 случаев на 10 тыс. женщин в год [46, 62].
B целом риск развития венозных тромботических осложнений при приеме современных гормональных контрацептивов, несмотря на некоторые различия, связанные с составом препарата, в полтора-два раза ниже, чем у курящих женщин, и значительно уступает имеющемуся риску во время беременности и в послеродовом периоде (рис. 3) [6, 8, 44, 52, 55]. При этом потенциальная польза от их применения превышает все возможные риски у здоровых женщин моложе 40 лет (табл. 7) [6]. Своевременное назначение индивидуально подобранного контрацептивного средства не только предотвращает наступление нежеланной беременности, но и положительно влияет как на репродуктивное, так и на общее здоровье женщины [67, 68].
1. Burkman R., Bell C., Serfaty D. The evolution of combined oral contraception: improving the risk-to-benefit ratio // Contraception. 2011. Vol. 84. № 1. P. 19–34.
2. Pincus G., Chang M.C., Hafez E.S. et al. Effects of certain 19-norsteroids on reproductive processes in animals // Sсience. 1956. Vol. 124. № 3227. P. 890–891.
3. Pincus G., Garcia C.R., Rock J. et al. Effectiveness of an oral contraceptive; effects of a progestin-estrogen combination upon fertility, menstrual phenomena, and health // Sсience. 1959. Vol. 130. № 3367. P. 81–83.
4. Dhont M. History of oral contraception // Eur. J. Contracept. Reprod. Health Care. 2010. Vol. 15. Suppl. 2. P. 12–18.
5. Gerstman B.B., Piper J.M., Tomita D.K. et al. Oral contraceptive estrogen dose and the risk of deep venous thromboembolic disease // Am. J. Epidemiol. 1991. Vol. 133. № 1. P. 32–37.
6. Melmed S., Polonsky K.S., Larsen P.R. et al. Williams Textbook of Endocrinology. 11th ed. Philadelphia: Saunders, 2008.
7. The effects of seven monophasic oral contraceptive regimens on hemostatic variables: conclusions from a large randomized multicenter study // Contraception. 2003. Vol. 67. № 3. P. 173–185.
8. US Selected Practice Recommendations for Contraceptive Use. CDC, 2013 // www.cdc.gov/mmwr/pdf/rr/rr62e0614.pdf.
9. Medical Eligibility Criteria for Contraceptive Use, 4th ed. Geneva: WHO, 2009.
10. Speroff L., Fritz M.A. Clinical gynecologic endocrinology and infertility. 7th ed. Philadelphia: Lippincott Williams and Wilkins, 2005.
11. Clinical effectiveness unit. combined hormonal contraception. London: Faculty of Sexual and Reproductive Healthcare, 2011 // www.guideline.gov/content.aspx?f=rss&id=36071.
12. Grow D.R. Metabolism of endogenous and exogenous reproductive hormones // Obstet. Gynecol. Clin. North Am. 2002. Vol. 29. № 3. P. 425–436.
13. Porter J.B., Jick H., Walker A.M. Mortality among oral contraceptive users // Obstet. Gynecol. 1987. Vol. 70. № 1. P. 29–32.
14. Zeun S., Lu M., Uddin A. et al. Pharmacokinetics of an oral contraceptive containing oestradiol valerate and dienogest // Eur. J. Contracept. Reprod. Health Care. 2009. Vol. 14. № 3. P. 221–232.
15. Agren U.M., Anttila M., Mäenpää-Liukko K. et al. Effects of a monophasic combined oral contraceptive containing nomegestrol acetate and 17β-oestradiol compared with one containing levonorgestrel and ethinylestradiol on haemostasis, lipids and carbohydrate metabolism // Eur. J. Contracept. Reprod. Health Care. 2011. Vol. 16. № 6. P. 444–457.
16. Jensen J.T. Evaluation of a new estradiol oral contraceptive: estradiol valerate and dienogest // Expert Opin. Pharmacother. 2010. Vol. 11. № 7. P. 1147–1157.
17. Duijkers I.J., Klipping C., Grob P. et al. Effects of a monophasic combined oral contraceptive containing nomegestrol acetate and 17 beta-oestradiol on ovarian function in comparison to a monophasic combined oral contraceptive containing drospirenone and ethinylestradiol // Eur. J. Contracept. Reprod. Health Care. 2010. Vol. 15. № 5. P. 314–325.
18. Mansour D., Verhoeven C., Sommer W. et al. Efficacy and tolerability of a monophasic combined oral contraceptive containing nomegestrol acetate and 17β-oestradiol in a 24/4 regimen, in comparison to an oral contraceptive containing ethinylestradiol and drospirenone in a 21/7 regimen // Eur. J. Contracept. Reprod. Health Care. 2011. Vol. 16. № 6. P. 430–443.
19. Westhoff C., Kaunitz A.M., Korver T. et al. Efficacy, safety, and tolerability of a monophasic oral contraceptive containing nomegestrol acetate and 17β-estradiol: a randomized controlled trial // Obstet. Gynecol. 2012. Vol. 119. № 5. P. 989–999.
20. Schindler A.E., Campagnoli C., Druckmann R. et al. Classification and pharmacology of progestins // Maturitas. 2008. Vol. 61. № 1–2. P. 171–180.
21. Stanczyk F.Z. Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception // Rev. Endocr. Metab. Disord. 2002. Vol. 3. № 3. P. 211–224.
22. Lello S. Nomegestrol acetate: pharmacology, safety profile and therapeutic efficacy // Drugs. 2010. Vol. 70. № 5. P. 541–559.
23. Mueck A.O., Sitruk-Ware R. Nomegestrol acetate, a novel progestogen for oral contraception // Steroids. 2011. Vol. 76. № 6. P. 531–539.
24. Christin-Maitre S., Serfaty D., Chabbert-Buffet N. et al. Comparison of a 24-day and a 21-day pill regimen for the novel combined oral contraceptive, nomegestrol acetate and 17β-estradiol (NOMAC/E2): a double-blind, randomized study // Hum. Reprod. 2011. Vol. 26. № 6. P. 1338–1347.
25. Read C.M. New regimens with combined oral contraceptive pills: moving away from traditional 21/7 cycles // Eur. J. Contracept. Reprod. Health Care. 2010. Vol. 15. Suppl. 2. P. 32–41.
26. Seracchioli R., Mabrouk M., Frascà C. et al. Long-term cyclic and continuous oral contraceptive therapy and endometrioma recurrence: a randomized controlled trial // Fertil. Steril. 2010. Vol. 93. № 1. P. 52–56.
27. Klipping C., Duijkers I., Fortier M.P. et al. Long-term tolerability of ethinylestradiol 20 μg/drospirenone 3 mg in a flexible extended regimen: results from a randomised, controlled, multicentre study // J. Fam. Plann. Reprod. Health Care. 2012. Vol. 38. № 2. P. 84–93.
28. Trussell J. Contraceptive failure in the United States // Contraception. 2011. Vol. 83. № 5. P. 397–404.
29. Trussell J., Henry N., Hassan F. et al. Burden of unintended pregnancy in the United States: potential savings with increased use of long-acting reversible contraception // Contraception. 2013. Vol. 87. № 2. P. 154–161.
30. Blumenthal P.D., Gemzell-Danielsson K., Marintcheva-Petrova M. Tolerability and clinical safety of Implanon // Eur. J. Contracept. Reprod. Health Care. 2008. Vol. 13. Suppl. 1. P. 29–36.
31. Hatcher R.A., Trussell J., Nelson A.L. et al. Contraceptive Technology. 19th ed. New York: Ardent Media, 2007.
32. Trussell J., Wynn L.L. Reducing unintended pregnancy in the United States // Contraception. 2008. Vol. 77. № 1. P. 1–5.
33. Winner B., Peipert J.F., Zhao Q. et al. Effectiveness of long-acting reversible contraception // N. Engl. J. Med. 2012. Vol. 366. № 21. P. 1998–2007.
34. Lidegaard Ø. Hormonal contraception and venous thromboembolic risk in midlife women // Maturitas. 2013. Vol. 74. № 1. P. 1–2.
35. Van Hylckama Vlieg A., Helmerhorst F.M., Vandenbroucke J.P. et al. The venous thrombotic risk of oral contraceptives, effects of oestrogen dose and progestogen type: results of the MEGA case-control study // BMJ. 2009. Vol. 339. ID b2921.
36. Combined hormonal contraceptives (CHCs) and the risk of cardiovascular disease endpoints. FDA, 2011 // www.fda.gov/downloads/Drugs/DrugSafety/ucm277384.pdf.
37. Acute myocardial infarction and combined oral contraceptives: results of an international multicentre case-control study // Lancet. 1997. Vol. 349. № 9060. P. 1202–1209.
38. Lidegaard Ø., Løkkegaard E., Jensen A. et al. Thrombotic stroke and myocardial infarction with hormonal contraception // N. Engl. J. Med. 2012. Vol. 366. № 24. P. 2257–2266.
39. Chan W.S., Ray J., Wai E.K. et al. Risk of stroke in women exposed to low-dose oral contraceptives: a critical evaluation of the evidence // Arch. Intern. Med. 2004. Vol. 164. № 7. P. 741–747.
40. Baillargeon J.P., McClish D.K., Essah P.A. et al. Association between the current use of low-dose oral contraceptives and cardiovascular arterial disease: a meta-analysis // J. Clin. Endocrinol. Metab. 2005. Vol. 90. № 7. P. 3863–3870.
41. Knopp R.H., LaRosa J.C., Burkman R.T. Jr. Contraception and dyslipidemia // Am. J. Obstet. Gynecol. 1993. Vol. 168. № 6. Pt. 2. P. 1994–2005.
42. Lubianca J.N., Faccin C.S., Fuchs F.D. Oral contraceptives: a risk factor for uncontrolled blood pressure among hypertensive women // Contraception. 2003. Vol. 67. № 1. P. 19–24.
43. Tepper N.K., Curtis K.M., Steenland M.W. et al. Blood pressure measurement prior to initiating hormonal contraception: a systematic review // Contraception. 2013. Vol. 87. № 5. P. 631–638.
44. Sherif K. Benefits and risks of oral contraceptives // Am. J. Obstet. Gynecol. 1999. Vol. 180. № 6. Pt. 2. P. 343–348.
45. Cardiovascular disease and use of oral and injectable progestogen-only contraceptives and combined injectable contraceptives. Results of an international, multicenter, case-control study // Contraception. 1998. Vol. 57. № 5. P. 315–324.
46. Sidney S., Cheetham T.C., Connell F.A. et al. Recent combined hormonal contraceptives (CHCs) and the risk of thromboembolism and other cardiovascular events in new users // Contraception. 2013. Vol. 87. № 1. P. 93–100.
47. Raps M., Helmerhost F., Fleischer K. et al. Sex hormone-binding globulin as a marker for the thrombotic risk of hormonal contraceptives // J. Thromb. Haemost. 2012. Vol. 10. № 6. P. 992–997.
48. Lidegaard O., Nielsen L.H., Skovlund C.W. et al. Venous thrombosis in users of non-oral hormonal contraception: follow-up study, Denmark 2001-10 // BMJ. 2012. Vol. 344. ID e2990.
49. Lidegaard Ø., Nielsen L.H., Skovlund C.W. et al. Risk of venous thromboembolism from use of oral contraceptives containing different progestogens and oestrogen doses: Danish cohort study, 2001-9 // BMJ. 2011. Vol. 343. ID d6423.
50. Parkin L., Sharples K., Hernandez R.K. et al. Risk of venous thromboembolism in users of oral contraceptives containing drospirenone or levonorgestrel: nested case-control study based on UK General Practice Research Database // BMJ. 2011. Vol. 342. ID d2139.
51. Dinger J.C., Heinemann L.A., Kühl-Habich D. The safety of a drospirenone-containing oral contraceptive: final results from the European Active Surveillance Study on oral contraceptives based on 142,475 women-years of observation // Contraception. 2007. Vol. 75. № 5. P. 344–354.
52. Heit J.A., Kobbervig C.E., James A.H. et al. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study // Ann. Intern. Med. 2005. Vol. 143. № 10. P. 697–706.
53. Manzoli L., De Vito C., Marzuillo C. et al. Oral contraceptives and venous thromboembolism: a systematic review and meta-analysis // Drug Saf. 2012. Vol. 35. № 3. P. 191–205.
54. Dinger J., Assmann A., Möhner S. et al. Risk of venous thromboembolism and the use of dienogest- and drospirenone-containing oral contraceptives: results from a German case-control study // J. Fam. Plann. Reprod. Health Care. 2010. Vol. 36. № 3. P. 123–129.
55. Руководство по контрацепции / под ред. В.Н. Прилепской. 2-е изд., перераб. и доп. М.: МЕДпресс-информ, 2010.
56. Kemmeren J.M., Algra A., Meijers J.C. et al. Effect of second- and third-generation oral contraceptives on the protein C system in the absence or presence of the factor VLeiden mutation: a randomized trial // Blood. 2004. Vol. 103. № 3. P. 927–933.
57. Oral contraceptives, venous thrombosis, and varicose veins. Royal College of General Practitioners' Oral Contraception Study // J. R. Coll. Gen. Pract. 1978. Vol. 28. № 192. P. 393–399.
58. Sandset P.M., Høibraaten E., Eilertsen A.L. et al. Mechanisms of thrombosis related to hormone therapy // Thromb. Res. 2009. Vol. 123. Suppl. 2. P. 70–73.
59. Odlind V., Milsom I., Persson I., Victor A. Can changes in sex hormone binding globulin predict the risk of venous thromboembolism with combined oral contraceptive pills? // Acta Obstet. Gynecol. Scand. 2002. Vol. 81. № 6. P. 482–490.
60. Fleischer K., van Vliet H.A., Rosendaal F.R. et al. Effects of the contraceptive patch, the vaginal ring and an oral contraceptive on APC resistance and SHBG: a cross-over study // Thromb. Res. 2009. Vol. 123. № 3. P. 429–435.
61. Johnson J.V., Lowell J., Badger G.J. et al. Effects of oral and transdermal hormonal contraception on vascular risk markers: a randomized controlled trial // Obstet. Gynecol. 2008. Vol. 111. № 2. Pt. 1. P. 278–284.
62. Lidegaard Ø., Løkkegaard E., Svendsen A.L. et al. Hormonal contraception and risk of venous thromboembolism: national follow-up study // BMJ. 2009. Vol. 339. ID b2890.
63. Grimes D.A., Lopez L.M., O'Brien P.A. et al. Progestin-only pills for contraception // Cochrane Database Syst. Rev. 2010. Vol. 1. CD007541.
64. Van Hylckama Vlieg A., Helmerhorst F.M., Rosendaal F.R. The risk of deep venous thrombosis associated with injectable depot-medroxyprogesterone acetate contraceptives or a levonorgestrel intrauterine device // Arterioscler. Thromb. Vasc. Biol. 2010. Vol. 30. № 11. P. 2297–3000.
65. Alexander N.J., Baker E., Kaptein M. et al. Why consider vaginal drug administration? // Fertil. Steril. 2004. Vol. 82. № 1. P. 1–12.
66. Brito M.B., Ferriani R.A., Meijers J.C. et al. Effects of the etonogestrel-releasing contraceptive implant inserted immediately postpartum on maternal hemostasis: a randomized controlled trial // Thromb. Res. 2012. Vol. 130. № 3. P. 355–360.
67. Alkema L., Kantorova V., Menozzi C. et al. National, regional, and global rates and trends in contraceptive prevalence and unmet need for family planning between 1990 and 2015: a systematic and comprehensive analysis // Lancet. 2013. Vol. 381. № 9878. P. 1642–1652.
68. Lopez L.M., Steiner M., Grimes D.A. et al. Strategies for communicating contraceptive effectiveness // Cochrane Database Syst. Rev. 2013. Vol. 4. CD006964.
Modern Hormonal Contraception: Evolution and Thrombophilic Risks
O.A. Pustotina
Peoples’ Friendship University of Russia
Contact person: Olga Anatolyevna Pustotina, pustotina@gmail.com
Here, published data about evolution of hormonal contraception, types and composition of modern hormonal drugs as well as therapeutic regimens and routes of administration are presented. In addition, safety data and specific effects triggered by administration of contraceptives on health of women are discussed. Comparative characteristics of action of synthetic gestagens and estrogens on risk of thrombophilic complications are analyzed.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.