Современные методы лечения метастатической меланомы с поражением головного мозга
- Аннотация
- Статья
- Ссылки
- English




Эпидемиология метастазов в головной мозг
Меланома характеризуется достаточно низкой распространенностью. Так, в России доля меланомы составляет менее 2% от всех видов злокачественных новообразований [1]. При этом меланома, наряду с раком молочной железы и раком легкого, имеет наибольшую склонность к метастазированию в головной мозг (ГМ). Частота развития метастазов в ГМ при меланоме достигает 73–75% [2, 3]. На долю меланомы приходится 6–11% всех метастатических поражений ГМ, что выводит опухоль на третье место по данному показателю [1, 2].
Прогноз заболевания у пациентов с метастазами меланомы в головной мозг
Развитие метастазов меланомы в ГМ связано с плохим прогнозом: медиана общей выживаемости (ОВ) таких пациентов до внедрения в практику современных методов терапии составляла примерно 4–5 месяцев [3–5]. С началом применения и развитием таргетной терапии (ТТ) и иммуноонкологической терапии (ИТ) эффективность лечения данной когорты пациентов существенно возросла. Это доказывают результаты исследования M. Hasanov и соавт., которые сравнили выживаемость пациентов с диагностированными метастазами в ГМ (n = 791), находящихся на лечении в одном исследовательском центре, за два пятилетних периода – 2009–2013 гг. (n = 332) и 2014–2018 гг. (n = 459). Во втором периоде пациенты чаще проходили лечение ТТ (22%) и ИТ (39%), чем в первом: 12 и 14% соответственно. При этом медиана ОВ во втором периоде возросла до 14,4 месяца по сравнению с 10,3 месяца в первом. Однолетняя и двухлетняя выживаемость также были выше во втором периоде: 56 и 39% против 45 и 27% в первом периоде соответственно (табл. 1) [5].
Симптомные и бессимптомные метастазы в головной мозг
Метастазы в ГМ могут сопровождаться развитием общемозговой или очаговой неврологической симптоматики или оставаться бессимптомными [6, 7].
Самой тяжелой группой пациентов с меланомой являются пациенты с симптомными метастазами в ГМ из-за склонности к быстрому ухудшению состояния и частой необходимости применения глюкокортикостероидов (ГКС) для контроля неврологических симптомов [6]. Наиболее частыми общемозговыми симптомами метастазов в ГМ являются головная боль, тошнота, рвота, головокружение, двоение в глазах. Специфические проявления очаговой неврологической симптоматики связаны с локализацией метастатических очагов в различных структурах ГМ и могут включать нарушения чувствительности, памяти, зрения и слуха, различные двигательные нарушения и эпилептические припадки [7, 8].
Проблема критериев симптомности метастазов в головном мозге
Наличие симптомов при метастазах опухоли в ГМ оказывает влияние на прогноз заболевания и тактику лечения пациентов [4, 6]. Однако наличие симптомов метастазов в ГМ и степень их выраженности может трактоваться по-разному. Так, в клиническом исследовании TRICOTEL авторам пришлось произвести переоценку результатов применения комбинации атезолизумаб + вемурафениб + кобиметиниб у пациентов с симптомными метастазами меланомы в ГМ в связи с неверной интерпретацией проявлений симптомности. Первично опубликованные результаты исследования были отозваны авторами, критерии симптомности метастазов в ГМ были пересмотрены, как и оценка эффективности применения комбинации. К сожалению, опубликованные повторно результаты продемонстрировали более низкую эффективность триплета атезолизумаб + вемурафениб + кобиметиниб при симптомных метастазах в ГМ [9–11].
Выработка единых критериев симптомности метастазов является важной задачей, решение которой позволит проводить более объективное сравнение эффективности разных видов лечения для пациентов с метастазами в ГМ.
Лечение пациентов с метастазами в головной мозг
Для лечения пациентов с метастазами в ГМ применяют локальные и системные методы [8]:
- локальные:
- нейрохирургическое лечение,
- дистанционная лучевая терапия: облучение всего ГМ; стереотаксическая радиотерапия (СТРТ) (в режиме радиохирургии или гипофракционирования);
- системные:
- химиотерапия,
- таргетная терапия,
- иммуноонкологическая терапия.
При планировании лечения врачу необходимо оценить размеры метастатических очагов, их количество и локализацию в ГМ. Не менее важен функциональный статус пациента с балльной оценкой по шкале Карновского или ECOG (табл. 2 и 3) [8].
Нейрохирургическое лечение
У пациентов с метастазами в ГМ нейрохирургическое лечение проводится в случае одиночных крупных метастатических очагов (максимальный диаметр очага более 25 мм или объем более 1000 мм3), у пациентов с интракраниальными рецидивами метастазов в ГМ, стабилизацией экстракраниальной болезни и высоким функциональным статусом [7]. В этом случае хирургическое удаление метастазов может способствовать уменьшению неврологической симптоматики, сохранению функционального статуса, улучшению качества жизни и увеличению ОВ, а также в ряде случаев позволяет достичь локального контроля интракраниальных метастазов [7]. Вместе с тем реальная возможность хирургического удаления метастазов с описанными характеристиками также зависит от навыков и опыта нейрохирурга и от расположения метастазов по отношению к структурам мозга.
Применение нейрохирургического лечения при множественных метастазах в ГМ в отдельных случаях может привести к улучшению качества жизни, но не к увеличению ОВ [12].
Облучение всего головного мозга
В настоящее время облучение всего головного мозга (ОВГМ) редко применяют в режиме монотерапии у пациентов с метастазами в ГМ. Большинство исследований показывают, что ОВГМ не увеличивает выживаемость у данной когорты пациентов [7], но может быть использовано в ситуациях, когда проведение нейрохирургического лечения или СТРТ не представляется возможным или целесообразным [13]. В частности, ОВГМ в самостоятельном режиме рекомендовано для пациентов с наличием 11 и более метастатических очагов в ГМ и хорошим прогнозом ОВ [8].
Кроме низкой эффективности, к недостаткам ОВГМ можно отнести неблагоприятный профиль безопасности: ОВГМ ухудшает качество жизни, увеличивает риск нейрокогнитивных расстройств, а также может быть причиной развития лейкоэнцефалопатии и социальной дезадаптации пациента. При этом риск развития лейкоэнцефалопатии возрастает с увеличением разовой дозы радиации и возрастом пациента [7, 14].
Стереотаксическая радиотерапия
В клинических исследованиях показано увеличение ОВ при применении СТРТ у пациентов с одиночными метастазами в ГМ по сравнению с использованием ОВГМ [15].
СТРТ может быть проведена в режиме радиохирургии и в режиме гипофракционирования [8].
Радиохирургия метастазов в ГМ позволяет достичь высоких показателей локального контроля [7], особенно у больных с ограниченным метастатическим поражением ГМ и максимальным диаметром очагов менее 25–30 мм [16]. Вместе с тем радиохирургия не снижает риск развития новых (дистантных) метастазов в ГМ [7].
Наиболее часто встречающимся осложнением СТРТ является радиационный некроз, который, как правило, сопровождается отеком окружающих тканей. Частота развития некроза напрямую зависит от объема облученной ткани, величины подведенной дозы и вида системной терапии (вероятность развития радиационного некроза выше при применении ингибиторов контрольных точек по сравнению с ТТ) [7, 9, 17]. В случае крупных метастатических очагов (больше 25 мм в диаметре) при необходимости подведения большей дозы излучения целесообразнее применять СТРТ в режиме гипофракционирования [7]. Это позволяет уменьшить разовую дозу излучения и снизить риск развития радиационного некроза и неврологической токсичности.
В отношении очагов небольшого размера среди исследователей нет единого мнения о преимуществах режима гипофракционирования: имеются данные и об улучшении локального контроля [18], и об отсутствии преимуществ режима гипофракционирования [15].
Системные методы лечения
Системные методы лечения у пациентов с метастазами в ГМ включают проведение химиотерапии, ТТ и ИТ. В самостоятельном варианте лечения системную противоопухолевую терапию целесообразно проводить у пациентов с небольшими по размеру, бессимптомными метастазами в ГМ [8].
Первые исследования иммунотерапии у пациентов с метастазами меланомы кожи в ГМ показали неэффективность использования только одного ниволумаба [19]. Иммунотерапия с применением двойной комбинации (ниволумаб + ипилимумаб) продемонстрировала достаточную эффективность у пациентов с бессимптомными метастазами, однако у пациентов с симптомными метастазами меланомы кожи в ГМ, по данным исследования CheckMate 204, эффективность была низкая: интракраниальная частота объективных ответов (ЧОО) составила всего 17% [20]. Поэтому для пациентов с симптомными метастазами в ГМ остается только два вида терапии – ТТ и ТТ + ИТ. Проведем непрямое сравнение результатов COMBI-MB (группа D: симптомные пациенты с мутацией в гене BRAF V600D/E/K/R) и TRICOTEL (когорта симптомных пациентов в группе пациентов с мутацией в гене BRAF) [4, 11].
Пересмотренные результаты исследования TRICOTEL оказались ниже изначально опубликованных и в сравнении с результатами исследования COMBI-MB уже не кажутся такими обнадеживающими. Так, интракраниальная ЧОО при применении комбинации дабрафениб + траметиниб была выше почти в 1,5 раза, чем при применении тройной комбинации атезолизумаб + вемурафениб + кобиметиниб. Медиана ОВ (11,5 месяца) и медиана выживаемости без прогрессирования (ВБП) (5,5 месяца) при применении комбинации дабрафениб + траметиниб также были выше, чем при применении тройной комбинации (медиана ОВ 9,0 месяца, медиана ВБП 4,5–5,1 месяца). Двойная комбинация уступала триплету только по длительности интракраниального ответа – 4,5 месяца и 6,1–7,4 месяца соответственно (табл. 4) [4, 11].
По профилю безопасности у пациентов с симптомными метастазами меланомы в ГМ комбинация дабрафениб + траметиниб значительно превосходит триплет атезолизумаб + вемурафениб + кобиметиниб. В клинических исследованиях с нежелательными явлениями (НЯ) 3–4-й степени тяжести столкнулись восемь из десяти пациентов, получавших терапию тройной комбинацией, и только пять из десяти пациентов, принимавших дабрафениб + траметиниб. Кроме того, при применении тройной комбинации несколько чаще приходилось прерывать лечение в связи с непереносимостью терапии: 22% против 18% при применении комбинации дабрафениб + траметиниб [4, 11]. Также важно помнить, что в состав триплета входит ингибитор контрольных точек атезолизумаб, а препараты этой группы способны вызывать иммуноопосредованные НЯ, которые могут переходить в хроническую форму и требовать длительной терапии ГКС [21].
Сопутствующая терапия
Для снижения степени выраженности симптомов, вызванных повышением внутричерепного давления из-за отека ГМ, пациенту с метастазами в ГМ может быть назначена терапия ГКС [8]. При назначении основного лечения следует учитывать сопутствующий прием ГКС, поскольку последние могут оказывать негативное влияние на эффективность, особенно ИТ [19, 20]. Возможное объяснение связано с тем, что ГКС повышают уровень ингибитора цистеиновой протеазы цистатина С, который, предположительно, обладает иммуносупрессорными свойствами. Высокие уровни цистатина С связывают со снижением выживаемости при всех видах рака и отсутствием ответа на иммунотерапию [22].
В случае неэффективности ГКС при стойком или нарастающем отеке и/или радиационном некрозе рекомендована терапия бевацизумабом [8].
В качестве сопутствующей терапии также возможно назначение противосудорожных препаратов [8].
Сочетание разных методов лечения
У пациентов с метастазами в ГМ допустимо сочетание различных методов лечения в зависимости от размеров метастатических очагов, их количества и локализации в ГМ, а также от функционального статуса пациента [8].
Так, для снижения риска локального рецидива после нейрохирургического лечения целесообразно проводить его в комбинации с СТРТ (предоперационная радиохирургия или послеоперационная СТРТ ложа удаленного метастатического очага) [8].
У пациентов с симптомными метастазами в ГМ противоопухолевую лекарственную терапию рекомендовано проводить в комбинации с локальным лечением метастазов в ГМ [8]. В то же время и у пациентов с бессимптомными метастазами наилучшие результаты показывает сочетанное применение системной лекарственной терапии и локальных методов лечения. Так, очень хороших результатов позволяет достичь использование ТТ комбинацией дабрафениб + траметиниб у пациентов с бессимптомными метастазами меланомы кожи в ГМ с предшествующей локальной терапией. В исследовании COMBI-MB медиана ОВ у данной группы пациентов составила 24,3 месяца [4].
Приводим два клинических случая лечения пациентов с симптомным и бессимптомным поражением ГМ.
Клинический случай 1
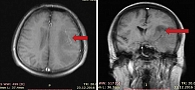
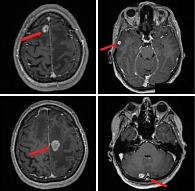
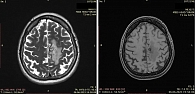
Пациенту Б., 66 лет, в декабре 2016 г. выполнена магнитно-резонансная томография (МРТ) ГМ по поводу жалоб на головную боль и потерю памяти. Выявлено объемное образование левого полушария ГМ (рис. 1).
В феврале 2017 г. пациент обратился в Архангельский клинический онкологический диспансер с результатами гистологического исследования после проведенного оперативного лечения по удалению опухоли ГМ от декабря 2016 г. Также в анамнезе проведение нефрэктомии справа и резекции нисходящей ободочной кишки в феврале 2013 г. по поводу рака левой почки (папиллярный рак почки, тип 2, светлоклеточный вариант).
В процессе диагностического поиска первичного поражения было исключено наличие диссеминированного процесса – выполнена компьютерная томография (КТ) органов грудной клетки, брюшной полости и малого таза: метастатических изменений не выявлено.
На консультации онкодерматолога в феврале 2017 г. было обнаружено и удалено путем широкого иссечения подозрительное пигментное образование в области кожи спины. По результатам гистологического исследования (ГИ) подтверждено наличие злокачественного образования – меланомы кожи.
Согласно гистологическому заключению, в коже обнаружена поверхностно-распространяющаяся меланома с началом вертикального роста, третьим уровнем инвазии по Кларку, толщина опухоли по Бреслоу – 1 мм.
Путем ГИ и иммуногистохимического исследования операционного материала (опухоль ГМ) подтверждено метастатическое новообразование, патоморфологическая картина, согласно заключению, наиболее соответствует метастазу беспигментной меланомы.
Выполнено исследование ДНК полученного образца: выявлена активирующая мутация в 15-м экзоне гена BRAF V600.
По результатам дообследования был установлен диагноз: «C43.5 злокачественная беспигментная BRAF-мутированная меланома кожи туловища; меланома кожи спины рT1аN0M1, IV стадии с метастазом в ГМ». Состояние после удаления метастаза меланомы в ГМ (декабрь 2016 г.) и широкого иссечения меланомы кожи спины (февраль 2017 г.).
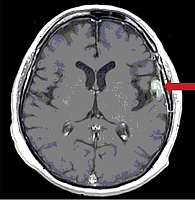
В марте 2017 г. при выполнении контрольной МРТ у пациента зарегистрирован ранний рецидив церебрального метастаза в коре левого полушария ГМ размерами 31 × 26 × 15 мм (рис. 2). Врачебным консилиумом пациенту рекомендована двойная ТТ дабрафенибом и траметинибом. В связи с отсутствием возможности назначить двойную комбинацию начата лекарственная монотерапия дабрафенибом 150 мг два раза в сутки длительно.
На фоне приема препарата из лекарственно-индуцированных осложнений отмечался эпизод пирексии до 38,5 °С с ознобом на второй день начала лечения, разрешившийся после применения парацетамола. В дальнейшем температура тела неоднократно возрастала не выше субфебрильных значений, снижалась под действием жаропонижающих средств (парацетамола по 500 мг до трех раз в сутки). Окончательное разрешение лихорадки зарегистрировано во время третьей недели приема дабрафениба. Также на третью неделю терапии возникло новое осложнение в виде развития множественных папиллом туловища: онкодерматологом проведена дерматоскопия, выполнено иссечение папиллом. Данные НЯ не потребовали снижения дозировки дабрафениба.
На фоне лечения отмечалась следующая динамика метастатического поражения ГМ по данным МРТ.
Через месяц после начала терапии (апрель 2017 г.) в полюсе левой височной доли в сравнении с исследованием от марта 2017 г. отек значительно уменьшился. В верхнелатеральных отделах определялось мягкотканное образование размером 30 × 17 × 23 мм (в сравнении с предыдущим исследованием несколько уменьшилось в размерах).
В мае 2017 г. на область церебрального метастаза проведена СТРТ в суммарной общей дозе 29,94 Гр в режиме гипофракционирования. Прием дабрафениба во время проведения радиотерапии не прекращался, после окончания СТРТ применялся дексаметазон в дозировке 4 мг внутримышечно с противоотечной целью в течение одного месяца.
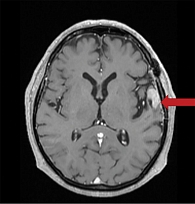
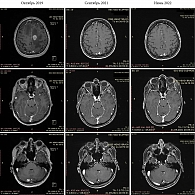
По результатам контрольной МРТ ГМ в июне 2017 г. после проведения СТРТ зафиксирована положительная динамика в сравнении с прошлым исследованием от апреля 2017 г.: уменьшение образования до размеров 23 × 22 × 13 мм (ранее 31 × 26 × 15 мм), без признаков перифокального отека (рис. 3).
В июле 2017 г. после включения в программу расширенного доступа пациент начал получать двойную ТТ: дабрафениб по 150 мг два раза в сутки, траметиниб по 2 мг один раз в сутки, длительно.
В процессе комбинированной терапии сохранялась положительная динамика. Согласно МРТ ГМ от февраля 2021 г., зарегистрировано дальнейшее уменьшение церебрального метастаза: в левой лобно-височной области сохраняется образование с четкими контурами 10 × 10 × 7 мм без признаков перифокального отека. Согласно критериям RANO, достигнута стабилизация заболевания (уменьшение максимального диаметра таргетного очага > 70%).
На последнем контрольном снимке в феврале 2024 г. отмечался максимальный регресс опухоли до размеров 9 × 10 × 5 мм, без признаков перифокального отека (рис. 4).
К настоящему моменту контроль над метастатической меланомой с метастазами в ГМ с начала приема ТТ у пациента составляет 84 месяца, продолжительность терапии первой линии – 7 лет. Путем применения нескольких методов для контроля над симптомами со стороны очагового образования ГМ пациент продолжает находиться в удовлетворительном состоянии, ECOG-статус – 1. Клинически значимые НЯ, способствующие прерыванию терапии, снижению дозировки препаратов, за время лечения не зарегистрированы.
Клинический случай 2
Пациентка В., 47 лет, впервые заметила появление новообразования на коже правой голени в марте 2013 г. Спустя два года, в марте 2015 г., стала отмечать повышенную травматизацию и кровоточивость места поражения, в результате чего была направлена в Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический), где выполнено иссечение новообразования.
По результатам ГИ подтвердилось наличие злокачественного образования: эпителиоидно-клеточная узловая меланома кожи средней трети правой голени, без изъязвления эпидермиса, уровень инвазии по Кларку – 4, толщина по Бреслоу – 0,8 мм, периневральная и лимфоваскулярная инвазии не выявлены, край резекции вне опухоли (pT1a).
Согласно AJCC 8th edition melanoma TNM, общий объем поражения соответствует IA стадии.
Через 21 месяц динамического наблюдения, в феврале 2017 г., возникло прогрессирование заболевания в области первичного локального лечения: внутрикожный метастаз правой голени. Повторно выполнено иссечение образования, рецидив заболевания подтвержден гистологически. В марте 2017 г. в другом лечебном учреждении начата вакцинотерапия. Спустя 14 месяцев с момента иссечения очага локального прогрессирования зарегистрировано распространение процесса: метастазы в подвздошные лимфоузлы справа. В июле 2018 г. выполнена подвздошная лимфаденэктомия справа.
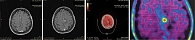
С сентября 2018 г. по август 2019 г. проводилась терапия интерфероном альфа-2b по 3 млн ЕД через день. В сентябре 2019 г. – клиническое прогрессирование, у пациентки появились жалобы на периодические головные боли и головокружение. Выполнена МРТ ГМ, на которой было подтверждено прогрессирование (рис. 5).
В октябре 2019 г. проведено дообследование пациентки:
- выполнено молекулярно-генетическое исследование (МГИ): обнаружена мутация в гене BRAF V600E;
- по результатам КТ органов грудной клетки, брюшной полости и малого таза с внутривенным контрастированием данных за наличие вторичного поражения не получено.
В конце октября 2019 г. после получения результатов МГИ начата комбинированная ТТ первой линии: дабрафениб по 150 мг два раза в день и траметиниб по 2 мг один раз в день, длительно. На фоне лечения отмечался частичный регресс очагов ГМ (рис. 6).
В процессе получения терапии из лекарственно-индуцированных НЯ в первый месяц лечения возникла гипертермия 1-й степени. Отмены или коррекции дозировки препаратов не потребовалось, общая переносимость препаратов была хорошей.
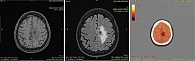
В октябре 2022 г., суммарно спустя 35 месяцев от начала лечения, зарегистрировано прогрессирование процесса в виде продолженного роста одного из очагов ГМ, дополнительно подтвержденного методом позитронно-эмиссионной и компьютерной томографии (ПЭТ/КТ) (рис. 7).
В ноябре 2022 г. выполнена СТРТ аппаратом гамма-нож на метастатический очаг ГМ на фоне продолжения терапии первой линии дабрафенибом и траметинибом.
При контрольной МРТ ГМ в марте 2023 г. заподозрено прогрессирование процесса в виде продолженного роста локально пролеченного очага: согласно заключению, отмечается увеличение размеров образования на границе левой лобной и правой теменной долей. По результатам ПЭТ/КТ – так же (рис. 8).
После очередного контрольного исследования (МРТ с внутривенным контрастированием) в июне 2023 г. прогрессирование не подтверждено (рис. 9).
По последним обследованиям от марта 2024 г. данных за прогрессирование нет. В течение 54 месяцев пациентка продолжает прием комбинированной ТТ дабрафениб + траметиниб в первой линии. За это время на область местного прогрессирования вторичного образования ГМ проведена СТРТ с положительным эффектом. Дальнейшего прогрессирования заболевания по данным визуализирующих методов не наблюдается. За время лечения достигнут частичный регресс заболевания, пациентка продолжает получать терапию с хорошей переносимостью (клинически значимых нежелательных событий за весь период наблюдения не возникло).
Выводы
- Для лечения пациентов с метастазами в ГМ применяют локальные и системные методы [8].
- Проведение нейрохирургического лечения у пациентов с одиночными метастазами в ГМ может повысить ОВ [7].
- Облучение всего ГМ характеризуется неблагоприятным профилем безопасности и не увеличивает ОВ у пациентов с метастазами в ГМ [7].
- Проведение только системной противоопухолевой терапии целесообразно у пациентов с небольшими по размеру, бессимптомными метастазами в ГМ [8]. Эффективность ИТ у пациентов с симптомными метастазами меланомы в ГМ была достаточно низкой [22].
- Пациентам с симптомными метастазами меланомы в ГМ часто требуется прием ГКС, которые могут снижать ответ опухоли на любую лекарственную терапию, особенно на иммунотерапию.
- При непрямом сравнении у пациентов с симптомными метастазами меланомы кожи в ГМ комбинация дабрафениб + траметиниб превосходила триплет атезолизумаб + вемурафениб + кобиметиниб и по эффективности, и по безопасности [4, 10]. Комбинация различных вариантов локальной и системной терапии позволяет повысить эффективность лечения у пациентов с метастазами в ГМ.
N.V. Zhukova, PhD, M.M. Kramchaninov, G.G. Rakhmankulova, V.A. Mirgorodskaya, M.N. Nechaeva, PhD
St. Petersburg State University
St. Petersburg Clinical Scientific and Practical Center for Specialized Types of Medical Care (Oncological)
Arkhangelsk Clinical Oncological Dispensary
St. Petersburg State Pediatric Medical University
Severodvinsk City Clinical Hospital No. 2 emergency Medical Service
Contact person: Natalia V. Zhukova, drnvz@yandex.ru
Melanoma, along with breast cancer and lung cancer, has the greatest tendency to metastasize to the brain (GM). In patients with asymptomatic metastases in GM, antitumor drug therapy is recommended in combination with local treatment of metastases in GM. At the same time, in patients with asymptomatic metastases, the best results are shown by the combined use of systemic drug therapy (the use of TT with a combination of dabrafenib + trametinib) and previous local therapy. The article presents two clinical cases of treatment of patients with symptomatic and asymptomatic GM lesions.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.