Современные подходы к использованию Мидокалма в локальной инъекционной терапии болевых синдромов
- Аннотация
- Статья
- Ссылки
- English


Введение
Отличительной особенностью современного этапа развития неврологии является приверженность принципам доказательной медицины и междисциплинарному подходу в решении актуальных клинических задач. Среди них особое место занимает проблема боли, которая по праву считается terra incognita, поскольку четкие патофизиологические основы данного феномена до конца не ясны, а терапия требует огромных материальных затрат и интеллектуальных ресурсов для достижения положительных результатов. Более того, часто человек, испытывающий боль, в ходе лечения становится заложником других проблем, поскольку нерациональное использование анальгезирующих средств в подавляющем большинстве случаев приводит к развитию осложнений [1]. Как правило, это вызвано системным действием препаратов. Очевидно, что чем дальше от источника боли расположена точка приложения того или иного лекарственного вещества, тем в большем количестве его необходимо ввести в организм и, следовательно, тем выше вероятность развития осложнений. Поэтому в последнее время большинство специалистов предлагают при выборе терапевтической тактики использовать доктрину «таргетного воздействия» на боль.
В связи с этим развитие теоретических и практических основ локальной терапии боли считается приоритетным направлением современной практической неврологии. Естественно, что усовершенствование медицинской помощи пациентам с болевыми синдромами базируется на результатах фундаментальных исследований, без которых немыслима нейрофизиологическая и нейрохимическая интерпретация ноцицептивного трафика и его «релейных станций». В частности, концепция о периферической и центральной сенситизации стала ключевой в конструировании элементов комплексной терапии хронической боли. Тем не менее поддержание активности патологических систем, формирующихся при хронической боли, осуществляется в основном за счет первичного источника болевой импульсации. Следовательно, его купирование можно расценивать как вариант этиотропной терапии в рамках любой нозологической формы [2, 3].
Как и во всем, что касается лечения пациентов, в основе каждой манипуляции, направленной на купирование болевого синдрома, должно лежать четкое, обоснованное показание. Говоря о локальной инъекционной терапии (ЛИТ), любая процедура, проводимая врачом, должна быть соответствующим образом тщательно спланирована, подготовлена и проведена. Необходимы прочные знания основ неврологии и четкие представления об анатомо-топографических взаимоотношениях нервных образований в зоне проведения ЛИТ. Врач должен знать методику процедуры и иметь практические навыки ее выполнения, быть осведомленным о тех осложнениях, которые могут возникнуть во время и после выполнения той или иной ЛИТ.
Во избежание разного рода осложнений врачу следует придерживаться следующих рекомендаций.
1. Поскольку ЛИТ представляет собой преднамеренное опасное повреждение тканей организма пациента, требуется обязательное предварительное разъяснение пациенту цели процедуры, получение от него информированного согласия на ее проведение. Важный фактор эффективности процедуры – это эмоциональное состояние больного. В этой связи очевидна целесообразность проведения психопрофилактической подготовки пациента за несколько дней до блокады, что позволит избежать обморочного состояния от одного только прикосновения или вида иглы.
2. Основным правилом при проведении ЛИТ является строжайшее соблюдение принципов асептики и антисептики, как того требует любое хирургическое вмешательство. Место инъекции рекомендуется оросить кожным антисептиком до полного увлажнения, с последующей выдержкой после орошения. Протирать место инъекции антисептическим раствором не следует, поскольку высока вероятность попадания микроорганизмов из кожных пор в область проведения процедуры.
3. Эффективность ЛИТ зависит не от количества вводимых препаратов, а от точности попадания в намеченную зону и правильности выполнения манипуляции.
4. Независимо от места блокады следует придерживаться следующего алгоритма ЛИТ:
-
наполнение шприца медикаментами производится непосредственно перед проведением блокады;
-
игла, с помощью которой производился набор препарата в шприц, перед инъекцией должна быть заменена на новую;
-
после введения иглы шприца в ткани на нужную глубину непосредственно перед инъекцией лекарственного препарата всегда необходимо проводить пробную аспирацию для исключения попадания иглы в сосуд.
Основные противопоказания и побочные эффекты ЛИТ приведены в таблицах 1 и 2.5. В период проведения ЛИТ врач или его ассистент должны осуществлять непрерывный контроль за состоянием пациента. При возникновении выраженных вегетативных реакций манипуляция должна быть прекращена и начаты мероприятия по их купированию. Наблюдение за больным должно быть продолжено и после проведения ЛИТ – от 30 минут до трех часов в зависимости от вида процедуры.
6. После окончания процедуры больному на место инъекции должна быть наложена асептическая повязка, которая может быть снята только по истечении шести-семи часов.
Среди большой группы препаратов, используемых при ЛИТ болевых синдромов, особое место занимает раствор толперизона гидрохлорида (Мидокалм). Последний представляет собой миорелаксант центрального действия, который, ингибируя мышечное напряжение, вызывает непрямой анальгезирующий эффект без сопутствующей седации. Обладая мембраностабилизирующим свойством и имея химическое родство с лидокаином, препарат оказывает также прямое антиболевое действие. Кроме того, Мидокалм способен блокировать альфа-адренорецепторы, локализованные в сосудах, что объясняет его отчетливое вазодилатирующее свойство [4].
На наш взгляд, наиболее оправданно применение Мидокалма в составе ЛИТ при тех заболеваниях, в патогенезе которых патологическое мышечное напряжение играет решающую роль: головной боли напряжения;
-
синдроме передней лестничной мышцы;
-
дорсалгиях;
-
синдроме грушевидной мышцы.
Головная боль напряжения
Головная боль напряжения является наиболее распространенным типом головной боли. Название этой нозологической формы объединяет, с одной стороны, исторически сложившееся понимание вовлечения перикраниальной мускулатуры в формирование головной боли, а с другой – частое ее возникновение в ответ на стрессовые ситуации.
Выделяют эпизодическую (с частотой болевых приступов не более чем 15 дней в месяц) и хроническую головную боль напряжения, возникающую 15 и более дней в месяц. В рамках эпизодической выделяют головную боль с редкими приступами (менее чем один день в месяц) и частыми (от одного до 14 дней в месяц).
Эпидемиологические исследования показали, что эпизодическая головная боль напряжения наблюдается у 42% женщин и 36% мужчин, хроническая – у 1,7 и 0,9% соответственно. Максимальная распространенность эпизодической головной боли напряжения приходится на возраст 30–39 лет [1].
К факторам, провоцирующим головную боль напряжения, относятся эмоциональные расстройства, физическое утомление, длительные однообразные статические нагрузки (работа за компьютером, вождение машины). Повышение тонуса перикраниальной мускулатуры, иногда выявляемое при электромиографии, послужило основой для дискуссии об участии мышечной системы в патогенетических механизмах развития головной боли напряжения. Показано, что повышение чувствительности мышц связано с тяжестью головной боли напряжения. Однако тщательно проведенные исследования не подтвердили наличие повышенной ЭМГ-активности мышц головы и шеи как первопричины головной боли напряжения. В то же время воздействие на алгические точки височной, грудино-ключично-сосцевидной, верхней порции трапециевидной мышц формирует отраженную боль, воспроизводящую картину головной боли напряжения. Ряд исследователей считают, что головная боль напряжения обусловлена ишемией мышечных волокон, вызванной повышением напряжения мышц. Следствием этого становятся сдавление артерий и гипоксия, развитие венозного застоя в мышцах, что приводит к накоплению в ней продуктов метаболизма, отеку и болезненности. Кроме того, предполагается, что повышение концентрации калия, возникающее во время длительного напряжения мышцы, также стимулирует ее ноцицепторы и вызывает боль (рис. 1) [2].
Головная боль напряжения часто развивается у больных с эмоциональными тревожными и депрессивными расстройствами. При этом состояние тревоги считается более характерным для эпизодических приступов, а депрессия – для хронических. Следует помнить, что в части случаев головная боль напряжения служит клиническим проявлением так называемой маскированной депрессии, при которой собственно эмоциональные депрессивные расстройства скрываются под маской других неврологических или соматических нарушений.
Головная боль напряжения характеризуется двусторонней локализацией, легкой или умеренной интенсивностью и не усиливается при физической активности. Данная патология не сопровождается рвотой, однако могут отмечаться легкая тошнота, фото- или фонофобия. Больные описывают этот вид головной боли как сдавливающую, стягивающую, сжимающую с локализацией в форме «шлема» или «каски».
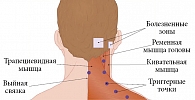
Достаточно часто при осмотре таких больных отмечается повышенное напряжение трапециевидных мышц и мышц задней шейной группы, в ряде случаев выявляется дисфункция височно-нижнечелюстного сустава. Выделяют головную боль напряжения с вовлечением перикраниальной мускулатуры (когда при ее пальпации возникает болезненность в определенных точках) и без таковой. При пальпации чаще всего наблюдается повышенная чувствительность верхней порции трапециевидной мышцы, ременной, височной, грудино-ключично-сосцевидной и жевательной мышц.
Замечено, что в большинстве случаев хроническая головная боль напряжения формируется из эпизодической, реже она начинается сразу как хроническая. Иногда наблюдается постепенная трансформация мигрени в хроническую головную боль напряжения. Интенсивность боли нарастает, когда головная боль напряжения комбинируется с мигренью.
Для ЛИТ головной боли напряжения используется 1 мл раствора Мидокалма и 4 мл 0,5%-ного раствора лидокаина в шприце объемом 5 мл. Введение осуществляется в толщу трапециевидной, ременной и височной мышц в зоны наибольшей болезненности, выявляемые при предварительной пальпации (так называемые триггерные точки) [2, 5]. Под триггерными точками понимают участок уплотненной скелетной мышцы или фасции диаметром 1,5–3 мм, обладающий острой болезненностью, которая значительно менее выражена в нескольких миллиметрах от его границы. В ряде гистохимических исследований было продемонстрировано, что в зоне триггерных точек происходит накопление различных биологически активных веществ – кининов, простагландинов, гистамина и пр. Предполагается, что они выделяются тучными клетками в связи с миогенной ишемией, гипоксией и ацидозом. Важная особенность триггерных точек заключается в их значимом влиянии на мышечный тонус, боль и ряд вегетативных реакций, однако в отличие от обычных экстерорецепторов триггерные точки обладают большей реактивностью. Вот почему важно осуществлять инъекции не просто в толщу напряженных мышц, а таргетно в триггерные точки. Целесообразно провести пять сеансов ЛИТ с интервалом в три дня. Локализация инъекций определяется каждый раз заново, исходя из картирования триггерных точек в трапециевидной, ременной и височной мышцах.
Синдром передней лестничной мышцы
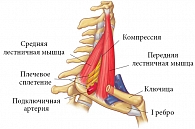
Синдром передней лестничной мышцы – это результат рефлекторного напряжения передней лестничной мышцы вследствие раздражения корешков спинномозговых нервов при патологии шейного отдела позвоночника на уровне С4–С6 (рис. 2). Заболевание чаще всего встречается в возрасте 40–60 лет в равной степени как у мужчин, так и у женщин. Решающим фактором в развитии синдрома передней лестничной мышцы является длительная статическая экспозиция головы и верхних конечностей в неудобном положении (очень часто из-за длительных разговоров по телефону при зажатой между головой и плечом трубке). Для синдрома передней лестничной мышцы характерны три группы симптомов.
Для клинического подтверждения синдрома передней лестничной мышцы проводятся следующие дифференциально-диагностические тесты.1. Симптомы, связанные собственно с musculus scalenus anterior. Пациента беспокоят боль в передней или задней области плеча, чувство тяжести в руке, а также болезненное уплотнение в передней лестничной мышце при пальпации. Из-за этого отмечается ограничение объема активных движений в шейном отделе позвоночника. Болевой синдром усиливается в ночное время, при наклонах головы, отведении или резких движениях рукой и при глубоком вдохе.
2. Симптомы компрессии двигательных и чувствительных волокон плечевого сплетения. Компрессия нижнего ствола плечевого сплетения в межлестничной щели вызывает боль и нарушение чувствительности в IV и V пальцах руки, а также иногда в ульнарной зоне предплечья. При выраженной компрессии появляются слабость в руке, особенно в ее дистальных отделах, гипотония и гипотрофия мышц гипотенара, стойкая гипестезия в зоне иннервации локтевого нерва.
3. Симптомы сосудистой компрессии. При компрессии arteria subclavia наблюдаются ослабление пульса на лучевой артерии, отечность кисти (в основном над основаниями II–IV пальцев и на тыльной поверхности кисти, особенно в утренние часы) и припухлость в надключичной области (псевдотумор Ковтуновича) вследствие лимфостаза. Нередки вегетативно-сосудистые расстройства, появляющиеся интермиттирующими ишемическими кризами с болями и побледнением пальцев, напоминающие болезнь Рейно.
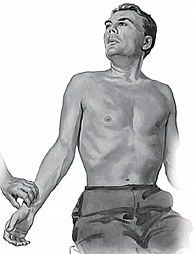
Для ЛИТ используется шприц объемом 2 мл, содержащий 1 мл Мидокалма, с иглой длиной 2,5 см (рис. 4). Перед началом процедуры врач пальпаторно определяет локализацию передней лестничной мышцы, располагающейся над ключицей позади грудино-ключично-сосцевидной мышцы. Пациента просят сделать глубокий вдох, задержать дыхание и повернуть голову в здоровую сторону. При этом врач обхватывает средним и указательным пальцами переднюю лестничную мышцу, одновременно оттягивая кнутри ключичную порцию musculus sternocleidomastoideus. Введение иглы осуществляется перпендикулярно поверхности кожи в мышцу на глубину не более 0,5 см, где после предварительной аспирации производится инъекция Мидокалма. В случае правильного выполнения ЛИТ уже через несколько минут пациент отметит значительное снижение интенсивности болевого синдрома.1. В положении больного сидя определяют пульсацию на лучевых артериях, затем больному предлагают сделать глубокий вдох, поднять голову (несколько запрокинуть назад) и наклонить ее в направлении больной конечности. В этом положении происходит напряжение передней лестничной мышцы, и в случае компрессионного синдрома пульсация на лучевой артерии исчезает или становится крайне слабой (проба Адсона) (рис. 3).
2. Поза больного по стойке «смирно» с отодвиганием плеч назад и вниз может приводить к компрессии межлестничного пространства, следствием чего также становятся ослабление или исчезновение пульса на лучевой артерии.
Дорсалгии
Вертеброгенные неврологические синдромы относятся к одним из самых распространенных хронических заболеваний человека. Статодинамические нагрузки позвоночного двигательного сегмента вызывают деформацию тканей (в первую очередь межпозвонковых дисков и желтой связки) и оказываются причиной постоянного раздражения рецепторов, в особенности болевых. Кроме того, деформированные ткани могут компримировать спинной мозг и нервные корешки.
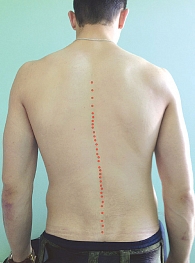
Болевые синдромы и неврологические расстройства наиболее часто вызываются дегенеративно-дистрофическими изменениями позвоночника (остеохондрозом и спондилоартрозом). Различают компрессионные и рефлекторные неврологические синдромы. Рефлекторные неврологические синдромы не только преобладают в структуре вертеброгенных поражений периферической нервной системы, но и являются маркером дебюта заболевания. Их развитие обусловлено тем, что в состав позвоночного сегмента входят не только диск, фиброзные ткани и смежные позвонки, но и соединяющие их мышцы, которые под влиянием болевой импульсации (особенно из задней продольной связки) рефлекторно напрягаются и формируют рефлекторные мышечно-тонические нарушения. Асимметричное напряжение приводит к локальному сколиозу («симптом распорки») (рис. 5). Рефлекторный дефанс глубоких и поверхностных длинных мышц позвоночника создает естественную защитную иммобилизацию. Аналогичная иммобилизация создается за счет фиброза диска. Однако функциональное выключение одного звена кинематической цепи позвоночника ведет к перегрузке соседних, что ускоряет дегенеративно-дистрофические процессы в них.
Компрессионные синдромы возникают при значительно выраженных изменениях позвоночника, которые деформируют спинномозговой корешок, корешковые или спинальные сосуды и даже спинной мозг. Непосредственной причиной компрессии вышеуказанных образований являются задние остеофиты, боковые и срединные грыжи дисков, деформирующие позвоночный канал.
Компрессионные радикулопатии могут возникнуть на любом уровне, но наиболее часто сдавливаются корешки L5 и S1 (за счет парамедианных грыж L4–L5 и L5–S1). Большая межпозвонковая грыжа может компримировать сразу два корешка, а деформация дурального мешка приводит к натяжению соседних корешковых манжеток (би- и мультирадикулярные синдромы).
Верхнепоясничные корешки L1, L2, L3 компримируются межпозвонковой грыжей не так часто (иногда вовлечение в патологический процесс носит онкогенный характер). Радикулопатии этого уровня проявляются болью и выпадениями чувствительности по внутренней и передней поверхности бедра, слабостью, гипотрофией и гипотонией четырехглавой мышцы бедра, снижением или выпадением коленного рефлекса.
Радикулопатия L4 характеризуется парестезиями и резкой болью, иррадиирущей по внутренней и передней поверхности бедра до колена, двигательными нарушениями в четырехглавой мышце, снижением или отсутствием коленного рефлекса.
При радикулопатии L5 боль иррадиирует от поясницы в ягодицу, по наружному краю бедра и передненаружной поверхности голени до внутреннего края стопы и большого пальца. В дистальных отделах дерматома выявляется гипестезия. Определяются снижение силы разгибателя I пальца, гипотония и гипотрофия передней большеберцовой мышцы.
Радикулопатия S1 – это самая динамичная клиническая форма, поскольку грыжа диска на этом уровне не удерживается долго узкой и тонкой задней продольной связкой. Заболевание часто начинается сразу с корешковой симптоматики без стадии люмбаго и люмбалгии. Боль иррадиирует от ягодицы или от поясницы и ягодицы по наружнозаднему краю бедра, по наружному краю голени до наружного края стопы или IV–V пальцев. Здесь же возникают парестезии и гипестезия, обнаруживается снижение или отсутствие ахиллова рефлекса. Двигательные расстройства проявляются снижением силы трехглавой мышцы голени и сгибателей пальцев стопы (особенно сгибателя V пальца), гипотонией и гипотрофией икроножной мышцы.
В качестве основного варианта ЛИТ при дорсалгиях в клинической практике применяется паравертебральная мышечная блокада. Для процедуры используется шприц объемом 2 мл, содержащий 1%-ный раствор лидокаина, и шприц объемом 10 мл, в котором находится комбинированный раствор, состоящий из 9 мл 0,5%-ного раствора лидокаина и 1 мл раствора Мидокалма. Выбор места введения иглы определяют с учетом особенностей клинической картины, а также пальпаторно – точка максимальной болезненности обычно соответствует проекции вовлеченного в патологический процесс корешка [2, 5]. Инъекция производится билатерально паравертебрально с отступлением от срединной линии на 3–4 см. После предварительной обработки кожи раствором антисептика тонкой иглой внутрикожно, в месте предполагаемого введения иглы, в проекции необходимого промежутка между позвонками вводят раствор лидокаина до образования «лимонной корочки» (первый шприц 2 мл). После этого в область образованного желвака перпендикулярно поверхности кожи вводят иглу (второй шприц 10 мл) вглубь мышечной ткани, где после предварительной аспирации вводят 5 мл комбинированного раствора (лидокаин + Мидокалм). Затем процедуру повторяют симметрично с другой стороны. Целесообразно выполнить пять сеансов ЛИТ с интервалом в три дня.
Синдром грушевидной мышцы
По нашим данным, синдром грушевидной мышцы встречается в 5% случаев среди пациентов с болью в нижней части спины. Он проявляется симптомокомплексом прогрессирующей невропатии седалищного нерва. Дебютирует с боли и вегетативных нарушений в голени и стопе (возникают ощущения зябкости, жжения, одеревенения), к которым присоединяются признаки моторного и сенсорного дефицита в зоне иннервации nervus ischiadicus. При нарастании сдавления нижней ягодичной артерии формируются признаки перемежающейся хромоты (больной вынужден останавливаться при ходьбе, кожа ноги при этом бледнеет). Имеет место положительная проба Бонне (усиление боли в голени и стопе при приведении бедра).
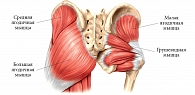
Грушевидная мышца начинается в области капсулы крестцово-подвздошного сочленения. Дальше через большое седалищное отверстие ее пучки выходят из малого таза, после переходят в короткое и узкое сухожилие, которое прикрепляется к медиальной поверхности большого вертела бедра. Здесь же находится слизистая сумка.
В области седалищного отверстия грушевидная мышца образует верхнюю и нижнюю щели. Верхняя щель занята верхней ягодичной артерией и одноименным нервом. В нижней щели расположены нижняя ягодичная артерия и седалищный нерв (рис. 6). Иннервируется грушевидная мышца ветвями крестцового сплетения из спинномозговых корешков S1 и S2. Кровоснабжение поступает из верхней и нижней ягодичных артерий.
Основной функцией грушевидной мышцы является отведение бедра и ротация его кнаружи. Она одновременно разгибает и отводит бедро, вращает его при резкой флексорно-абдукционной позе, а также препятствует быстрой внутренней ротации бедра в первой стадии ходьбы и бега.
Ствол седалищного нерва в 90% случаев выходит в ягодичную область из полости таза под грушевидной мышцей. В 10% случаев он при переходе в ягодичную область прободает грушевидную мышцу. Таким образом, при возникновении синдрома грушевидной мышцы может быть:
компрессия седалищного нерва между крестцово-остистой связкой и измененной грушевидной мышцей;
компрессия седалищного нерва измененной грушевидной мышцей при его прохождении через мышцу (вариант развития седалищного нерва).
Для процедуры ЛИТ грушевидной мышцы используется шприц объемом 2 мл, содержащий 1%-ный раствор лидокаина, и шприц 10 мл, в который набирают комбинированный раствор, состоящий из 10 мл 0,25%-ного раствора лидокаина и 1 мл Мидокалма. Инъекция осуществляется согласно специальному протоколу [2].
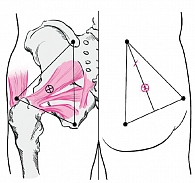
Врач пальпаторно определяет анатомические точки-ориентиры (задняя верхняя ость подвздошной кости, вершина большого вертела, седалищный бугор) и соединяет их раствором йода, образуя треугольник. Затем из угла, вершиной которого служит место соединения задней верхней ости подвздошной кости с крестцом, опускают биссектрису. Последнюю делят на три равные части и отмечают точку между нижней и средней третями биссектрисы (рис. 7). В искомую точку тонкой иглой (1,6 см) внутрикожно вводят 1–2 мл 1%-ного раствора лидокаина до образования «лимонной корочки» (первый шприц 2 мл). После этого в область образованного желвака перпендикулярно поверхности кожи вводят длинную иглу (второй шприц 10 мл) на глубину 5–6 см до ощущения сопротивления, которое оказывает игле крестцово-остистая связка. Далее врач извлекает иглу на 1 см и, направляя ее несколько под углом 30° к прежней позиции, вновь вводит ее на глубину 1 см. После предварительной аспирации (возможно попадание в сосуд) вводится лекарственный раствор. По завершении процедуры ЛИТ пациенту рекомендуется провести 30 минут лежа на животе. Сеансы ЛИТ целесообразно повторить несколько раз с интервалом в три дня.
В целом, по нашим данным, использование Мидокалма в качестве основного лекарственного препарата для ЛИТ алгических синдромов у пациентов неврологического профиля (более 500 больных) позволило уменьшить интенсивность боли в среднем на 65% по цифровой оценочной шкале (Numerical Rating Scale – NRS) уже после первой инъекции. Это более чем в два раза эффективнее стандартной схемы выполнения ЛИТ с применением местных анестетиков (новокаина, лидокаина) и витаминов группы В (p < 0,05) (табл. 3). Расчет одного из наиболее показательных параметров эффективности того или иного препарата – индекса NNT (Number Needed to Treat – число больных, которых необходимо пролечить для получения заданного отличия от плацебо) показал, что для 50%-ного снижения интенсивности боли на фоне ЛИТ с использованием Мидокалма индекс NNT равен 2,3 (p < 0,05). Это свидетельствует о высокой эффективности препарата. При этом выраженность нежелательных явлений, оцениваемая с помощью шкалы оценки побочного действия UKU (UKU Side-Effect Rating Scale), была крайне низкая. Практически все пациенты хорошо переносили Мидокалм, серьезные нежелательные явления отсутствовали. Более того, применение Мидокалма в составе комбинированного раствора для ЛИТ болевых синдромов различной локализации позволяет снизить дозировку и длительность приема нестероидных противовоспалительных препаратов (p < 0,05) как препаратов сопутствующей терапии, а также продолжительность течения болевого синдрома как такового.
Заключение
Наш опыт применения раствора Мидокалма в составе ЛИТ болевых синдромов различной локализации свидетельствует о несомненной целесообразности использования данного препарата в повседневной клинической практике ввиду его высокой эффективности, хорошей переносимости и возможного снижения потребности пациентов в дополнительном приеме нестероидных противовоспалительных препаратов.
I.N. Samartsev, S.A. Zhivolupov, N.A. Rashidov, S.N. Bardakov
Military Medical Academy named after S.M. Kirov
Contact person: Igor Nikolayevich Samartsev, alpinaigor@mail.ru
Here we outline features of using centrally acting muscle relaxant Mydocalm as a part of local injection therapy during tension headaches, scalenus anterior syndrome, dorsalgia, and piriformis syndrome. Experience of using Mydocalm solution evidences about undoubted practicability of its application in routine clinical practice due to its high efficacy, good tolerability and opportunity for lowering demand in additional administration of nonsteroidal anti-inflammatory drugs during pain syndrome of various anatomical location.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.