количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Супрессивная терапия в лечении пациенток с бесплодием и наружным генитальным эндометриозом
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №6 (55)
- Аннотация
- Статья
- Ссылки
- English
Обследовано 92 пациентки с диагнозом «рецидив эндометриоидных кист яичников», обратившихся в клинику по поводу бесплодия. Диагноз был установлен при лапароскопии и подтвержден гистологическим исследованием. Диагностированы II–IV стадии распространенности наружного генитального эндометриоза по классификации Американского общества репродуктивной медицины (ASRM). Проведен сравнительный анализ результатов лечения бесплодия у пациенток с эндометриоидными кистами после хирургического (n = 40, II группа) и комбинированного лечения (хирургическое вмешательство в сочетании с послеоперационной терапией агонистами гонадотропин-рилизинг-гормона (аГнРГ), n = 52, I группа). В течение 1 года после лечения успешная беременность наступила у 41 (78,8%) пациентки I группы (комбинированное лечение) и у 18 (45%) пациенток II группы (только оперативное лечение). По данным лапароскопии рецидив эндометриоидных кист достоверно чаще наблюдался после изолированного хирургического лечения по сравнению с комбинированным лечением. После повторного хирургического и медикаментозного лечения аГнРГ препаратом Бусерелин-депо (6 инъекций) частота наступления беременности у пациенток I группы (ранее получали комбинированное лечение) независимо от стадии заболевания была достоверно выше, чем во II группе (ранее получали только хирургическое лечение): в течение 12 месяцев беременность наступила у 55,8% в I группе и у 30,1% во II группе.
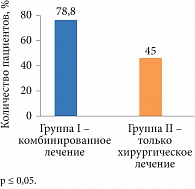
Рис. 1. Частота наступления беременности по данным анамнеза
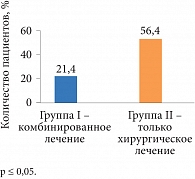
Рис. 2. Частота спаечного процесса по результатам настоящего исследования
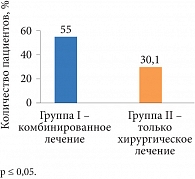
Рис. 3. Частота наступления беременности после повторной лапароскопичекой операции по результатам настоящего исследования
Несмотря на более чем вековую историю изучения разных аспектов медико-социальной проблемы эндометриоза, она продолжает оставаться в центре внимания. В структуре гинекологической заболеваемости эндометриоз занимает третье место. Это заболевание поражает до 50% женщин детородного возраста, приводя к функциональным расстройствам и структурным изменениям в репродуктивной системе. В общей популяции частота генитального эндометриоза составляет 10–15% [1], а при бесплодии варьирует от 12 до 80% [1, 2].
Этиология и патогенез эндометриоза и в наше время являются предметом изучения. Существует множество разнообразных теорий, пытающихся объяснить возникновение эндометриоза. Многочисленные исследования показали, что в патогенезе развития заболевания значительную роль играют нейроэндокринные нарушения, изменения иммунного статуса и наследственные факторы [3]. Доказано, что эндометриоз – эстрогензависимое заболевание [4]. Тем не менее, как считают многие ученые, истинные причины заболевания до сих пор не выявлены.
Наиболее значимым в проблеме эндометриоза является его сочетание с бесплодием и хронической тазовой болью, диагностируемым у 46% и 80% больных соответственно [2]. В структуре причин женского бесплодия эндометриоз занимает второе место (после воспалительных заболеваний матки и ее придатков). К этиологическим факторам возникновения бесплодия у больных с эндометриозом относятся изменения в перитонеальной жидкости, нарушение процессов овуляции, развитие иммуносупрессии, трубно-перитонеальные нарушения. Важная роль отводится ретроградной менструации.
Учитывая, что простагландин Е2 является не только главным медиатором боли, связанной с эндометриозом, но и веществом, которое способствует экспрессии ароматазы в гетеротопическом эндометрии, супрессивная терапия агонистами гонадотропин-рилизинг-гормона (аГнРГ) способна блокировать синтез простагландинов и таким образом снижать экспрессию ароматазы [5].
Терапия, направленная на создание медикаментозной менопаузы, способствует подавлению пролиферативной активности эндометриоидных гетеротопий, то есть их способности к имплантации.
Агонисты гонадотропин-рилизинг-гормона в настоящее время наиболее эффективны в лечении тяжелых форм заболевания, в частности при эндометриоидных кистах яичников. Уровень эстрогенов в крови на фоне терапии аГнРГ становится менее 100 пмоль/л, то есть соответствует содержанию этих гормонов на фоне медикаментозной менопаузы. Соответственно снижается синтез эстрадиола, прогестерона и тестостерона яичниками [6]. Кроме того, аГнРГ способствуют снижению интра- и постоперационных осложнений, особенно спайкообразования.
При создании выраженной гипоэстрогении происходят атрофические изменения эндометриоидных очагов, что подтверждает гистологическое исследование биоптатов, взятых до и после лечения.
К сожалению, лечение аГнРГ, как и другими средствами (в том числе хирургическими), не обеспечивает предотвращения персистенции или рецидивов заболевания, особенно если оно с самого начала протекает в инфильтративной форме. Частота рецидивов заболевания через 5 лет составляет 53%, а при тяжелых, инфильтративных формах персистенция заболевания и возобновление симптомов достигает 73% [7].
Гипоэстрогения, вызванная препаратами аГнРГ, сопровождается у большинства пациенток симптомами различной степени выраженности в зависимости от применяемых доз и длительности лечения: приливы жара (до 20–30 раз в день у 90% пациенток), сухость слизистой оболочки влагалища, нарушение сна, эмоциональная лабильность, раздражительность, головные боли и головокружения. Механизмы развития этих явлений связаны с эстрогенным дефицитом и успешно купируются «терапией прикрытия» низкими дозами препаратов для заместительной гормональной терапии (например, Фемостон 1/5).
Сегодня общепринята следующая тактика лечения больных с эндометриоидными кистами яичников: на первом этапе – обязательное проведение хирургического лечения, на втором – в зависимости от степени распространенности процесса, в частности при эндометриомах яичников, показано проведение супрессивной терапии аГнРГ, что было показано в наших предыдущих исследованиях [8, 9]. Однако практикующие врачи до настоящего времени предпочитают проведение только хирургического лечения, что, на наш взгляд, неоправданно.
Цель исследования
Провести сравнительный анализ результатов лечения бесплодия у пациенток с эндометриоидными кистами после хирургического и комбинированного лечения с применением аГнРГ в послеоперационном периоде (по данным динамической лапароскопии).
Материал и методы исследования
Обследовано 92 пациентки с диагнозом «рецидив эндометриоидных кист яичников», обратившихся в клинику по поводу бесплодия.
У всех больных диагностированы II–IV стадии распространенности заболевания по классификации Американского общества репродуктивной медицины (American Society for Reproductive Medicine – ASRM). Диагноз был установлен при лапароскопии и подтвержден гистологическим исследованием.
Согласно критериям включения, в исследование вошли женщины репродуктивного возраста с наружным генитальным эндометриозом и бесплодием (рецидив эндометриоидных кист).
Применялись следующие критерии невключения: предраковые заболевания и рак любой локализации, подростковый возраст, климактерий, хронические заболевания других органов и систем, мужской фактор бесплодия.
Пациентки были разделены на две группы. Первую группу составили 52 пациентки репродуктивного возраста (56,5% от общего числа больных), средний возраст – 32,6 ± 2,3 года, которым ранее было проведено комбинированное лечение (хирургическое и медикаментозное – аГнРГ – препаратом Бусерелин-депо 3,75 мг 1 раз в 28 дней в/м 4–6 инъекций) в нашей клинике по поводу эндометриом яичников и бесплодия.
Вторую группу составили 40 пациенток репродуктивного возраста, средний возраст – 30,8 ± 2,1 лет (43,5% от общего числа больных), с бесплодием, ранее оперированных в других клиниках лапароскопически по поводу эндометриом яичников без последующей медикаментозной терапии аГнРГ.
В ходе исследования пациентки I и II группы были разделены на две подгруппы по стадии распространенности наружного генитального эндометриоза (НГЭ). Подгруппа IА включила 20, подгруппа IIA – 26 пациенток (III и IV стадия НГЭ), подгруппа IБ – 32 и IIБ – 14 (II стадия заболевания) пациенток.
В работе использовали общеклинические и лабораторно-инструментальные исследования: ультразвуковое исследование (УЗИ), лапароскопию, гистологическое исследование удаленных во время операции тканей. Биохимические исследования проводились в сети лабораторий INVITRO г. Москвы.
Результаты исследования и их обсуждение
При анализе общеклинических данных выявлено достоверное различие (р < 0,05) по возрасту менархе. У пациенток подгрупп А (III и IV стадии НГЭ) возраст менархе был достоверно более ранним по сравнению с пациентками подгрупп Б (II стадия НГЭ): 10,9 ± 0,4 и 11,4 ± 0,5 года соответственно. Та же закономерность прослеживается по длительности менструального цикла. У обследованных пациенток с эндометриоидными кистами больших размеров (III и IV стадии НГЭ) из подгрупп IА и IIА достоверно чаще (р < 0,05) наблюдали короткий менструальный цикл (средняя длительность 25 ± 1,6 дня). У пациенток подгруппы Б (II стадия НГЭ) длительность цикла составила в среднем 29 ± 1,2 дня. Несомненно, при раннем возрасте менархе и коротком менструальном цикле ретроградная менструация возникает чаще, что является риском возникновения НГЭ, и отмечено в работах других исследователей [10].
Дисменорея одинаково часто встречалась у подавляющего большинства всех пациенток и достоверно не различалась по подгруппам I и II группы (р > 0,05), то есть не зависела от стадии НГЭ.
Наши данные согласуются с результатами международного исследования Global Study of Women’s Health (GSWH) [11]. Известно, что дисменорея сопровождается гиперпростагландинемией, являющейся ключевым механизмом локальной гиперэстрогении в эндометриоидных гетеротопиях.
Семейный анамнез больных показал достоверно большую (р < 0,05) по сравнению с популяционными данными частоту гинекологических заболеваний, в том числе генитального эндометриоза, у обследованных пациенток независимо от стадии заболевания. Так, по данным J.M. Wheeler, результаты генетических исследований показали, что вероятность развития эндометриоза в 3–10 раз выше среди родственниц первой степени родства женщин с этим заболеванием по сравнению с женщинами контрольной группы без эндометриоза [3, 12]. По мнению Л.В. Адамян, E.Н. Андреевой [3], наследственная предрасположенность к эндометриозам определяется сложными генетическими дефектами, которые могут затрагивать несколько генов.
В анамнезе у 78,8% (n = 41) пациенток I группы в течение года после комбинированного лечения (хирургического и медикаментозного препаратом Бусерелин-депо 3,75 мг в количестве 4–6 инъекций) наступила беременность, закончившаяся своевременными родами (рис. 1). Все 52 пациентки не выполняли рекомендации по применению комбинированных оральных контрацептивов (КОК) или прогестагенов с целью профилактики рецидива наружного генитального эндометриоза и в дальнейшем обратились по поводу рецидива эндометриом яичников. В предыдущих исследованиях нами показана протективная роль диеногестсодержащих КОК в профилактике рецидива эндометриоидных кист яичников [13].
Во II группе в анамнезе частота наступления беременности, закончившейся родами, составила 45% (n = 18). Это на 33,8% ниже, чем в I группе (p < 0,05), что можно объяснить проведением только хирургического лечения.
В клинических рекомендациях по лечению эндометриоза Европейского общества репродуктологов и эмбриологов (European Society for Human Reproduction and Embryology – ESHRE, 2008) показано, что послеоперационное лечение аГнРГ способствует уменьшению интенсивности болей, а применение аГнРГ в течение 6 месяцев приводит к отсрочке рецидива болевого синдрома более чем на 12 месяцев.
По нашим данным, частота рецидивов заболевания положительно коррелировала со стадией распространенности эндометриоза. У 21 пациентки в IА подгруппе (III и IV стадии НЭГ) рецидив эндометриом яичников наблюдали в более поздние сроки – 3,2 ± 0,5 лет. У 26 пациенток из IIА подгруппы (III и IV стадии НЭГ) рецидив заболевания отмечен через 1,5 ± 0,4 года. У пациенток со II стадией наружного эндометриоза (26 пациенток из подгруппы IБ и 14 пациенток из подгруппы IIБ) рецидив заболевания отмечался в более поздние сроки. Более того, у большинства пациенток I группы, ранее получавших комбинированную терапию, стадия НГЭ при повторной лапароскопии была достоверно меньше по сравнению с обследованными пациентками II группы.
Результаты гормональных исследований у обследованных пациенток не выявили каких-либо отклонений от нормы и не различались по группам (р > 0,05).
Подобные результаты получены в работах других авторов [11]; рецидив эндометриоза после лапароскопии наблюдается даже у опытных врачей, общий уровень рецидивов через 5 лет составляет почти 20%.
Известно, что механизмом формирования эндометриоидных кист является инвагинация первичного очага в толщу яичника (то есть ложе кисты – это кора яичника с примордиальными фолликулами), вследствие чего происходит снижение овариального резерва. Количественное значение антимюллерова гормона (АМГ) отражает фолликулярный (овариальный) резерв яичников. Отметим: уровень АМГ у пациенток с рецидивом эндометриоидных кист яичников в подгруппах IА и IIA (III и IV стадии НГЭ) был достоверно ниже по сравнению с пациентками подгрупп IБ и IIБ (II стадия) – 1,6 ± 0,1 нг/мл и 2,2 ± 0,3 нг/мл соответственно (р < 0,05), что согласуется с данными как зарубежной [6], так и отечественной литературы [14]. В связи с этим в последние годы большое внимание уделяется максимально «бережному» удалению эндометриоидных кист яичников с использованием биполярной коагуляции [15, 16].
Напомним, что первым этапом терапии у обследованных нами пациенток с рецидивами эндометриоидных кист яичников было хирургическое лечение эндоскопическим доступом: удаление эндометриоидных кист яичников с максимальным сохранением здоровой ткани во избежание снижения овариального резерва [15, 16]. Вторым этапом комбинированного лечения являлось назначение супрессивной гормональной терапии. Препаратами, обладающими такими свойствами, являются аГнРГ (в частности Бусерелин-депо), длительно используемые в лечении эндометриоза. Учитывая наши предыдущие исследования [8, 9], которые показали высокую эффективность комбинированной терапии (хирургическое лечение в сочетании с применением аГнРГ), пациенткам с бесплодием назначали аГнРГ (Бусерелин-депо 3,75 мг 1 раз в 28 дней в/м в количестве 6 инъекций) с «терапией прикрытия». В качестве «терапии прикрытия» использовали 1 мг 17-бета-эстрадиола в комбинации с 5 мг дидрогестерона, что соответствует рекомендациям Американского общества акушеров и гинекологов (American College of Obstetricians and Gynecologists – ACOG).
В дальнейшем, после восстановления менструального цикла, все пациентки получали гестагены во вторую фазу, в качестве предимплантационной подготовки (дидрогестерон по 20 мг/сут с 16-го по 25-й день цикла). При наступлении беременности продолжали прием препарата до 14–16 недель с целью профилактики иммуноконфликтных ранних потерь беременности. Положительный эффект предимплантационной подготовки гестагенами показан в многочисленных исследованиях [17].
Важнейшим критерием эффективности терапии наружного генитального эндометриоза является наступление беременности. Частота наступления беременности после комбинированного лечения у пациенток I группы независимо от стадии заболевания была достоверно выше, чем во II группе, ранее получавшей только хирургическое лечение (р < 0,05) (рис. 1). Эти результаты можно объяснить достоверно большей частотой спаечного процесса у пациенток II группы (р < 0,05), чем у пациенток I группы, которые получали комбинированную терапию, – у 21,5% и 56,4% пациенток соответственно (рис. 2).
После повторного хирургического и медикаментозного лечения аГнРГ Бусерелин-депо (6 инъекций) в течение 12 месяцев беременность наступила в I группе у 55,8% (n = 29), во II группе – у 30,1% (n = 12) (межгрупповые различия достигли уровня статистической значимости) (рис. 3). При этом частота наступления беременности достоверно не различалась по подгруппам, то есть наступление беременности не зависело от стадии НГЭ.
По результатам предыдущих исследований, проводившихся в нашей клинике, наибольшая частота беременностей наступает в первые 6–12 месяцев после окончания комбинированного лечения, что подтверждено данными настоящего исследования [8, 9]. Учитывая возраст пациенток и повторную лапароскопическую операцию по поводу рецидива заболевания, соответственно снижения овариальных резервов, в случае ненаступления беременности в течение года пациенткам рекомендовали экстракорпоральное оплодотворение.
Таким образом, суммарная эффективность комбинированного лечения бесплодия (хирургическое и медикаментозное аГнРГ) у пациенток с рецидивами эндометриоидных кист составила 44,6%.
Заключение
Супрессивная терапия эндометриоидных кист яичников с использованием аГнРГ, направленная на подавление овуляции и снижение уровня эстрогенов, является патогенетически обоснованной. Комбинированное (хирургическое и медикаментозное) лечение повышает частоту наступления беременности у пациенток с наружным генитальным эндометриозом, снижает частоту спайкообразования и является действенной профилактикой рецидива эндометриоза.
1. Адамян Л.В., Сухих Г.Т. Состояние и перспективы репродуктивного здоровья населения России // Современные технологии в диагностике и лечении гинекологических заболеваний. М.: Медицина, 2007. С. 5–19.
2. Leyland N., Casper R., Laberge P., Singh S.S.; SOGC. Endometriosis: diagnosis and management // J. Obstet. Gynaecol. Can. 2010. Vol. 32. № 7. Suppl. 2. P. S1–S32.
3. Адамян Л.В., Кулаков В.И., Андреева Е.Н. Эндометриозы: руководство для врачей. 2-е изд. М.: Медицина, 2006. 416 с.
4. Ашрафян Л.А., Киселев В.И., Муйжнек Е.Л. Патогенетическая профилактика рака репродуктивных органов. М.: Молодая гвардия, 2009. 171 с.
5. Shimizu Y., Mita S., Takeuchi T. et al. Dienogest, a synthetic progestin, inhibits prostaglandin E2 production and aromatase expression by human endometrial epithelial cells in a spheroid culture system // Steroids. 2011. Vol. 76. № 1–2. P. 60–67.
6. Lee D.Y., Young Kim N., Jae Kim M. et al. Effects of laparoscopic surgery on serum anti-Müllerian hormone levels in reproductive-aged women with endometrioma // Gynecol. Endocrinol. 2011. Vol. 27. № 10. P. 733–736.
7. Lemos N.A., Arbo E., Scalco R. et al. Decreased anti-Müllerian hormone and altered ovarian follicular cohort in infertile patients with mild/minimal endometriosis // Fertil. Steril. 2008. Vol. 89. № 5. P. 1064–1068.
8. Горбунова Е.М. Повышение эффективности лечения бесплодия у пациенток с наружным генитальным эндометриозом: автореф. дис. … канд. мед. наук. М., 2009. 27 с.
9. Григорова Л.В. Восстановление репродуктивного здоровья у больных с наружным генитальным эндометриозом: автореф. дис. … канд. мед. наук. М., 2008. 26 с.
10. Nothnick W.B. Treating endometriosis as an autoimmune disease // Fertil. Steril. 2001. Vol. 76. № 2. P. 223–231.
11. Johnson N.P., Hummelshoj L.; World Endometriosis Society Montpellier Consortium. Consensus on current management of endometriosis // Hum. Reprod. 2013. Vol. 28. № 6. P. 1552–1568.
12. Wheeler J.M. Epidemiology of endometriosis-associated infertility // J. Reprod. Med. 1989. Vol. 34. № 1. P. 41–46.
13. Геворкян М.А., Манухин И.Б., Манухина Е.И. и др. Профилактика рецидива наружного генитального эндометриоза // Проблемы репродукции. 2008. № 1. С. 78–80.
14. Александрова Н.В., Марченко Л.А., Гус А.И. и др. Новые возможности верификации диагноза при преждевременном снижении овариального резерва // Современные технологии в диагностике и лечении гинекологических заболеваний. М., 2006. С. 45–46.
15. El-Sahwi K., El-Faham M., Ei-Sahwi S. Laparoscopic management of ovarian endometriomas: incision peeling versus coagulation // Proceedings of XIX World Congress on Fertility & Sterility. Durban, South Africa, 2007. FC1502. P. 78.
16. Exacoustos C., Zupi E., Amadio A. et al. Laparoscopic removal of endometriomas: sonographic evaluation of residual functioning ovarian tissue // Am. J. Obstet. Gynecol. 2004. Vol. 191. № 1. P. 68–72.
17. Серов В.Н., Прилепская В.Н., Овсянникова Т.В. Гинекологическая эндокринология. М.: МЕДпресс-информ, 2004. 528 с.
Suppressive therapy in the treatment of patients with infertility and external genital endometriosis
M.A. Gevorkyan, Ye.I. Manukhina, M.V. Prokhorova, N.R. Karakashyan
State Budgetary Educational Institution for Higher Professional Education ‘Moscow State University of Medicine and Dentistry named after A.I. Evdokimov’
Contact person: Marianna Aramovna Gevorkyan, marianagevorkyan@mail.ru
Our study involved 92 infertile women with recurrent ovarian endomeriomas confirmed by laparoscopy and histology. The patients had external genital endometriosis stages II-IV (ASRM, American Society for Reproductive Medicine). The results of infertility treatment in patients with ovarian endometrioid cysts were assessed after combination intervention (group I, surgery + postoperative gonadotrophin-releasing hormone agonists (aGnRH), n=52) and isolated surgical operation (group II, n=40). Within one year following the intervention, successful pregnancies were more frequent in the combination treatment group – in 41 (78.8%) of patients compared to 18 (45%) of patients in isolated surgery group. Laparoscopy-confirmed recurrence of endometriod cysts was significantly more frequent in the isolated surgical treatment group. After second surgical operations followed by aGnRH (Buserelin-depo) in both groups, significantly more pregnancies were achieved in the group I (in 55.8%) compared to the group II (30.1%); the results were independent of the disease stage.
Новости на тему
15.07.2022 10:00:00
28.06.2022 18:20:00
30.04.2014
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.