Топические лекарственные препараты для лечения инфекционно-воспалительных заболеваний уха и глаз
- Аннотация
- Статья
- Ссылки
- English



Введение
Инфекционно-воспалительные заболевания уха и глаз относятся к распространенным патологиям – частота встречаемости до 11% (свыше половины – у детей до пяти лет) [1] и 3,5% [2] соответственно.
Инфекционно-воспалительные заболевания глаз объединяют широкий спектр патологий, включая кератит (воспаление роговицы), конъюнктивит и кератоконъюнктивит, блефарит (воспаление краев век), ячмень (гордеолум, воспаление волосяного мешочка ресницы или сальной железы Цейса), склерит и эписклерит, иридоциклит (воспаление радужки и ресничного тела), эндофтальмит (воспаление внутренних оболочек глазного яблока) [3].
Как правило, возбудителями блефарита являются стафилококки, Streptococcus pyogenes, Pseudomonas aeruginosa, конъюнктивита – стафилококки, S. pneumoniae, P. aeruginosa, Klebsiella pneumoniae и Escherichia coli, дакриоцистита – стафилококки, P. aeruginosa и E. coli, кератита – коагулазонегативные стафилококки, P. aeruginosa и Staphylococcus aureus, эндофтальмита – S. viridians, S. pneumoniae и коагулазонегативные стафилококки [4]. Следует отметить, что конъюнктивит имеет преимущественно вирусную этиологию и в 60–90% случаев вызывается аденовирусами [3]. Наиболее характерными симптомами бактериального кератита, конъюнктивита и кератоконъюнктивита являются боль, слезотечение, инъекция сосудов конъюнктивы, ухудшение или затуманивание зрения и гнойное отделяемое. Эндофтальмит сопровождается сильной болью, покраснением глаз, ухудшением зрения и гипопионом [3].
Инфекционно-воспалительные заболевания уха, подлежащие местной терапии, включают острые и хронические наружные и средние отиты. В 90% случаев возбудителями наружного отита являются бактерии, чаще P. aeruginosa (20–60%), S. aureus (10–70%), S. epidermidis (до 9%) и бета-гемолитические стрептококки (до 5%). Отмечается высокая распространенность коинфекций, в большинстве случаев вызываемых P. aeruginosa и S. aureus [5, 6]. Проявлением наружного отита может быть локализованный фурункул (обычно вызываемый S. aureus) или диффузная инфекция всего слухового прохода (острый диффузный наружный отит). К характерным симптомам острого наружного отита относятся выраженная боль, эритема, зуд, оторея и отек ушного канала, иногда приводящий к снижению слуха [6].
Основными возбудителями острого среднего отита являются S. pneumoniae (49%) и Haemophilus influenzae (29%). Moraxella catarrhalis обнаруживается, по разным данным, у 6–28% пациентов, нередко в составе коинфекций с указанными бактериями. S. pyogenes обусловливают до 30% случаев развития острого среднего отита [7, 8]. Наиболее характерно возникновение среднего отита у детей в возрасте от трех месяцев до трех лет. Симптоматика заболевания включает сильную боль, повышение температуры тела, отечность слухового канала и барабанной перепонки, сопровождающиеся ухудшением слуха, при перфорации барабанной перепонки – гнойное, серозное или смешанное отделяемое [9].
Рациональное применение лекарственных средств различных групп позволяет добиться быстрой элиминации патогенных микроорганизмов, уменьшения воспаления, боли и зуда и в конечном итоге повышения качества жизни больного. Одним из оптимальных способов решения этой задачи считается использование комбинированных лекарственных препаратов, содержащих активные вещества этиотропной и патогенетической направленности. Речь идет об антибактериальных, противовоспалительных средствах и местных анестетиках.
Антибактериальные средства
Антибактериальные средства, входящие в состав монокомпонентных и комбинированных препаратов для топического применения при болезнях уха и глаз, включают [10]:
1) антибиотики:
- аминогликозиды (тобрамицин, гентамицин, неомицин, фрамицетин, нетилмицин);
- полипептиды (полимиксин В, колистиметат натрия, грамицидин);
- тетрациклин (тетрациклин, ролитетрациклин);
- амфениколы (хлорамфеникол);
- ансамицины (рифамицин);
2) синтетические химиотерапевтические средства:
- фторхинолоны (ципрофлоксацин, левофлоксацин, офлоксацин, моксифлоксацин);
- сульфаниламиды (сульфацетамид);
3) антисептики (кислота борная, цинка сульфат, бензилдиметил-миристоиламино-пропиламмоний, пиклосидин).
Выбор антимикробных лекарственных средств в офтальмологии и оториноларингологии основан на их активности в отношении наиболее часто встречающихся патогенов, фармакокинетике, интраокулярной биодоступности и проникновении во внутреннее ухо, а также вероятности развития системных нежелательных эффектов. Основными проблемами при выборе являются резистентность микроорганизмов, низкая тканевая биодоступность и токсичность препаратов [7, 11].
Как и при инфекциях других локализаций, продолжительность терапии при заболеваниях уха и глаз зависит от тяжести заболевания и динамики процесса, но не менее одной недели. При чрезмерно длительном использовании антибактериальных средств существует значительный риск суперинфекции. Использование комбинаций антибиотиков в общем случае нежелательно, но может быть рекомендовано при выявлении по результатам культивирования высокорезистентных штаммов микроорганизмов [11].
Антибиотики
Группа аминогликозидов, включающая тобрамицин, гентамицин, неомицин и фрамицетин, при заболеваниях уха и глаз применяется уже давно. Эти антибиотики оказывают дозозависимое бактерицидное действие за счет связывания с 30S-субъединицей бактериальной рибосомы и нарушения элонгации синтезируемого белка, что приводит к некорректной трансляции матричной РНК [12]. Аминогликозиды активны в отношении большинства грамотрицательных аэробных и факультативно анаэробных бактерий и малоактивны против грамотрицательных анаэробов и большинства грамположительных микроорганизмов. Гентамицин в наибольшей степени активен против S. aureus, включая полирезистентные штаммы, и Haemophilus influenzae, тобрамицин – против P. aeruginosa. Чувствительность метициллинрезистентного S. aureus (MRSA) к тобрамицину на территории Европы превышает 50% [13].
Нетилмицин высокоактивен против H. influenzae и других распространенных патогенов, высокоэффективен против гентамицин- и тобрамицин-резистентных грамотрицательных палочек [14], а также может превосходить гентамицин по клинической эффективности при бактериальных инфекциях глаз [15]. Фрамицетин идентичен по структуре неомицину B (> 90% неомицина) [16].
Системная абсорбция аминогликозидов при местном применении составляет от 0,5 до 5%, при этом воспаление среднего уха способствует их проникновению как во внутреннее ухо, так и в системный кровоток. Аминогликозиды обладают нефро- и ототоксичностью при системной абсорбции (наибольшая ототоксичность характерна для неомицина), а также могут вызывать отек сетчатки, интраретинальные кровоизлияния и нарушения зрения, в том числе при топическом применении [17–19]. Некоторые токсичные продукты воспаления или распада бактерий потенцируют ототоксические эффекты аминогликозидов [7].
Полимиксин В – смесь полимиксинов B1, B1-I, B2, B3 и B6, полипептидный антибиотик, оказывающий бактерицидный эффект за счет связывания негативно заряженных сайтов на поверхности липополисахаридного слоя и нарушения электростатического равновесия и целостности наружной мембраны, приводящего к лизису клетки. Таким образом, характерная особенность этого антибиотика заключается в связывании и инактивировании бактериальных эндотоксинов липополисахаридной природы. К полимиксину B чувствительны многие грамотрицательные (H. influenzae, P. aeruginosa, Enterobacter spp., E. coli), но не грамположительные микроорганизмы. Особое клиническое значение имеет активность препарата в отношении P. aeruginosa, которая напрямую зависит от концентрации [20].
Препарат характеризуется перекрестной резистентностью с колистином, а также перекрестной аллергенностью с аминогликозидами. Препарат плохо проникает через тканевые и гистогематические барьеры, в связи с чем развитие системных нежелательных реакций при инстилляции глазных капель маловероятно. При истончении или перфорации барабанной перепонки полимиксин B может вызывать ототоксические реакции, выраженность которых сопоставима или превосходит таковую аминогликозидных антибиотиков [7, 21, 22].
Колистиметат натрия (полимиксин Е) – циклический полипептидный антибиотик, родственный по структуре и схожий по свойствам с полимиксином В. Как и последний, колистин нарушает проницаемость внешней мембраны бактерий, что сопровождается гибелью клеток. Колистин высокоэффективен в отношении P. aeruginosa и других грамотрицательных бактерий (H. influenzae, Citrobacter spp., Enterobacter spp.), а также некоторых грибов, но не активен против S. aureus. Важным преимуществом данного препарата является отсутствие перекрестной резистентности с другими антибиотиками широкого спектра действия. Колистин может использоваться при инфекционно-воспалительных заболеваниях глаза, вызванных мультирезистентной P. aeruginosa [23, 24].
Способность колистиметата натрия проникать через слизистую оболочку глаза достаточно низкая, однако его абсорбция повышается при воспалении. Наиболее значимые системные побочные эффекты колистина включают нейро- и нефротоксические реакции, но риск их развития на фоне применения препаратов в рекомендованных режимах минимален [25].
Тетрациклин – антибиотик – родоначальник группы тетрациклинов. Оказывает бактериостатическое действие за счет подавления синтеза белка вследствие нарушения образования комплекса между транспортной РНК и рибосомой. Активен в отношении многих грамположительных (Staphylococcus spp., включая S. aureus, E. coli) и грамотрицательных микроорганизмов (H. influenzae, Neisseria gonorrhoeae, Chlamydia trachomatis, Mycoplasma spp.) и не действует на P. aeruginosa, S. pyogenes, Proteus spp., Serratia spp.
Тетрациклин создает значительные концентрации в слезной жидкости, проникает в ткани глаза через неповрежденный эпителий, накапливается в водянистой влаге, сосудистой оболочке и сетчатке глаза, а также достаточно хорошо всасывается в системный кровоток. Использование мазей обеспечивает высокую интраокулярную биодоступность тетрациклина по сравнению с водными растворами [26].
Ролитетрациклин – полусинтетическое производное-пролекарство тетрациклина, отличающееся повышенной стабильностью в водных растворах [27].
Тетрациклин дополнительно подавляет коллагенолитический процесс при химических ожогах роговицы [28] и уменьшает сухость глаз за счет ингибирования матриксных металлопротеиназ и продукции провоспалительных цитокинов [29]. При нарушении барьерной функции барабанной перепонки тетрациклин повреждает волосковые клетки, однако риск явлений ототоксичности при его использовании ниже, чем на фоне применения полимиксинов и хлорамфеникола [30].
Хлорамфеникол – антибиотик бактериостатического действия, ингибирующий биосинтез белка на уровне 50S-субъединицы рибосомы на этапе трансфера аминокислот, переносимых тРНК. Хлорамфеникол активен в отношении многих видов грамположительных (Staphylococcus spp., Streptococcus spp.) и грамотрицательных бактерий (N. gonorrhoeae, H. influenzae, E. coli). Устойчивость микроорганизмов, в том числе S. aureus, к хлорамфениколу развивается относительно медленно [13].
При местном применении хлорамфеникол проникает в водянистую влагу, системный кровоток и центральную нервную систему, хорошо распределяется в жидкостях организма (ликвор, желчь, грудное молоко), проникает через плацентарный барьер. Случаи гипоплазии костного мозга вследствие длительного инстилляционного применения хлорамфеникола редки [10]. Ототоксические реакции при топическом применении хлорамфеникола у человека встречаются достаточно редко [7, 30].
Грамицидин (грамицидин D) – пептидный антибиотик, состоящий из изомеров грамицидина A, B и C в соотношении 80, 5 и 15%. Грамицидины обладают ионофорной активностью и образуют поры в мембранах бактериальных клеток и органелл, что приводит к потере клеткой электролитов, нарушению ионных градиентов, блокаде репликации ДНК, биосинтеза белка и продукции АТФ. Спектр действия грамицидина D ограничен грамположительными бактериями, такими как S. aureus, S. pneumoniae и S. pyogenes, однако активность препарата наблюдается и в отношении полирезистентных патогенов [31–33]. Токсические реакции на грамицидин со стороны слухового аппарата и органов зрения в литературе не описаны.
Рифамицин – антибиотик из группы ансамицинов, оказывающий бактерицидное действие путем комплексообразования с ДНК-зависимой РНК-полимеразой, что нарушает процесс транскрипции. Препарат проявляет активность в отношении Staphylococcus spp., Streptococcus spp. (в том числе S. pneumoniae), N. gonorrhoeae, в более высоких концентрациях – также E. coli и Proteus spp. [34]. Препараты рифамицина – одни из немногих, которые могут быть использованы при перфорации барабанной перепонки [10].
Характерным побочным эффектом рифамицина является розовая окраска барабанной перепонки, видимая при отоскопии, а также окрашивание биологических жидкостей в красно-розовый цвет. Рифамицин не обладает ототоксичностью и может применяться при перфоративных острых средних отитах без риска развития ототоксических реакций. При местном использовании в форме ушных капель препарат характеризуется низкой системной абсорбцией, но может отягощать существующие заболевания печени [10, 34]. Рифамицин характеризуется невысоким сенсибилизирующим потенциалом, а также не вступает в перекрестное взаимодействие с другими перечисленными антибиотиками [34].
Синтетические антибактериальные средства
Фторхинолоны – бактерицидные средства широкого спектра действия, фторированные производные 4-хинолона. Механизм действия фторхинолонов заключается в ингибировании бактериальной ДНК-топоизомеразы II (ДНК-гиразы) и, в значительно меньшей степени, – ДНК-топоизомеразы IV – ферментов, участвующих в процессах компактизации и репликации ДНК, транскрипции, расхождения хромосом и клеточного деления.
Ципрофлоксацин оказывает клинически значимое бактерицидное действие на активные и покоящиеся формы многих аэробных грамположительных (S. aureus, S. epidermidis, S. pneumoniae) и грамотрицательных микроорганизмов (H. influenzae, P. aeruginosa, S. marcescens). In vitro подтверждена варьирующаяся активность соединения против штаммов M. catarrhalis и N. gonorrhoeae. Умеренной чувствительностью к препарату обладает C. trachomatis. Норфлоксацин высокоактивен против Neisseria spp., M. catarrhalis, Pseudomonas spp., Chlamydia spp., а также стафилококков и стрептококков [35].
Бактерицидная активность фторхинолонов первого поколения (ципрофлоксацин, норфлоксацин и офлоксацин) сравнима с таковой представителя второго поколения – левофлоксацина, но последний может быть более эффективен против атипичных возбудителей бактериальных инфекций глаза и стрептококков [36]. Левофлоксацин также высокоэффективен в отношении мультирезистентных изолятов. Фторхинолоны второго (левофлоксацин) и третьего поколений (моксифлоксацин) высокоэффективны против как грамотрицательных, так и грамположительных бактерий, обеспечивают микробиологическую эрадикацию в течение достаточно коротких курсов лечения [37].
В сравнительных исследованиях инстилляции глазных капель левофлоксацина обеспечивали создание большей концентрации активного вещества в слезе, водянистой влаге и стекловидном теле по сравнению с офлоксацином и ципрофлоксацином. Проникновение левофлоксацина в переднюю камеру глаза облегчается механизмом его активного транспорта. Применение комбинации фторхинолонов и препаратов, содержащих соли металлов (цинка сульфат), ассоциируется со значительным снижением проникающей способности антибактериальных агентов [36]. Препараты фторхинолонов могут использоваться при перфорации барабанной перепонки [10].
Частота побочных эффектов на фоне терапии левофлоксацином сравнима с таковой при использовании плацебо [36]. Левофлоксацин также обладает наименьшей токсичностью для кератоцитов и эндотелиоцитов in vitro по сравнению с другими фторхинолонами [38]. Перекрестная резистентность бактерий развивается только в пределах группы хинолонов и не распространяется на препараты других групп, например бета-лактамные или аминогликозидные антибиотики. Резистентность бактерий к фторхинолонам развивается сравнительно медленно и может исчезать со временем [36]. Тем не менее прослеживается тенденция к распространению резистентности к ципрофлоксацину среди штаммов P. aeruginosa, N. gonorrhoeae, E. coli и K. pneumoniae [39].
Сульфацетамид – производное сульфаниламида широкого спектра действия. Механизм действия сульфаниламидов основан на их структурном сходстве с парааминобензойной кислотой (ПАБК), что обеспечивает их конкурентный антагонизм. Вытесняя ПАБК из связи с дигидроптероатсинтетазой, сульфаниламиды нарушают синтез дигидро- и тетрагидрофолиевой кислот, а впоследствии – нуклеиновых кислот у бактерий. Сульфацетамид активен в отношении грамположительных (S. aureus, S. pneumoniae) и грамотрицательных микроорганизмов (H. influenzae, Neisseria spp., Chlamydia spp., E. coli), однако в последнее время распространенность резистентных к сульфаниламидам штаммов значительно возросла [40].
При использовании глазных капель сульфацетамид хорошо всасывается и создает высокие концентрации в водянистой влаге, синовиальной, плевральной и перитонеальной жидкостях [41]. В настоящий момент разработаны полимерные пленки, содержащие раствор сульфацетамида, обеспечивающие его контролируемое высвобождение и бóльшую интраокулярную биодоступность [40]. Топические препараты сульфаниламидов редко вызывают системные побочные эффекты, однако обладают достаточно высоким аллергизирующим потенциалом [41].
Антисептики играют вспомогательную роль в топической терапии заболеваний уха и глаз, но при бактериальном конъюнктивите могут использоваться в дополнение к фторхинолонам (например, бензилдиметил-миристоиламино-пропиламмоний, пиклосидин) [42].
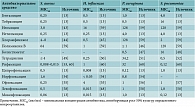
Сравнительная in vitro активность антибактериальных средств в отношении микроорганизмов, наиболее часто вызывающих инфекции уха и глаз, отражена в табл. 1 [13, 43–60].
Противогрибковые средства
Клотримазол – противогрибковое средство группы имидазолов. Его механизм действия заключается в изменении проницаемости клеточных мембран за счет влияния на синтез эргостерола и связывания с фосфолипидами клеточной стенки грибов. Клотримазол подавляет синтез белков, липидов, нуклеиновых кислот, полисахаридов, нарушает электролитный обмен и репликацию ДНК. Он активен в отношении дерматофитов (Epidermophyton floccosum, Microsporum canis, Trichophyton rubrum), дрожжей (Candida spp.), простейших (Trichomonas vaginalis) и некоторых грамположительных бактерий [61]. В отношении Aspergillus spp. препарат не активен. Монокомпонентные препараты клотримазола практически не обладают ототоксичностью [62, 63], однако в лечении наружных отитов он используется в основном при наличии бактериально-грибковых ассоциаций в виде фиксированных комбинаций с антибактериальным, противовоспалительным и анестезирующим компонентами.
Основными возбудителями грибкового поражения наружного слухового прохода являются плесневые грибы родов Aspergillus, Penicillium, а также дрожжеподобные грибы рода Candida. При кандидозном наружном отите могут быть использованы 1%-ные растворы клотримазола, нафтифина или хлорнитрофенола в виде аппликаций на турундах 5–10 минут каждая два раза в сутки в течение 10–14 дней. Терапию можно продолжить в течение 14 дней после стихания клинических признаков и/или до получения трехкратного отрицательного лабораторного анализа. При наружном отите, вызванном плесневыми грибами, препаратом выбора для проведения местного лечения является 1%-ный раствор нафтифина, применяемый по аналогичной схеме, но время экспозиции – 10–15 минут. Средняя длительность применения препаратов составляет примерно четыре недели [64, 65].
Стероидные противовоспалительные средства
Глюкокортикоиды (ГК) в офтальмологии и оториноларингологии используются в топических формах (глазные, ушные и назальные капли, глазные мази) в качестве местных противовоспалительных средств самостоятельно или в составе комбинированных препаратов. ГК подавляют выработку медиаторов воспаления, угнетают пролиферацию Т-лимфоцитов, активность В-лимфоцитов и выработку иммуноглобулинов, ингибируют интраретинальную миграцию иммунных клеток, снижают экспрессию фактора роста VEGF и уменьшают проницаемость гематоретинального барьера. При местном применении ГК оказывают выраженный противовоспалительный, противоаллергический, противозудный, антиэкссудативный и антипролиферативный эффекты [66, 67].
Показания к применению ГК в офтальмологии включают заболевания глаз аллергической природы (дерматит век, блефарит, конъюнктивит и кератоконъюнктивит), воспалительные заболевания переднего (блефарит, конъюнктивит, склерит, глубокий кератит без поражения эпителия, ирит, иридоциклит) и заднего отделов глаза (хориоидит, хориоретинит, неврит зрительного нерва), воспалительные реакции после травм и операций, а также восстановление прозрачности роговицы и подавление неоваскуляризации после перенесенных кератитов, химических и термических ожогов [66, 67].
Основным недостатком ГК в аспекте применения при заболеваниях глаза является их малая внутриглазная биодоступность, обусловленная наличием эпителиального и соединительнотканного барьеров, постоянным обновлением и оттоком слезной жидкости, а также плохой растворимостью липофильных молекул ГК в водных средах [68]. Современные лекарственные формы, обеспечивающие улучшенную интраокулярную биодоступность ГК, включают глазные мази, гели, эмульсии и суспензии, в том числе с наночастицами.
В то же время отток слезной жидкости по носослезному каналу опосредует системную абсорбцию ГК, что наряду с местным иммуносупрессорным и антипролиферативным воздействием обусловливает развитие наиболее часто встречаемых побочных эффектов [68]. При всасывании в кровоток на фоне длительного использования ГК могут вызывать характерные побочные эффекты, в частности дисфункцию гипоталамо-гипофизарно-надпочечниковой оси и атрофию надпочечников, перераспределение жировой клетчатки, атрофию кожи и ее производных, изъязвление желудочно-кишечного тракта, повышение артериального и внутриглазного давления, развитие катаракты, снижение минеральной плотности костей. Риск развития системных побочных эффектов топических ГК снижается при их использовании строго в рамках рекомендованного периода. Кроме того, применение препаратов с высоким профилем безопасности ассоциируется с уменьшением данного риска [10, 68–70]. Так, топический ГК фторметолон вызывает повышение внутриглазного давления гораздо реже (8,5% пациентов) и в меньшей степени (ΔР = 2,56 мм рт. ст.), чем дексаметазон (62,5% пациентов и ΔР = 8,58 мм рт. ст. соответственно) [71].
Местным антипролиферативным эффектом ГКС может быть обусловлена атрофия роговицы и прилежащих тканей, что особенно важно при уже имеющемся истончении роговицы (например, при кератоконусе) [10, 71]. Хотя интравитреальная биодоступность ГК в виде глазных капель и мазей оценивается сравнительно невысоко [66], истончение эпителия роговицы способствует ее существенному увеличению, в то время как одновременная инстилляция антибиотиков, напротив, может снижать ее [68]. Установлено, что наличие кератоконуса, а также дистрофии Фукса увеличивает риск повышения внутриглазного давления, приводящего к развитию вторичной глаукомы. Таким образом, местное применение ГК при заболеваниях, вызывающих дистрофию роговицы, требует тщательного мониторинга внутриглазного давления [71–73].
Длительное применение топических ГК также сопряжено с увеличением риска формирования задней субкапсулярной катаракты (особенно у пожилых пациентов), снижением местного иммунитета и сопротивляемости инфекциям, ухудшением заживления повреждений роговицы и склеры, возникновением мидриаза, птоза, тромбоза сосудов сетчатки и атрофии зрительного нерва [68].
В оториноларингологии препараты, содержащие ГК (чаще в комбинации с антибактериальными средствами), применяются при наружном и среднем отите инфекционной и неинфекционной этиологии. Их включение в комбинированные рецептуры позволяет блокировать каскад медиаторных реакций и уменьшить выраженность местного воспаления, что обеспечивает уменьшение боли, отека, зуда, экссудации и эритемы [7]. Системная абсорбция и риск ассоциированных побочных эффектов при использовании ГК в форме ушных капель минимальны [74]. В отличие от нестероидных противовоспалительных средств ГК не обладают ототоксичностью [7].
Сравнительная характеристика ГК для местного применения в офтальмологии и оториноларингологии приведена в табл. 2.
Нестероидные противовоспалительные препараты
Группа нестероидных противовоспалительных препаратов (НПВП) в составе средств для лечения отитов представлена феназоном и холина салицилатом. НПВП ингибируют циклооксигеназу (ЦОГ) 1 и 2, блокируя образование провоспалительных простагландинов и тромбоксана А2 из арахидоновой кислоты. В результате уменьшаются воспаление, боль, эритема, отек, зуд и экссудация.
Феназон – производное пиразолона, неселективный ингибитор ЦОГ. По анальгезирующей и жаропонижающей активности феназон близок к производным салициловой кислоты. Противовоспалительная активность препарата, по имеющимся данным, уступает его анальгетической активности [75]. При попадании во внутреннее ухо и системной абсорбции феназон способен вызывать ототоксические реакции, угнетение костномозгового кроветворения и образование язвенных дефектов желудочно-кишечного тракта [10]. Препарат не применяется при наружном отите, но в комбинации с лидокаином может использоваться для уменьшения оталгии при остром среднем отите [76].
Холина салицилат – производное салициловой кислоты, неселективный ингибитор ЦОГ, в кислой среде также оказывающий противомикробный и противогрибковый эффекты. Препарат характеризуется анальгетической активностью и может использоваться для симптоматического лечения ушной боли при остром среднем, хроническом среднем и наружном отите, мирингите. При местном применении холина салицилат не оказывает системного действия [10].
Следует помнить, что применение НПВП при среднем отите возможно только при сохранении целостности барабанной перепонки (в первые дни развития процесса). При неясной клинической картине, наличии перфорации или вероятности ее возникновении можно применять либо антибактериальные ушные капли (фторхинолоны, рифамицин), либо, при наличии шунта барабанной перепонки, комбинации фторхинолона и ГК (Комбинил). Применение этой комбинации возможно также при сохранении целостности барабанной перепонки.
Местные анестетики
Местные анестетики достаточно часто используются в качестве средств для топического применения в офтальмологии и оториноларингологии. Механизм их действия заключается в блокаде быстрых натриевых каналов нейрональной мембраны, что препятствует возникновению и распространению потенциала действия. Препараты этой группы нередко комбинируют с противомикробными агентами и противовоспалительными средствами, что позволяет увеличить анальгетический и противозудный эффекты последних. Особенностью действия местных анестетиков является более быстрое (одна-две минуты) наступление эффекта по сравнению с противовоспалительными препаратами [7].
Монопрепараты местных анестетиков, содержащие проксиметакаин, оксибупрокаин или лидокаин, как правило, не применяются при инфекционно-воспалительных заболеваниях глаз и используются для проведения поверхностной анестезии глазного яблока [77].
Местные анестетики могут оказывать токсическое действие на клетки роговицы при длительном использовании или в высоких концентрациях [77]. Лидокаин обладает не только большей анестезирующей активностью, но и более высокой степенью проникновения в переднюю камеру глаза по сравнению с прокаином [78]. Скорость инактивации прокаина больше скорости его проникновения через слизистые оболочки, в связи с чем при топическом применении он не оказывает системного эффекта [10].
В оториноларингологии доминирующим анестетиком для топического применения в составе комбинированных лекарственных препаратов является лидокаин, значительно превосходящий по эффективности терминальной анестезии реже используемый прокаин.
Комбинированные лекарственные препараты
Традиционно применение топических комбинированных препаратов при болезнях уха и глаз преследует цель добиться одновременно этиотропного, патогенетического и симптоматического воздействия на патологический процесс. Большинство выпускаемых комбинированных препаратов содержат антибактериальный и противовоспалительный компоненты. К ушным каплям иногда добавляют местный анестетик для достижения более быстрого обезболивающего эффекта.
Сочетание двух лекарственных веществ в одном флаконе способно улучшить приверженность больного лечению за счет сокращения времени, необходимого для введения капель, частоты использования и общего количества используемых флаконов. Кроме того, использование одного лекарственного препарата, а не нескольких снижает ежедневные затраты на проводимую терапию. Сокращается также время закапывания капель и потенциально повышается их эффективность за счет устранения эффекта вымывания ранее закапанного препарата.
Кроме того, в фиксированной комбинации суммарное количество получаемых пациентом консервантов будет меньше, чем при использовании разных препаратов, что может улучшить переносимость лечения (особенно актуально при неонатальных конъюнктивитах).
Примером комбинированных глазных/ушных капель является комбинация ципрофлоксацина и дексаметазона, зарегистрированная в России под торговым названием Комбинил. На данный момент это единственная в РФ комбинация фторхинолона и ГК, используемая как в офтальмологии, так и в оториноларингологии.
Данная комбинация включена в клинические рекомендации по лечению наружного и среднего отита у детей (с одного года) и взрослых. За рубежом комбинация ципрофлоксацина и дексаметазона зарегистрирована для лечения отита у детей с шести месяцев, что служит подтверждением безопасности данной комбинации [76, 79, 80].
В качестве вспомогательного вещества Комбинил содержит гидроксипропил-бета-циклодекстрин, который способен образовывать комплексы с молекулами лекарственных веществ, увеличивая их растворимость, стабильность в среде физиологических жидкостей и при хранении, усиливая фармакологическую активность, пролонгируя терапевтическое действие, снижая побочные эффекты, в том числе раздражающее действие на слизистые [81].
Современный ассортимент комбинированных глазных капель, мазей и ушных капель для лечения инфекционно-воспалительных заболеваний представлен на рисунке и в табл. 3.
Основные цели проводимой топической терапии при заболеваниях уха и глаз – элиминация возбудителя, устранение клинических симптомов, профилактика распространения инфекционного процесса и развития его осложнений. Выбор оптимальных топических препаратов для данных целей является эмпирическим и основан на знаниях о наиболее частых возбудителях заболеваний и состоянии антибиотикорезистентности (в первую очередь локальных, региональных и национальных) в соответствии с актуальными клиническими рекомендациями.
Лечение воспалительных заболеваний наружного уха предполагает целый комплекс мероприятий – этиотропную, патогенетическую и симптоматическую терапию. При лечении неосложненных наружных отитов, как правило, достаточно применения местных лекарственных препаратов. При этом нет необходимости в проведении системной антибактериальной терапии. Быстрый клинический эффект достигается на фоне применения ушных капель, создающих высокие местные концентрации действующих веществ без системных побочных эффектов [7].
При всех формах наружного отита могут использоваться различные монопрепараты и комбинированные средства. Однако предпочтение следует отдавать фторхинолон-содержащим средствам [76]. При остром диффузном наружном отите используемые препараты должны быть эффективны против S. aureus и P. aeruginosa. В этом случае предпочтение также отдается фторхинолонам (офлоксацин, ципрофлоксацин). К используемым препаратам можно добавить антисептики. При остром среднем отите в составе комплексной терапии на постперфоративной стадии рекомендовано применение транстимпанально ушных капель на основе рифамицина или фторхинолонов (ципрофлоксацин, офлоксацин) [79]. Эти же препараты в силу высокой эффективности (чувствительны 75,6% изолятов) и безопасности рекомендованы как средства выбора при хроническом гнойном среднем отите (в том числе при перфорации барабанной перепонки) [80].
Благодаря высокой антимикробной активности и хорошей интраокулярной биодоступности фторхинолоны (ципрофлоксацин, левофлоксацин) могут считаться препаратами выбора при бактериальных конъюнктивитах, особенно резистентных к другим антибиотикам, и профилактике бактериальных инфекций в офтальмохирургии [42].
Препараты ципрофлоксацина в форме глазных капель зарегистрированы в России для применения у детей с одного года (монопрепараты), комбинация ципрофлоксацина и дексаметазона – с двух лет. Офлоксацин и левофлоксацин в форме глазных капель зарегистрированы для применения у детей с одного года [81–83].
Интересным решением, способствующим оптимизации профиля эффективности и безопасности, стало использование в глазных/ушных каплях, содержащих офлоксацин (Данцил), и глазных каплях, содержащих левофлоксацин (Сигницеф), вспомогательного вещества гипромеллозы. Она обладает высокой биосовместимостью, химической инертностью, стабильностью и биоразлагаемостью. Использование гипромеллозы позволяет обеспечить прозрачность получаемых лекарственных форм, увеличить всасывание плохорастворимых лекарственных веществ и замедлить всасывание быстрорастворимых, повысить время удержания капель в зоне применения, пролонгировать и усилить эффекты лекарственных веществ на уровне тканей глаза/уха [59].
Заключение
Рациональное применение лекарственных средств этиотропного и патогенетического действия позволяет осуществить эффективную эрадикацию инфекционного агента и уменьшить выраженность симптомов заболевания, включая воспаление, отечность, зуд и экссудацию. Одним из оптимальных способов решения этой задачи считается использование комбинированных лекарственных препаратов, содержащих антибактериальные (с акцентом на фторхинолоны) и противовоспалительные компоненты.
S.V. Okovity, PhD, Prof., V.A. Prikhodko
St. Petersburg State Chemical and Pharmaceutical University
Contact person: Veronika A. Prikhodko, veronika.prihodko@pharminnotech.com
In most cases, infectious and inflammatory diseases of the ear and eyes are amenable to local treatment using etiotropic and/or pathogenetic therapy, taking into account the species of the infectious agent and clinical symptoms. The use of combined drugs can significantly increase the effectiveness of treatment, achieve recovery in a shorter time and significantly improve the quality of life of patients. The article analyzes modern monocomponent and combined drugs used in ophthalmological and otorhinolaryngological practice for topical treatment of infectious and inflammatory diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.