Целесообразность применения пробиотиков в лечении атерогенной дислипидемии
- Аннотация
- Статья
- Ссылки
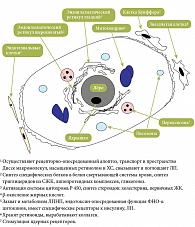




Исследования последних лет показали, что неалкогольная жировая болезнь печени играет важную роль в формировании факторов риска сердечно-сосудистых заболеваний. Связано это с тем, что синтез холестерина осуществляется главным образом в печени. С одной стороны, нарушение функционального состояния печени является одним из наиболее важных факторов развития дислипопротеинемии (ДЛП), так как нарушения липидного метаболизма начинаются на уровне гепатоцита, с другой – печень является органом-мишенью при атерогенной дислипидемии (рис. 1). Поэтому возникают сложности в назначении гиполипидемических препаратов, в частности статинов, которые сами по себе обладают известным гепатотоксическим эффектом, и увеличение их дозы может привести к развитию лекарственного гепатита на фоне неалкогольной жировой болезни печени (НАЖБП). В случаях недиагностированного стеатогепатита побочное действие лекарственных препаратов может быть связано с нарушением метаболизма препарата в печени.
В последнее время была доказана патогенетическая связь состояния кишечного биоценоза не только с заболеваниями желудочно-кишечного тракта (ЖКТ), но и с такими заболеваниями, как атеросклероз и артериальная гипертония, мочекаменная болезнь и пиелонефрит, желчекаменная болезнь и гепатиты, бронхиальная астма и экзема [2, 5, 7, 8, 14, 18, 21, 22, 23]. Наиболее важными и изученными функциями кишечной микрофлоры являются обеспечение антиинфекционной защиты, стимуляция иммунных функций макроорганизма, обеспечение всасывания минералов и воды, синтез витаминов группы В и К, регуляция липидного и азотистого обмена, регуляция кишечной моторики [20]. Роль кишечной микрофлоры в поддержании гомеостаза равнозначна функциям жизненно важных органов. До настоящего времени уделяется необоснованно мало внимания значению микробной экологии пищеварительного тракта в реализации физиологических функций и патологических нарушений при дислипидемии. Поэтому формирование и прогрессирование дислипидемии необходимо рассматривать в тесной взаимосвязи с микробиотой пищеварительного тракта.
В 1935 г. была выдвинута гипотеза о том, что кишечная микрофлора участвует в холестериновом обмене. С тех пор накоплено много доказательств того, что резидентная и транзиторная микрофлора хозяина, синтезируя, трансформируя или разрушая экзогенные и эндогенные стерины, активно участвует в стериновом метаболизме. В 2001 г. Карнейро Де Мура предложил теорию о нарушении микробного сообщества в толстой кишке как один из путей реализации нарушений липидного метаболизма [6].
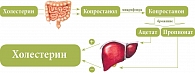
Кишечная микрофлора метаболизирует холестерин, поступающий в толстую кишку, в копростанол и далее – в копростанон (рис. 2).
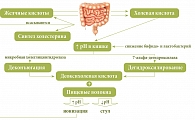
Образующиеся в результате брожения ацетат и пропионат, всосавшись в кровь и достигнув печени, могут влиять на синтез холестерина. В частности, показано, что ацетат стимулирует его синтез, а пропионат – тормозит. Третий путь влияния микрофлоры на обмен липидов в макроорганизме связан со способностью бактерий метаболизировать желчные кислоты, в частности холевую кислоту (рис. 3).
Не всосавшаяся в дистальных отделах подвздошной кишки конъюгированная холевая кислота в толстой кишке подвергается деконъюгации микробной холеглицингидролазой и дегидроксилированию при участии 7-альфа-дегидроксилазы. Образовавшаяся деоксихолевая кислота связывается с пищевыми волокнами и выводится из организма. При повышении значений рН, которое может быть вызвано разными причинами, усиливается активность ферментов, участвующих в синтезе деоксихолевой кислоты, увеличивается ее растворимость и всасывание, что приводит к повышению в крови уровня желчных кислот, холестерина и триглицеридов. Одной из причин повышения рН в толстой кишке может быть недостаток пребиотических компонентов в питании, нарушающих рост нормальной микрофлоры, в т.ч. бифидо- и лактобактерий [8, 10, 15].
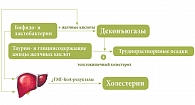
Также установлено, что покоящиеся и растущие клетки бифидобактерий в присутствии солей желчных кислот секретируют деконъюгазы, которые превращают таурин- и глицинсодержащие амиды желчных кислот в труднорастворимые осадки, связывающие толстокишечный холестерол и обеспечивающие экскрецию его с каловыми массами. Деконъюгаза также ингибирует активность ГМГ-КоА-редуктазы, что приводит к уменьшению экскреции холестерина гепатоцитами, и оказывает влияние на количество рецепторов для липопротеидов низкой плотности на поверхности форменных элементов крови (рис. 4).
Аналогичные свойства отмечаются у лактобацилл и некоторых других кишечных микроорганизмов [11, 12, 19]. Стоит еще раз подчеркнуть, что трансформация холестерина в экскретируемые формы происходит в присутствии желчных кислот, выход которых уменьшается при паренхиматозных заболеваниях печени.
Надо отметить, что в патогенезе атерогенной дислипидемии немаловажную роль играют продукты метаболизма кишечной микрофлоры, в частности короткоцепочечные жирные кислоты (КЖК), эндотоксин, оксид азота [1, 4, 13, 16]. КЖК – основной продукт микробной ферментации углеводов, жиров и белков – представляют собой монокарбоновые кислоты с длиной цепи до 8 атомов углерода. K ним относятся уксусная, пропионовая, изомасляная, масляная, изовалериановая, валериановая, изокапроновая и капроновая кислоты. Неразветвленные летучие жирные кислоты – уксусная, пропионовая и масляная – образуются при анаэробном брожении углеводов. В присутствии этих кислот тормозится развитие условно-патогенных штаммов, которые в большинстве своем обладают протеолитическим типом метаболизма. Подавление протеолитических штаммов сопровождается угнетением гнилостных процессов и подавлением образования аммиака, ароматических аминов, сульфидов, эндогенных канцерогенов [20]. Образование разветвленных КЖК – изомасляной и изовалериановой – происходит в процессе метаболизма белков из валина и лейцина соответственно.
Благодаря выработке жирных кислот происходит регуляция рН внутрикишечного содержимого. Локально КЖК определяют снижение рН и обеспечивают колонизационную резистентность, а также принимают участие в регуляции кишечной моторики, осуществляют дезинтоксикационную функцию, за счет выведения продуктов метаболизма белков [17].
Также доказано их участие в энергообеспечении эпителиальных тканей, в процессах роста и дифференцировки колоноцитов, поставки субстратов глюконеогенеза, подержании ионного и газового обмена, активации местного и системного иммунитета и др. [3].
Выполнение перечисленных и многих других метаболических функций возможно лишь в том случае, если нормальная микрофлора в полной мере обеспечена необходимыми для ее роста и развития нутриентами. Важнейшими энергетическими источниками для нее являются углеводы: ди-, олиго- и полисахариды, не расщепляющиеся в просвете тонкой кишки, которые получили название пребиотики. Для нормальной жизнедеятельности бактериям толстой кишки необходимы также витамины, некоторые из них синтезируют сами бактерии.
Итак, кишечная микрофлора выполняет многочисленные функции, жизненно необходимые для макроорганизма. Целью исследования была оценка состояния кишечной микрофлоры, качественного и количественного состава продуктов, характеризующих метаболическую активность микроорганизмов, а также определение роли коррекции дисбиоза в лечении больных с атерогенной дислипидемией и НАЖБП.
Материалы и методы исследования
Проведены клинические наблюдения за 108 больными, из них 72 женщины (66,7%) и 36 мужчин (33,3%) в возрасте от 35 до 70 лет (средний возраст – 53,0 ± 9,32 года) с различными типами дислипидемии (по Фредриксону, 1967 г.). Больные находились на амбулаторном и стационарном обследовании и лечении в отделении сочетанных заболеваний органов пищеварения ЦНИИГ.
В исследовании участвовали больные с морбидным ожирением (ОТ/ОБ > 0,9, ИМТ > 30 кг/м2) и дислипидемией. В течение 3 месяцев до начала исследования больные не принимали гиполипидемические препараты, кишечные антисептики, пре- и пробиотики. Критерии исключения больных: возраст старше 70 лет, органические заболевания толстого кишечника, вторичное ожирение (церебральное: опухоли головного мозга, травма основания черепа и последствия хирургических операций, синдром пустого турецкого седла, травмы черепа, воспалительные заболевания (энцефалит и др.); эндокринное: гипофизарное, гипотиреоидное, надпочечниковое; ожирение на фоне психических заболеваний и/или приема нейролептиков), наличие гепатита другой этиологии (вирусной, алиментарной), отказ больного от исследования.
У всех обследуемых больных кроме тщательного сбора анамнеза и клинического обследования проводили оценку биохимических показателей крови (липидного спектра: общий холестерин, ХС-ЛПНП, ХС-ЛПВП, триглицериды; показателей функции печени: аланинаминотрансаминаза (АЛТ), аспартатаминотрансаминаза (АСТ), щелочная фосфатаза (ЩФ), гамма-глутамилтранспептидаза (ГГТП)), исследование КЖК в кале методом газожидкостного хроматографического анализа, определение степени выраженности дисбиоза кишечника по классификации Р.В. Эпштейн-Литвак, Ф.Л. Вильшанской (1977 г.), а также проводилось определение уровня эндотоксина и оксида азота в сыворотке крови (по методу В.А. Метельской, 2005 г.). Указанные исследования проводились до и после лечения. Кроме этого, проводилось серологическое исследование маркеров вирусных гепатитов (В, С) иммуноферментным методом, а также исследование крови на АМА-М2 и АNА. Также 34 больным провели пункционную биопсию печени с изучением гистологической картины.
Больные были разделены на 2 группы в зависимости от стадии НАЖБП (рис. 5):
- 1 группа – пациенты с НАЖБП в стадии стеатоза;
- 2 группа – пациенты с НАЖБП в стадии стеатогепатита.
По проводимой терапии больные были разделены на 3 подгруппы:
- подгруппа А – больные, получавшие гиполипидемическую терапию (статин 10 мг);
- подгруппа Б – больные, получавшие пробиотик;
- подгруппа В – больные, получавшие пробиотик в комбинации с гиполипидемической терапией (статин 10 мг).
Для обработки данных был использован стандартный статистический пакет Statistica 6.0 с применением непараметрических методов оценки (критерий Уилкоксона – Уитни-Манна). Критический уровень значимости в исследовании принимался ≤ 0,05.
Результаты исследования
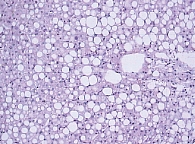
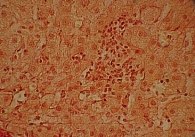
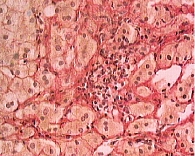
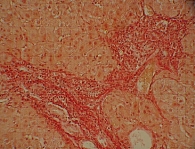
Исходно в биохимическом анализе крови повышение уровня АЛТ отмечалось у 24% больных, АСТ – у 23%, ГГТП – у 48,6%, ЩФ – у 6,6% больных. У этой же группы больных при проведении пункционной биопсии печени определялись признаки неалкогольной жировой болезни печени в стадии стеатогепатита: крупнокапельная жировая дистрофия гепатоцитов (рис. 6), внутридольковые инфильтраты (рис. 7), реже портальное воспаление, перигепатоцеллюлярный фиброз и перипортальный фиброз (рис. 8), а также изменения мелких желчных протоков (рис. 9): перидуктулярная лимфоцитарная инфильтрация, перидуктулярный фиброз и пролиферация дуктул.
Однако в ходе исследования не выявлено прямой корреляции между биохимическими показателями функции печени и тяжестью морфологических изменений (появление морфологических признаков стеатогепатита предшествует развитию цитолитического и холестатического синдромов по данным лабораторного обследования).
В анализе кала на флору у части больных (68%) отмечалось уменьшение количества бифидобактерий (6,67х107 ± 0,48х107), а также в ряде случаев увеличение условно-патогенной и наличие патогенной микрофлоры. До лечения у всех больных диагностировано снижение суммарного количества КЖК в кале.
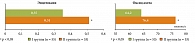
Исследование не показало достоверной связи дисбиоза толстой кишки и количества КЖК в крови с уровнем липидов в крови. Однако в 100% случаев определялось повышение эндотоксина (0,37 ± 0,01) и оксида азота (72,25 ± 2,22) в крови (нормальные значения: эндотоксин 0,18 ± 0,05 ЕЭ/мл, оксид азота 32,15 ± 0,51 мкмоль/л). Следует отметить, что данные показатели были достоверно выше в группе больных с печеночной гиперферментемией (рис. 10).
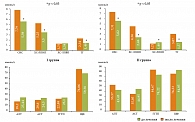
На фоне терапии статином отмечался выраженный гиполипидемический эффект (рис. 11), однако данная терапия была менее эффективна у больных со стеатогепатитом, а также вызывала повышение уровня ферментов печени (рис. 11). Уровень КЖК существенно не менялся, однако эндотоксин и оксид азота в крови были достоверно выше в обеих группах больных (рис. 12).
Лечение пробиотиком не оказывало гиполипидемического действия, но улучшало показатели печеночного обмена и состава кишечной микрофлоры, о чем свидетельствует повышение суммарного количества КЖК в кале и крови и снижение эндотоксина и оксида азота в крови.
Комбинированная терапия пробиотиком и статином оказала более выраженный гиполипидемический эффект при отсутствии значительного повышения уровня ферментов печени (рис. 13). Однако наблюдалось одновременное увеличение уровня КЖК и снижение содержания эндотоксина и оксида азота в крови (рис. 14), что отражает их роль в патогенезе атерогенной дислипидемии.
Выводы
- У больных неалкогольной жировой болезнью печени (НАЖБП) с повышенной активностью печеночных ферментов наблюдается увеличение содержания в крови эндотоксина в 1,5 раза и оксида азота в 1,2 раза, по сравнению с группой больных с нормальным уровнем печеночных ферментов (р < 0,05). Выявлена прямая корреляция содержания эндотоксина и оксида азота с уровнем АСТ (r = 0,34), ГГТП (r = 0,88 и r = 0,86 соответственно) (р < 0,05), что доказывает участие указанных метаболитов кишечной микрофлоры в патогенезе НАЖБП.
- Показатели суммарного количества короткоцепочечных жирных кислот и анаэробного индекса в кале и крови малоинформативны в диагностике НАЖБП: коэффициент корреляции данных показателей с уровнем печеночных ферментов (АЛТ, АСТ, ГГТП, ЩФ) и липидным спектром менее 0,2 (r < 0,2).
- Эндотоксин и оксид азота могут быть использованы в качестве маркеров развития неалкогольного стеатогепатита. При повышении эндотоксина и оксида азота выявлено прогрессирование воспалительной инфильтрации печени, о чем свидетельствует повышение индекса гистологической активности (r = 0,84 и r = 0,69 соответственно).
- Применение пробиотиков у больных НАЖБП в стадии стеатогепатита способствует снижению активности печеночных ферментов (АЛТ на 38,5%, АСТ на 30%, ГГТП на 33,2%).
- При назначении монотерапии пробиотиками у больных НАЖБП и атерогенной дислипидемией отмечена тенденция к снижению общего холестерина у 12% больных, ХС-ЛПНП – у 10%, триглицеридов – у 7% (р > 0,05).
- Комбинированная терапия статинами и пробиотиками оказывает достоверный гиполипидемический эффект в обеих группах (в I группе общий холестерин снизился на 28%, ХС-ЛПНП на 33%, триглицериды на 36%, во II группе – на 23%, 46% и 49% соответственно, р < 0,05), сопровождается снижением эндотоксина (на 32% в I группе, 38,9% во II группе, р < 0,05), оксида азота (на 18,9% в I группе и 23,1% во II группе, р < 0,05). Отмечено уменьшение гепатотоксического эффекта статинов (в I группе статистически значимого повышения печеночных ферментов не отмечено, во II группе выявлена тенденция к снижению АЛТ на 19%, ГГТП на 12%, р > 0,05).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.