Статиновый гепатит у пациента с неалкогольной жировой болезнью печени
- Аннотация
- Статья
- Ссылки

Введение
В группе токсических поражений печени особое положение занимают лекарственные гепатиты. Об этом следует помнить при установлении этиологии любого острого или хронического заболевания печени.
На сегодняшний день известно свыше 1000 лекарственных средств, способных вызывать предсказуемые и непредсказуемые поражения печени. Непредсказуемые поражения обычно развиваются на фоне своевременно не диагностированного заболевания у пациентов с неалкогольной жировой болезнью печени (НАЖБП) в стадии неалкогольного стеатогепатита (НАСГ) [1, 2].
Выявить НАСГ достаточно сложно, поскольку отсутствуют специфические диагностические маркеры, нередко болезнь протекает бессимптомно и реализуется на фоне применения препаратов с гепатотоксическим эффектом, в ряде случаев при использовании препаратов, которые не должны вызывать токсическое поражение печени при ее нормальном функционировании.
Неблагоприятный эффект может быть обусловлен как прямым токсическим воздействием лекарственных средств или их метаболитов, так и идиосинкразией на них [3]. Последняя проявляется метаболическими либо иммунологическими нарушениями. Следовательно, лекарственный хронический гепатит можно сравнить с вирусным или аутоиммунным гепатитом с антиядерными и антимикросомальными антителами. При аутоиммунном варианте заболевания воспалительный процесс в печени прекращается после отмены препарата. Морфологические проявления указанного вида гепатита разнообразны: фокальный некроз гепатоцитов, гранулематоз, мононуклеарно-эозинофильная инфильтрация, холестаз и др. [2, 4].
Известно несколько путей гепатотоксических реакций лекарственных средств. В частности, они могут выступать в качестве гепатотоксинов опосредованного действия. Различают цитотоксические, холестатические и канцерогенные гепатотоксины.
К цитотоксическим веществам относят некоторые антибактериальные препараты, в том числе противотуберкулезные, цитостатики, нестероидные противовоспалительные препараты (НПВП), антиаритмики, к холестатическим – анаболические стероиды, пероральные контрацептивы, противосудорожные препараты, антидепрессанты, литохолевую кислоту. Эти вещества вызывают поражение печени посредством избирательного нарушения секреции в желчные канальцы.
В свою очередь во второй группе гепатотоксинов выделяют вещества, вызывающие поражение печени вследствие:
-
аллергических реакций по типу гиперчувствительности (с развитием гранулематозного поражения печени с наличием очагов эозинофилии, лихорадки, сыпи, повышением количества эозинофилов в крови);
-
воздействия токсических метаболитов лекарственных средств при снижении активности глутатионовой системы гепатоцита, цитохрома Р450, оксидазной активности микросомальной фракции гепатоцитов [2–7].
Токсические метаболиты лекарственных средств могут выступать в роли гаптенов и полугаптенов, связывающихся со специфическими молекулами мембран клеток. В результате образуются антигены, тропные к гепатоцитам. Последние разрушаются с образованием аутоантигенов, на которых формируются антитела к собственным гепатоцитам [8–10]. Таким образом, процесс способен приобретать аутоиммунный характер.
В 1995 г. Л.И. Аруин выделил три степени активности гепатита. При первой (минимальной) ступенчатые некрозы ограничены небольшими сегментами только перипортальной зоны, поражается лишь часть портальных трактов. При второй (умеренной) ступенчатые некрозы также ограничены перипортальными зонами, но в процесс вовлечены почти все портальные тракты. При третьей (выраженной) степени некрозы проникают в глубь долек, имеют место перисептальные сливающиеся мостовидные некрозы [4].
Сегодня для классификации хронического гепатита рекомендуют не ограничиваться качественной характеристикой трех степеней активности, а проводить также полуколичественный анализ – определять индекс гистологической активности (ИГА). Для этого оценивают морфологические компоненты хронического гепатита:
1) перипортальные некрозы гепатоцитов, включая мостовидные, – от 0 до 10 баллов;
2) внутридольковые фокальные некрозы и дистрофию гепатоцитов – от 0 до 4 баллов;
3) воспалительный инфильтрат в портальных трактах – от 0 до 4 баллов;
4) фиброз – от 0 до 4 баллов.
ИГА от 1 до 3 баллов свидетельствует о минимальном хроническом гепатите, от 4 до 8 баллов – о мягком, от 9 до 12 баллов – умеренном, от 13 до 18 баллов – тяжелом хроническом гепатите [2] (табл. 1).
Рассмотрим клинический случай развития лекарственного гепатита как результат гепатотоксического воздействия статинов и способы его лечения [1, 2].
Клинический случай
Больной М., 43 года, поступил в отделение эндокринных и метаболических заболеваний органов пищеварения Московского клинического научно-практического центра (МКНЦ) 5 июня 2014 г. Пациент жаловался на общую слабость, повышенную утомляемость, увеличение массы тела на 10 кг с марта 2008 г., боли в поясничном отделе.
Из анамнеза известно, что больной 20 декабря 2013 г. был госпитализирован в кардиологическое отделение клинической больницы с сильной давящей болью за грудиной, иррадиирующей в левую половину грудной клетки. По результатам клинических и лабораторно-инструментальных исследований установлен диагноз: ишемическая болезнь сердца (ИБС), острый крупноочаговый задне-диафрагмальный инфаркт миокарда, состояние после тромболитической терапии Стрептазой, недостаточность кровообращения стадии IIА, эпизод сердечной астмы, гипертоническая болезнь стадии III, 2-я степень, гиперлипидемия типа IIБ, алиментарно-конституциональное ожирение 3-й степени, мочекаменная болезнь.
Биохимический анализ крови показал повышение уровня общего холестерина – 8,5 ммоль/л, триглицеридов – 4,52 ммоль/л, ультразвуковое исследование – увеличение размеров печени, диффузные изменения печени и поджелудочной железы, микролиты в обеих почках. На фоне проведенной терапии зафиксирована положительная динамика инфаркта миокарда.
При выписке больному рекомендован прием антиагрегантов, антикоагулянтов, ингибиторов ангиотензинпревращающего фермента, бета-блокаторов, а также статинов (Липримар 40 мг/сут).
Несмотря на прием назначенных препаратов, пациента по-прежнему беспокоили ноющие боли за грудиной при быстрой ходьбе. Больной был госпитализирован в Научно-практический центр интервенционной кардиоангиологии. При обследовании выявлены повышение уровня аланинаминотрансферазы (АЛТ) – три нормы, нормализация показателей холестерина и его фракций, уплотнение стенок и створок аорты, нарушение локальной сократимости левого желудочка, фракция выброса – 56% (по результатам эхокардиографии), частота сердечных сокращений (ЧСС) – 37 в минуту (по результатам суточного мониторирования электрокардиограммы). Другой существенной патологии (так же, как и при пробе с физической нагрузкой) не установлено.
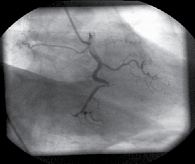
С учетом полученных данных и сохраняющегося болевого синдрома проведена коронарная ангиография (рис. 1). Выявлены стеноз промежуточной ветви на 70% (диаметр 2 мм), правой коронарной артерии (ПКА) на границе среднего и дистального сегментов – на 90% на изгибе. Принято решение о стентировании ПКА. Во время оперативного вмешательства произошла диссекция артерии, в связи с чем в экстренном порядке было проведено аутовенозное аортокоронарное шунтирование ПКА без искусственного кровообращения.
В послеоперационный период развился плеврит, перикардит. Длительное время сохранялась температура до 38,5 °С. Это свидетельствовало о раннем проявлении синдрома Дресслера. Клинический анализ крови показал лейкоцитоз (уровень лейкоцитов 15 × 109/л) без сдвига лейкоцитарной формулы, уровень эозинофилов – 3%, скорость оседания эритроцитов – 27 мм/ч.
На фоне проведенной терапии состояние больного стабилизировалось, проявления перикардита нивелировались, в левой плевральной полости оставалось незначительное количество осумкованной жидкости.
При выписке рекомендован прием блокаторов кальциевых каналов, антикоагулянтов с последующим переходом на антиагреганты, бета-блокаторов, курсовая метаболическая терапия, прием статинов (Аторис 20 мг/сут).
В январе 2014 г. по результатам биохимического анализа крови выявлено повышение уровня трансаминаз: АЛТ – три нормы, аспартатаминотрансферазы (АСТ) – две нормы. Больному назначили эссенциальные фосфолипиды по две капсулы в сутки курсами.
В феврале 2014 г. анализ крови показал повышение уровней трансаминаз (АЛТ – шесть норм, АСТ – три нормы), а также признаки холестаза (гамма-глутамилтранспептидаза (ГГТП) – четыре нормы). Прием аторвастатина был отменен. Через два месяца уровень АЛТ снизился до двух норм, уровень АСТ практически нормализовался.
Из-за повторного повышения холестерина прием аторвастатина (20 мг/сут) был возобновлен. Через два месяца уровень АЛТ достиг 17 норм, АСТ – 10 норм. С указанными показателями больной поступил в МКНЦ для обследования и лечения.
Состояние пациента характеризовалось как удовлетворительное. Телосложение гиперстеническое (рост – 160 см, вес – 92 кг, индекс массы тела (ИМТ) – 35 кг/м2). Кожные покровы смуглые, чистые, склеры и видимые слизистые оболочки обычной окраски. Периферических отеков нет. Дыхание везикулярное, побочные шумы в легких отсутствовали. Частота дыхания – 16 в минуту. Левая граница относительной тупости сердца смещена на 1,5 см кнаружи от левой среднеключичной линии. При аускультации тоны сердца приглушены, ритм правильный, шумов нет. ЧСС – 64 в минуту, артериальное давление – 120/70 мм рт. ст. Живот увеличен за счет подкожной жировой клетчатки, при пальпации мягкий, чувствительный в правом подреберье. Печень при спокойном дыхании из-под реберной дуги не выступала, при форсированном дыхании край печени доступен для пальпации. Край печени плотный, ровный, гладкий. Границы печени по Курлову – 13 × 11 × 9 см. Селезенка не пальпировалась. Область почек не изменена, почки также не пальпировались. Симптом поколачивания с обеих сторон отрицательный.
В клиническом анализе крови патологических изменений не выявлено. Биохимический анализ крови показал гипертрансаминаземию (АЛТ – 8,5 нормы, АСТ – 3,5 нормы), лабораторный синдром холестаза (повышение уровня билирубина до 30,4 мкмоль/л за счет непрямой фракции, прямой билирубин – 5,7 мкмоль/л), ГГТП – 1,5 нормы, общий холестерин до 5,64 ммоль/л, дислипидемию (триглицериды – 1,9 ммоль/л, липопротеины низкой плотности (ЛПНП) – 3,91 ммоль/л, липопротеины высокой плотности (ЛПВП) – 0,87 ммоль/л).
Отказ больного от употребления алкоголя (в течение трех лет) позволил исключить заболевание печени алиментарной этиологии. Однако, учитывая перенесенные оперативные вмешательства (аортокоронарное шунтирование, аппендэктомию, операцию по поводу грыжи белой линии живота), исключить вирусное поражение не представлялось возможным. Именно поэтому было проведено исследование крови на наличие маркеров гепатитов В, С, G, ТТ. Результат отрицательный.
Ультразвуковое исследование органов брюшной полости показало увеличение (за счет правой доли – 156 мм) и диффузные изменения печени, повышение эхогенности ее ткани и обеднение сосудистого рисунка, диффузные изменения поджелудочной железы, сетчатую форму холестероза желчного пузыря, каликоэктазию левой почки.
Поскольку пациент длительно принимал антиагреганты, антикоагулянты, НПВП (из-за боли в поясничном отделе, связанной с межпозвоночными грыжами), была выполнена коагулограмма (показатели в пределах нормы), а также эзофагогастродуоденоскопия, по результатам которой диагностированы недостаточность кардии, поверхностный гастрит с хроническими эрозиями в антральном отделе.
Из-за наличия признаков метаболического синдрома, а также риска развития аутоиммунного заболевания (в том числе с поражением щитовидной железы) пациента направили на консультацию к эндокринологу. Установлено: щитовидная железа пальпируется (1-я степень), имеет неоднородную структуру, ИМТ – 35 кг/м2, уровень холестерина повышен, уровень глюкозы – 5,2 ммоль/л (норма), тиреотропного гормона – 1,89 мМЕ/л (норма). Заключение: экзогенно-конституциональное ожирение 2-й степени.
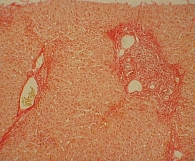
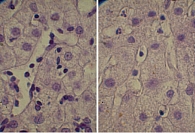
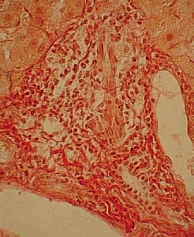
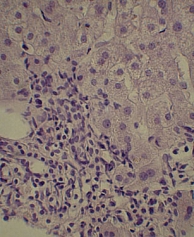
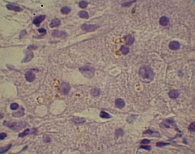
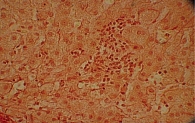
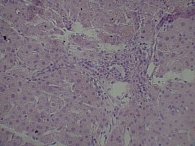
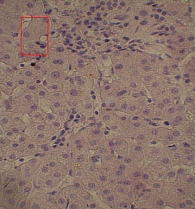
Для изучения структуры паренхимы печени проведена ультразвуковая эластометрия, однако исследование оказалось неинформативным из-за узких и ригидных межреберных промежутков и избыточности подкожной жировой клетчатки. Потребовалось выполнение пункционной биопсии печени. Результат: портальные тракты расширены, умеренно инфильтрированы лимфоцитами (рис. 2) с небольшой примесью плазматических клеток (рис. 3). Некоторые портальные тракты сильно фиброзированы. Гиперплазия мелких желчных протоков (рис. 4), часть протоков разрушена и окружена лимфоцитарным инфильтратом. В клетках эпителия желчных протоков – дистрофические изменения. Целостность пограничной пластинки в отдельных портальных трактах нарушена, и лимфоцитарный инфильтрат распространился между гепатоцитами (рис. 5). В отдельных перипортальных гепатоцитах выявлены участки внутриклеточного холестаза (рис. 6), мелкие внутридольковые лимфоцитарные инфильтраты (рис. 7), выраженная гиперплазия клеток ретикулоэндотелиальной системы. В просвете расширенных синусоидов лимфоциты (рис. 3). ИГА – 8 баллов. Заключение: хронический портальный и лобулярный гепатит низкой степени активности, аутоиммунный холангит.
На основании жалоб, собранного анамнеза, осмотра, результатов лабораторных и инструментальных методов обследования, а также данных предыдущих исследований (по выпискам из стационаров) установлен следующий диагноз:
-
основное заболевание: ИБС, стенокардия напряжения функционального класса II, постинфарктный кардиосклероз, аортокоронарное шунтирование, недостаточность кровообращения стадии I, гипертоническая болезнь стадии III 2-й степени 4-й степени риска, атерогенная дислипидемия типа IIБ. Экзогенно-конституциональное ожирение 2-й степени;
-
осложнение терапии: лекарственный (статиновый) гепатит;
-
сопутствующие заболевания: хронический гастрит с эрозией в стадии обострения, недостаточность кардии, холестероз желчного пузыря (сетчатая форма), хронический панкреатит в процессе ремиссии, мочекаменная болезнь, хронический пиелонефрит вне обострения.
Назначено лечение: гиполипидемическая диета, гепатопротекторы (Урсосан 1000 мг/сут), ферменты (Мезим форте), пентоксифиллин внутривенно капельно № 10.
На фоне проведенной терапии нормализовались уровни трансаминаз, билирубина, ГГТП. Однако из-за отмены статинов в биохимическом анализе крови зафиксировано повышение уровней холестерина, ЛПНП, триглицеридов. Поскольку у больного диагностирована атерогенная дислипидемия, проведено аортокоронарное шунтирование, существует высокий коронарный риск, рекомендован прием статинов (симвастатин 20 мг/сут). С учетом гепатотоксического действия препаратов данной группы назначен Урсосан 1000 мг/сут.
Через пять месяцев для динамического наблюдения пациента госпитализировали в МКНЦ. При обследовании выявлены снижение уровня общего холестерина, нормализация триглицеридов, высокий уровень ЛПНП – 4 ммоль/л. Учитывая литогенный эффект гиперхолестеринемии и дислипидемии, проведено контрольное ультразвуковое исследование органов брюшной полости, по результатам которого выявлены признаки диффузных изменений печени, поджелудочной железы, холестероза желчного пузыря, подтверждена мочекаменная болезнь. Повторная эзофагогастродуоденоскопия показала хронические эрозии желудка.
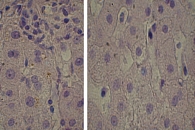
Для оценки гепатопротективного действия препарата урсодезоксихолевой кислоты (УДХК) проведена повторная биопсия печени – материал сильно фрагментирован и представлен мелкими кусочками печеночной ткани. Портальные тракты не расширены, некоторые слабо инфильтрированы лимфоцитами и слабо фиброзированы (рис. 8). Портальные тракты содержат один-два мелких желчных протока. Эпителий желчных протоков не изменен. Обнаружены участки внутриклеточного холестаза в отдельных перипортальных гепатоцитах (рис. 9), умеренная гиперплазия клеток ретикулоэндотелиальной системы. В просвете расширенных синусоидов – единичные лимфоциты и плазматические клетки (рис. 10). ИГА – 2 балла. Заключение: хронический очаговый портальный гепатит минимальной степени активности.
Таким образом, на фоне комбинированной терапии статином и Урсосаном дислипидемия приобрела менее атерогенную степень (тип IIА), снизился ИГА, нормализовался диаметр портальных трактов, уменьшились фиброз и инфильтрация лимфоцитами, исчезли перипортальные некрозы, гиперплазия ретикулоэндотелиальной системы, уменьшились признаки холестаза.
Поскольку целевой уровень общего холестерина и ЛПНП не был достигнут, при выписке больному рекомендовано двойное ингибирование холестерина (статин 10 мг + эзетимиб 10 мг) и прием гепатопротекторов (Урсосан 750 мг/сут).
Через две недели получены следующие результаты: уровни АЛТ – 69,4 Ед/л, АСТ – 39,1 Ед/л, холестерина – 5,75 ммоль/л, ЛПНП – 3,8 ммоль/л, триглицеридов – 1,38 ммоль/л. Несмотря на умеренное повышение уровня трансаминаз, отказаться от статинов не представлялось возможным из-за высокого риска развития сердечно-сосудистых осложнений (табл. 2). Именно поэтому на данном этапе продолжена терапия ингибирования холестерина одновременно с приемом препаратов УДХК в дозе 750 мг в сутки.
Обсуждение
Данное клиническое наблюдение демонстрирует, что пациентам с гиперлипидемией, которым показана гиполипидемическая терапия, необходим контроль функционального состояния печени.
С одной стороны, прием статинов приводит к значительному и стабильному снижению уровня общего холестерина на 22–42%, ЛПНП – на 27–60% (в зависимости от суточной дозы препарата) [2]. Установлено, что каждое удвоение дозы снижает уровень ЛПНП лишь на 6% (правило шести). В результате риск сердечно-сосудистых осложнений уменьшается на 18%. С другой – назначение любого лекарственного препарата может привести к развитию побочных эффектов. Так, на фоне применения статинов чаще наблюдаются диспепсические расстройства (метеоризм, тошнота, боли в животе), редко (у 0,1–1,0% больных) – кожная сыпь, зуд. Возможны расстройства сна, снижение концентрации внимания.
Наиболее неблагоприятным побочным эффектом статинов является поражение печени. Повышение активности печеночных ферментов АЛТ и АСТ отмечено у 1–5% больных. Гипертрансаминаземия считается дозозависимым эффектом статинов [2]. Если уровень хотя бы одного из перечисленных ферментов при двух последовательных измерениях в три раза превышает верхние границы нормы, прием статинов следует прекратить. Если показатели трансаминаз увеличены не более чем в полтора раза и клинические симптомы не наблюдаются, прием статинов может быть продолжен. При умеренном повышении уровня ферментов достаточно снизить дозу препаратов [2].
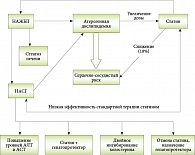
Итак, увеличение дозы статинов приводит к прогрессированию НАЖБП, что в свою очередь является одной из причин увеличения атерогенной дислипидемии, а также развития НАСГ. Образовавшийся замкнутый круг (рис. 11) обусловливает низкую эффективность стандартной терапии статинами, а сохраняющийся высокий сердечно-сосудистый риск – необходимость увеличения дозы статина, что чревато развитием лекарственного гепатита с более чем трехкратным повышением уровней АЛТ и АСТ в сыворотке крови (примерно у 1% больных). При этом у пациентов отмечаются слабость, отсутствие аппетита, снижение массы тела.
В случае своевременной диагностики и отмены препаратов симптомы гепатита исчезают в течение нескольких дней. Вместе с тем высокие показатели трансаминаз могут сохраняться еще несколько недель [2].
Из-за побочных эффектов статинов возник вопрос о более безопасной гиполипидемической терапии. Один из вариантов – двойное ингибирование холестерина (статин + эзетимиб). Данная низкодозовая комбинация позволяет уменьшить частоту развития побочных эффектов, уровень холестерина и выраженность дислипидемии.
Представленное клиническое наблюдение показывает, что при назначении статинов больным с атерогенной дислипидемией в связи с выраженным цитолитическим синдромом необходимо также назначать препараты УДХК. Это способствует нормализации показателей биохимических проб печени и положительной динамике в структуре печени.
Заключение
Препараты УДХК широко применяются в лечении НАЖБП у пациентов с ожирением, сахарным диабетом и другими метаболическими заболеваниями печени. В настоящее время выявлены новые механизмы их действия.
Так, установлена базисная связь молекулы УДХК с метаболизмом липидов и углеводным гомеостазом, что позволяет применять УДХК в лечении инсулинорезистентности.
Кроме того, УДХК (Урсосан):
-
нормализует показатели окислительного стресса;
-
влияет через рецепторный путь на MDR – белок множественной лекарственной устойчивости;
-
активирует протеинкиназы А и С;
-
является лигандом для G-протеин-желчнокислотного связанного рецептора;
-
активирует ядерный фарнезоидный X-рецептор FXRNR1H4, играющий ключевую роль в липогенезе, транспорте холестерина липопротеинов очень низкой плотности, триглицеридов, повышает чувствительность к инсулину;
-
восстанавливает чувствительность пероксисомальных рецепторов (PPRAg), рецепторов к инсулину, лептину, грелину, адипонектину, ингибиторам ангиотензинпревращающего фермента, ангиотензину II;
-
снижает уровень фактора некроза опухоли альфа и интерлейкина 6.
УДХК обладает также выраженным апоптоз-ингибирующим действием. Как известно, апоптоз – характерный признак НАЖБП, а выраженность апоптоза коррелирует с тяжестью НАЖБП.
Липоапоптоз – ключевой фактор развития и прогрессирования НАЖБП, при этом свободные жирные кислоты являются индукторами апоптоза гепатоцитов.
Таким образом, назначение препаратов УДХК патогенетически обосновано и эффективно.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.