количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Циклесонид (Альвеско®) – новый ингаляционный глюкокортикостероид для лечения бронхиальной астмы
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Пульмонология и оториноларингология" №2
- Аннотация
- Статья
- Ссылки
Препарат оказывает длительное действие благодаря высокой липофильности и конъюгации с жирными кислотами, что позволяет назначать циклесонид 1 раз в день. Такими фармакокинетическими особенностями циклесонида, как низкая оральная биодоступность, высокая степень связи с белками плазмы, высокий печеночный клиренс, обеспечивается уникальный профиль безопасности препарата в отношении развития нежелательных системных и локальных реакций. Все это делает Альвеско® препаратом выбора в терапии БА, особенно у детей и пациентов с высоким риском развития нежелательных явлений на фоне терапии другими ИГКС.
В статье дан обзор клинических исследований эффективности и безопасности применения при бронхиальной астме (БА) нового оригинального ингаляционного глюкокортикостероида (ИГКС) – циклесонида (Альвеско®). Циклеcонид, в отличие от других ИГКС, является пролекарством, активирующимся непосредственно в эпителиальных клетках легких. Фармакологическими особенностями молекулы циклесонида обусловлена высокая легочная депозиция препарата (52%), в том числе попадание в мелкие дыхательные пути, и равномерное распределение препарата в легких, что обеспечивает высокую противовоспалительную активность циклесонида.
Препарат оказывает длительное действие благодаря высокой липофильности и конъюгации с жирными кислотами, что позволяет назначать циклесонид 1 раз в день. Такими фармакокинетическими особенностями циклесонида, как низкая оральная биодоступность, высокая степень связи с белками плазмы, высокий печеночный клиренс, обеспечивается уникальный профиль безопасности препарата в отношении развития нежелательных системных и локальных реакций. Все это делает Альвеско® препаратом выбора в терапии БА, особенно у детей и пациентов с высоким риском развития нежелательных явлений на фоне терапии другими ИГКС.
Препарат оказывает длительное действие благодаря высокой липофильности и конъюгации с жирными кислотами, что позволяет назначать циклесонид 1 раз в день. Такими фармакокинетическими особенностями циклесонида, как низкая оральная биодоступность, высокая степень связи с белками плазмы, высокий печеночный клиренс, обеспечивается уникальный профиль безопасности препарата в отношении развития нежелательных системных и локальных реакций. Все это делает Альвеско® препаратом выбора в терапии БА, особенно у детей и пациентов с высоким риском развития нежелательных явлений на фоне терапии другими ИГКС.
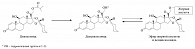
Рис. 1. Молекула циклесонида, дезциклесонида и конъюгат дезциклесонида с жирными кислотами

Рис. 2. Внутриклеточная концентрация циклесонида, дезциклесонида и эфиров дезциклесонида с жирными кислотами в эпителиальных клетках легочной ткани человека в течение 24-часовой инкубации в буферном растворе, не содержащем препарат
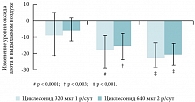
Рис. 3. Влияние циклесонида в суточной дозе 320 мкг и 640 мкг на уровень NOex у больных легкой персистирующей БА
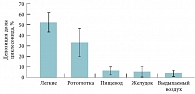
Рис. 4. Депозиция 99mTc циклесонида (320 мкг), изученная у 12 взрослых больных БА
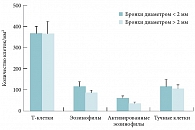
Рис. 5. Содержание клеток в слизистой бронхов разного калибра у больных БА
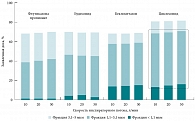
Рис. 6. Распределение частиц разного размера внутри респирабельной фракции различных ИГКС
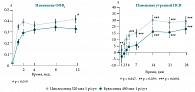
Изменение ОФВ1 и утренней ПСВ по сравнению с исходным значением в ответ на терапию циклесонидом (Альвеско®) 320 мкг 1 р/сут и будесонидом 400 мкг 1 р/сут (n = 399)
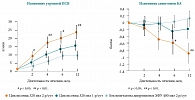
Рис. 8. Изменение утренней ПСВ и симптомов БА в ответ на терапию циклесонидом (Альвеско®) 320 мкг один раз в день или 640 мкг (320 мкг два раза в день) по сравнению с БДП-ХФУ 400 мкг 2 раза в день (n = 319)
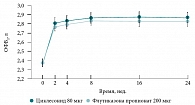
Рис. 9. Изменение ОФВ1 в ответ на терапию циклесонидом 80 мкг и флутиказона пропионатом 200 мкг у больных легкой и среднетяжелой БА
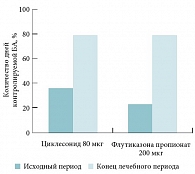
Рис. 10. Количество дней с контролируемой БА (без симптомов и без потребности в бронхолитических препаратах) у больных БА, получавших терапию циклесонидом 80 мкг 1 р/сут и флутиказона пропионатом 200 мкг (100 мкг 2 р/сут)
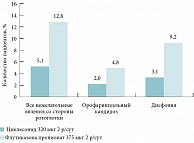
Рис. 11. Частота развития локальных нежелательных реакций со стороны ротоглотки у пациентов со среднетяжелой и тяжелой БА, получавших лечение циклесонидом или флутиказона пропионатом
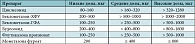
Таблица 1. Эквипотентные дозы ИГКС (зарегистрированных в РФ) для взрослых
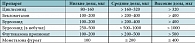
Таблица 2. Эквипотентные дозы ИГКС (зарегистрированных в РФ) для детей старше 5 лет

Таблица 4. Основные фармакокинетические свойства циклесонида и дезциклесонида после ингаляции единственной дозы 320 мкг у пациентов (19–52 лет) с БА

Таблица 3. Аффинность к ГК-рецепторам различных молекул ИГКС

Таблица 5. Распределение частиц ингаляционного глюкокортикостероида в дыхательных путях
- повышением количества бета-2-адренергических рецепторов на клетках гладких мышц бронхов и улучшением ответа на их стимул;
- уменьшением гиперпродукции слизи в бронхах;
- уменьшением числа тучных клеток в бронхиальной слизистой и усилением апоптоза эозинофилов;
- уменьшением отека слизистой и редукцией бронхиальной гиперреактивности [3, 4].
Фармакологические свойства циклесонида
Циклесонид – негалогенизированный ИГКС, который, в отличие от других ИГКС (будесонид, флутиказона пропионат), является пролекарством и активируется в фармакологически активный метаболит – дезциклесонид – эстеразами легких (рис. 1) [7]. Циклесонид как пролекарство обладает минимальной глюкокортикоидной активностью до момента конвертации в активную форму в легких, тогда как активный метаболит – дезциклесонид – имеет в 100 раз большее сродство к глюкокортикоидным (ГК) рецепторам, чем циклесонид [8]. Аффинность к ГК-рецепторам во многом определяет противовоспалительную активность молекулы глюкокортикоида. В таблице 3 представлена аффинность к ГК-рецепторам различных молекул ИГКС по сравнению с эталонной аффинностью дексаметазона, принятой за 100 [9].
Как видно из таблицы, дезциклесонид обладает высоким сродством к ГК-рецепторам. Однако прежде чем связаться с ГК-рецептором, молекула ГКС должна пройти через фосфолипидную двухслойную клеточную мембрану, то есть активность ГК-молекулы зависит от способности проникновения в клетку. Размер молекулы ИГКС и ее липофильность играют в данном процессе ключевую роль. Высокая липофильность способствует быстрому проникновению в клетку и повышению сродства к ГК-рецептору. Это свойство молекулы ИГКС коррелирует с объемом распределения и временем удержания препарата в легких. Удлинение периода времени, в течение которого препарат в активном состоянии находится в легочной ткани, закономерно будет усиливать его противовоспалительную активность. Основным механизмом данного процесса является конъюгация кортикостероида с высоколипофильными жирными кислотами в легочной ткани [10]. Связывание кортикостероида и жирной кислоты происходит через гидроксильную группу в позиции С-21 молекулы ГКС [11], которая есть у дезциклесонида (рис. 1) и отсутствует, к примеру, у флутиказона пропионата. Конъюгаты дезциклесонида с жирными кислотами (олеиновой, пальмитиновой) обнаружены в исследованиях in vitro и in vivo в легочной ткани крыс и человека [12, 13].
В исследовании T. Nonaka и соавт. [14] изучена внутриклеточная концентрация и метаболизм циклесонида в сравнении с флутиказона пропионатом в эпителиальных клетках легочной ткани человека. После инкубации концентрация циклесонида, определяемая в эпителиальных клетках легочной ткани человека (клетки аденокарциномы А649), была достоверно выше (в 1,1–2,1 раза, р < 0,001) по сравнению с флутиказона пропионатом во всех временных точках, что отражает большую липофильность циклесонида (в 7,9 раз выше, чем у флутиказона пропионата) и лучшую его способность проникать внутрь клетки, а следовательно, быстрее и эффективнее связываться с ГКС-рецепторами. В клетках циклесонид метаболизируется в фармакологически активный метаболит – дезциклесонид, который образует эфиры с жирными кислотами. Концентрация дезциклесонида в эпителиальных клетках легких остается постоянной на протяжении 24 часов (рис. 2), по-видимому, потому что он может конвертироваться из циклесонида и освобождаться из олеата дезциклесонида.
Образование ИГКС эфиров жирных кислот – процесс обратимый [12]. Эти фармакологически неактивные эфиры остаются в клетке и служат как депо циклесонида, реконвертируясь в активный метаболит – дезциклесонид, таким образом обеспечивая длительный контакт препарата с клетками дыхательных путей и легочной ткани и пролонгированную локальную противовоспалительную активность дезциклесонида. Именно это свойство циклесонида послужило доказательной основой для однократного (1 р/сут) применения препарата, эффективность этого режима была подтверждена в ряде клинических исследований [15, 16, 17]. Противовоспалительная активность циклесонида изучалась во многих исследованиях in vitro и in vivo. Циклесонид и/или дезциклесонид оказались эффективны в подавлении провоспалительных функций, включая индуцированную экспрессию адгезионных молекул и высвобождение воспалительных медиаторов, таких как гранулоцит-макрофаг-колониестимулирующий фактор, моноцитарный хемоаттрактант протеин-1 (МСР-1) [18, 19], интерферон-гамма (ИФН-гамма), интерлейкины (ИЛ) ИЛ-2, ИЛ-4, ИЛ-5, ИЛ-8 и фактор некроза опухоли альфа (ФНО-альфа), что было продемонстрировано в исследованиях in vivo [19, 20].
В небольшом (n = 21) рандомизированном двойном слепом плацебоконтролируемом исследовании применение циклесонида 1 р/сут в дозе 320 или 640 мкг привело к значительному снижению бронхиальной гиперреактивности уже в первые 2,5 часа после назначения препарата и снижению уровня оксида азота в выдыхаемом воздухе (NOex), особенно значимое на 3-й день применения циклесонида (рис. 3) [21]. Количество эозинофилов в индуцированной мокроте больных снизилось на фоне лечения циклесонидом, но значимого снижения в данном исследовании выявлено не было. Однако в ряде других исследований было убедительно продемонстрировано уменьшение числа эозинофилов и эозинофильного катионного протеина (ЕСР) в индуцированной мокроте больных, получавших терапию циклесонидом [22, 23].
Бронхиальная гиперреактивность – обязательный симптом БА, который определяется у 100% больных с персистирующими симптомами. В ходе многих исследований показано, что степень выраженности бронхиальной гиперреактивности коррелирует с тяжестью течения астмы и интенсивностью воспаления в слизистой бронхов. В этой связи бронхиальная гиперреактивность, являясь неинвазивным маркером воспаления в нижних дыхательных путях, служит дополнительным ориентиром эффективности проводимой терапии БА. Данные исследования бронхиальной гиперреактивности в ответ на аденозин монофосфат (АМФ) и метахолин у больных легкой и среднетяжелой астмой, получавших терапию циклесонидом, свидетельствуют о достоверном снижении (р < 0,05 в сравнении с плацебо или по сравнению с уровнем до лечения) бронхиальной гиперреактивности [21–24]. По влиянию на раннюю и позднюю астматическую реакцию после провокации специфическим аллергеном и уровню снижения эозинофилов в индуцированной мокроте была определена минимальная эффективная доза циклесонида у взрослых – 80 мкг 1 р/сут [25].
Фармакокинетические свойства циклесонида
Основные фармакокинетические характеристики циклесонида и дезциклесонида представлены в таблице 4. Как показали исследования, фармакокинетические свойства дезциклесонида не зависят от тяжести БА, пола, расы и веса пациентов. У пожилых больных экспозиция дезциклесонида может существенно повышаться по сравнению с пациентами молодого возраста, однако эти изменения не значимы клинически и не требуют изменения дозы. Аналогичные изменения в фармакокинетике циклесонида были отмечены у пациентов с легкими и средневыраженными нарушениями функции печени, однако это также не потребовало изменения обычной дозировки препарата [7]. Системная абсорбция циклесонида минимальна, что практически исключает возможность оказания системных эффектов. Оральная биодоступность циклесонида – < 0,5%, дезциклесонида – < 1%. Циклесонид и дезциклесонид имеют высокую связь с протеинами плазмы (≈ 99% и > 98% соответственно), а следовательно, низкую системную экспозицию (≈ 1–2%) после ингаляционного применения [7]. Дезциклесонид имеет низкую абсорбцию из гастроинтестинального тракта – быстро и практически полностью за первый пассаж, метаболизируется в печени [26].
Средняя величина депозиции циклесонида в легких составила 52% как у пациентов с легкой БА [27], так и у здоровых добровольцев [28] после одной ингаляции 320 мкг циклесонида с радиоактивной меткой или после нескольких ингаляций дозы 40 мкг, также меченной радиоактивно [28]. В данных исследованиях отмечено достаточно равномерное распределение препарата в легких, однако в периферических регионах, включающих мелкие бронхиолы и альвеолы, выявлялась бóльшая депозиция препарата по сравнению с центральными регионами, что имеет важное значение в свете современных представлений о воспалении в дистальных отделах дыхательных путей у больных астмой. В исследовании S. Newman и соавт. [27] изучалась орофарингеальная депозиция циклесонида, а также его распределение в пищеводе и желудке (рис. 4). Орофарингеальное отложение циклесонида после ингаляции из дозированного аэрозольного ингалятора (ДАИ), содержащего в качестве пропеллента гидрофторалкан (ГФА), было в 12 раз ниже, чем у будесонида, ингалируемого через ДАИ-ХФУ (хлорфторуглерод) [29], и в 7 раз ниже, чем у флутиказона пропионата, ингалируемого через ДАИ-ГФА [30]. Помимо изначально низкой орофарингеальной депозиции циклесонида, его количество в ротоглотке быстро снижается в течение 15 мин, что было отмечено у здоровых добровольцев и больных астмой после ингаляции дозы 640 мкг [29, 30]. Кроме этого, в данных исследованиях была отмечена низкая концентрация дезциклесонида в ротоглоточной фракции препарата, что позволяет предположить слабую активацию циклесонида в дезциклесонид в ротоглотке. Благодаря этим важным особенностям отмечается низкая частота локальных нежелательных явлений со стороны ротоглотки в процессе лечения циклесонидом больных БА.
Роль мелких дыхательных путей в патогенезе астмы
Долгое время БА традиционно рассматривалась как заболевание крупных и средних бронхов. Однако за последнее время получены убедительные данные, свидетельствующие, что воспалительный процесс при БА захватывает и дистальные отделы нижних дыхательных путей [31–33], так называемые мелкие дыхательные пути, к которым относят бронхи с внутренним диаметром ≤ 2 мм, то есть терминальные и респираторные бронхиолы. Изучение аутопсийного материала, полученного от умерших в результате тяжелого обострения астмы больных, показало увеличение гладкомышечной массы, гиперплазию бокаловидных клеток, слизистые пробки и воспаление, которые присутствовали как в крупных, так и в мелких бронхах [31]. Было отмечено выраженное воспаление и утолщение стенки как крупных, так и мелких бронхов, причем воспалительные клетки были равномерно распределены в проксимальных и дистальных отделах дыхательных путей [32, 33].
Некоторые воспалительные и структурные изменения в дистальных отделах легких при фатальной астме распространяются на периваскулярную область и перибронхиальные альвеолы, нарушая нормальное прикрепление альвеол. Эти повреждения обусловливают такие функциональные нарушения, как закрытие воздухоносных путей с формированием воздушных ловушек и снижение эластической отдачи легких [34]. Исследования in vivo с применением техники трансбронхиальной биопсии и иссечения ткани легкого также подтвердили вовлечение в воспалительный процесс дистальных дыхательных путей у пациентов с астмой, особенно с тяжелой формой БА [35, 36]. Воспаление, обусловленное экспрессией Тh2-цитокинов, эозинофилами и тучными клетками, выявляется как в центральных, так и в периферических отделах дыхательных путей, причем у больных тяжелой БА плотность воспалительных клеток больше в стенке мелких бронхов, чем в стенках крупных и средних бронхов [36]. Количество активированных эозинофилов было также выше в мелких дыхательных путях (рис. 5), что может свидетельствовать о наличии более выраженного воспаления в периферических дыхательных путях [37, 38]. Кроме этого, экспериментальные исследования на изолированных гладких мышцах дистальных дыхательных путей животных и человека, а также исследования in vivo у людей продемонстрировали наличие даже более высокой бронхиальной гиперреактивности мелких дыхательных путей по сравнению с крупными в ответ как на неспецифический (ацетилхолин), так и специфический (аллерген) стимулы [38, 39]. Выраженное воспаление мелких дыхательных путей у больных тяжелой, стероидорезистентной БА было выявлено с помощью техники эндобронхиальной и трансбронхиальной биопсии в исследовании S.E. Wenzel и соавт. [40].
Таким образом, дистальные, мелкие бронхи активно участвуют в патогенезе БА. ИГКС в качестве монотерапии или в комбинации с бета-2-агонистом длительного действия (ДДБА) составляют основу эффективной фармакотерапии БА, однако известно, что некоторые пациенты не достигают уровня оптимального контроля даже на фоне приема высоких доз ИГКС или комбинированных препаратов ИГКС + ДДБА. Возможно, у этих пациентов назначаемые препараты ИГКС или ИГКС + ДДБА не достигают дистального отдела легких, и воспаление в мелких бронхах продолжает персистировать, приводя к раннему закрытию дыхательных путей и образованию воздушных ловушек. В этой связи представляет интерес активно исследуемая гипотеза влияния на воспаление в мелких дыхательных путях с помощью экстрамелкодисперсных, содержащих ГФА в качестве пропеллента форм ИГКС, к которым относится циклесонид.
Циклесонид – экстрамелкодисперсный ИГКС
Преимущества ингаляционного пути введения препаратов для лечения обструктивных заболеваний легких (поступление лекарственного вещества непосредственно в пораженный орган и создание высокой концентрации препарата в дыхательных путях, быстрота наступления эффекта при минимуме побочных эффектов) абсолютно бесспорны. Но для того чтобы ингалируемый препарат достиг цели, необходимо выполнить определенные условия, главные из которых касаются, прежде всего, размера частиц лекарственного препарата (табл. 5) [41]. Предпочтительный размер частиц ингаляционного препарата, обеспечивающий равномерное распределение его в крупных и дистальных бронхах, составляет для взрослых 1–5 мкм [42], а для детей – 1,1–3 мкм [43, 44]. И чем больше таких частиц генерируется при ингаляции, тем эффективнее распределение препарата в легких. Доставленная доза, как процент от заявленной (на этикетке), равно как процент респерабельных частиц препарата в этой доставленной дозе, имеют ключевое влияние на величину легочной фракции.
Не так давно практически все производители ингаляционных лекарственных препаратов перешли на бесфреоновые формы ДАИ, согласно Международному соглашению о сохранении озонового слоя земли (Монреаль, 1987). Было налажено производство ДАИ с новым пропеллентом норфлураном (гидрофторалканом, ГФА 134а), который значимо повлиял на размер частиц некоторых ИГКС, в частности, беклометазона дипропионата, флунизолида. Циклесонид также производится в виде ДАИ, содержащего ГФА, поэтому существенная часть частиц препарата имеет размер от 1,1 до 2,1 мкм (так называемые экстрамелкодисперсные частицы) [45, 46]. В исследовании T.W. de Vries и соавт. [47] с помощью лазерного дифракционного анализа и разных инспираторных потоков было проведено сравнение доставленной дозы и размера частиц разных ИГКС: флутиказона пропионата 125 мкг, будесонида 200 мкг, беклометазона-ГФА 100 мкг и циклесонида 160 мкг. Средний аэродинамический размер частиц будесонида составил 3,5 мкм, флутиказона пропионата – 2,8 мкм, беклометазона и циклесонида – 1,9 мкм (рис. 6). Влажность окружающего воздуха и скорость инспираторного потока не оказывали значимого влияния на размер частиц. Циклесонид и беклометазон-ГФА имели самую большую фракцию мелкодисперсных частиц размером от 1,1 до 3,1 мкм. Ранее аналогичные результаты были получены при исследовании на каскадном импакторе [48, 49].
Таким образом, циклесонид ДАИ-ГФА продуцирует самую большую фракцию мелкодисперсных частиц, что делает его препаратом выбора в терапии детской БА. Применение циклесонида позволяет достичь мелких дыхательных путей и оказать противовоспалительный эффект на уровне всех бронхов. В исследовании J. Cohen и соавт. [24] изучалось влияние терапии циклесонидом (320 мкг 1 р/сут по сравнению с плацебо) у больных легкой и среднетяжелой БА на некоторые параметры, характеризующие вовлечение мелких бронхов: форсированная жизненная емкость легких (ФЖЕЛ), ФЖЕЛ 25–75, процент падения ФЖЕЛ после провокации метахолином, экспираторный легочный объем (методом компьютерной томографии (КТ)), альвеолярная фракция оксида азота (NO), объем закрытия легких. По результатам КТ у больных, получавших терапию циклесонидом, было выявлено значимое снижение альвеолярной фракции NO и уменьшение воздушных ловушек, индуцированных провокацией метахолином, по сравнению с показателями до лечения, а также группой пациентов, получавших плацебо, что свидетельствует о противовоспалительной активности циклесонида в мелких дыхательных путях.
В исследовании M. Hoshino [50] была проведена оценка влияния терапии циклесонидом 200 мкг 1 р/сут в течение 8 недель по сравнению с терапией флутиказона пропионатом 100 мкг 2 р/сут на функцию мелких дыхательных путей, оцениваемую с помощью импульсной осциллометрии, и воспаление дистальных бронхов, оцениваемое по проценту эозинофилов поздней фазы индуцированной мокроты. Циклесонид значимо снижал сопротивление мелких дыхательных путей и содержание эозинофилов поздней фазы в индуцированной мокроте по сравнению с флутиказона пропионатом, при этом значимых различий по обычным спирометрическим показателям между препаратами отмечено не было. Данные результаты свидетельствуют о влиянии циклесонида на воспаление в мелких бронхах у больных БА и об отсутствии такового у флутиказона пропионата.
Клиническая эффективность циклесонида
Эффективность циклесонида как препарата для долговременного контроля БА изучалась в большом числе клинических исследований у взрослых, подростков и детей как в сравнении с плацебо, так и с другими хорошо известными ИГКС [7, 15, 51–59]. Эквивалентность доз циклесонида другим ИГКС приведена в таблицах 1 и 2 (в соответствии с GINA (2011)). Плацебоконтролируемое исследование циклесонида (80 или 320 мкг 1 раз утром в течение 12 недель) у 360 взрослых больных с БА, леченных ранее беклометазоном, показало, что обе дозы циклесонида значительно увеличивают пиковую скорость выдоха (ПСВ) и объем форсированного выдоха за первую секунду (ОФВ1) по сравнению с плацебо [53]. Аналогичные результаты были получены и в исследовании K.R. Chapman и соавт. [15]. По сравнению с плацебо дозы циклесонида 160 и 640 мкг однократно утром были эквивалентно эффективны в поддержании утренней ПСВ, ОФВ1 и ФЖЕЛ. Результаты, полученные в ходе открытой фазы этого исследования (52 недели), продемонстрировали эффективность циклесонида. Сравнение двух идентичных по дизайну плацебоконтролируемых исследований у 1015 пациентов с легкой и среднетяжелой БА показало, что циклесонид в дозе 80, 160 или 320 мкг однократно в течение 12 недель значительно улучшает ОФВ1, редуцирует симптомы и использование бронхолитических препаратов по сравнению с плацебо [54].
Данные, полученные в ходе исследования, проведенного с участием 209 пациентов с БА, показали, что применение циклесонида 160 мкг однократно утром или вечером в течение 8 недель одинаково эффективно в отношении снижения симптомов БА и потребности в бронхолитической терапии, показателей спирометрии, но вечерняя ингаляция циклесонида приводила к достоверно более высокой утренней ПСВ у больных по сравнению с утренним режимом применения [55]. В многочисленных исследованиях сравнения циклесонида (1 или 2 р/сут) и флутиказона пропионата, будесонида и беклометазона, применявшихся в эквипотентных дозах, циклесонид продемонстрировал эквивалентную эффективность, а по некоторым параметрам даже более высокую, чем ИГКС сравнения. В рандомизированном двойном слепом, двойном плацебоконтролируемом исследовании, в котором участвовали 399 пациентов с персистирующей среднетяжелой астмой, применяли циклесонид 320 мкг (доставленная доза) 1 р/сут или будесонид 400 мкг 1 р/сут в течение 12 недель [56]. Первичным критерием эффективности был показатель ОФВ1; дополнительными критериями эффективности являлись показатели ФЖЕЛ и ПСВ, симптомы астмы, необходимость использования препаратов спасения и время до развития эффекта лечения.
Как видно на рисунке 7, циклесонид (Альвеско®) по сравнению с будесонидом демонстрирует достоверно более высокие показатели, причем увеличение ОФВ1 начинает проявляться с первых недель лечения и этот эффект сохраняется до конца исследования. Увеличение утренней ПСВ на фоне терапии циклесонидом по сравнению с терапией будесонидом развивается значительно быстрее и более выраженно. Циклесонид в дозе 320 мкг 1 р/сут и 640 мкг (320 мкг 2 р/сут) оказался не менее эффективным, чем беклометазон-ХФУ 800 мкг (400 мкг дважды), при 8-недельном лечении больных со среднетяжелой и тяжелой БА [57]. Циклесонид (Альвеско®) в дозе 640 мкг в сравнении с беклометазоном-ХФУ в дозе 800 мкг продемонстрировал более высокую статистически достоверную эффективность (р = 0,001) в отношении увеличения утренней ПСВ (первичная конечная точка), а также в уменьшении общего балла симптомов астмы (рис. 8). Помимо того, оба режима терапии циклесонидом (320 и 640 мкг) привели к более значимому снижению числа использований короткодействующих бета-2-агонистов по сравнению с терапией беклометазоном-ХФУ 800 мкг.
Сравнительная эффективность циклесонида 80 мкг 1 р/сут и флутиказона пропионата 100 мкг 2 р/сут изучалась в 24-недельном двойном слепом исследовании у 12–75-летних больных легкой и среднетяжелой БА [58]. Первичным критерием эффективности являлось изменение ОФВ1 по сравнению с базальным значением, вторичные точки эффективности включали контроль БА и качество жизни. Циклесонид в однократной суточной дозе 80 мкг оказался так же эффективен, как флутиказона пропионат в дозе 200 мкг (100 мкг 2 р/сут), в отношении ОФВ1 (статистически достоверных различий выявлено не было) (рис. 9). На фоне терапии обоими препаратами были получены идентичные показатели уровня достигнутого контроля БА и частоты обострений БА (у 5 пациентов в каждой группе наблюдалось обострение БА в течение лечебного периода) (рис. 10).
Аналогичные результаты были получены в исследовании E.D. Bateman и соавт. [59], проведенном у пациентов со среднетяжелой и тяжелой БА, получавших циклесонид 320 мкг 2 р/сут или флутиказона пропионат 375 мкг 2 р/сут в течение 6 месяцев. Оба препарата сравнения продемонстрировали нормальную эффективность, однако у пациентов, получавших циклесонид, отмечалось меньшее число нежелательных побочных эффектов со стороны ротоглотки (рис. 11), что объясняется низкой депозицией и активацией циклесонида в области рта и глотки. Таким образом, циклесонид является препаратом выбора у пациентов с БА, особенно с высоким риском развития локальных побочных реакций на ИГКС и уже отмечавших такие нежелательные явления ранее при применении ИГКС.
Заключение
- Циклесонид (Альвеско®) – ингаляционный кортикостероид новой генерации, являющийся пролекарством и активирующийся непосредственно в эпителиальных клетках легких в фармакологически активный метаболит дезциклесонид, обладающий высоким сродством к ГК-рецепторам и способностью образовывать неактивные эфиры с жирными кислотами, служащие в качестве депо циклесонида.
- Фармакологические особенности молекулы циклесонида обеспечивают высокую локальную противовоспалительную активность препарата с минимальным риском оказания системных эффектов и возможностью применения один раз в день, что способствует повышению приверженности терапии со стороны пациентов.
- Циклесонид (Альвеско®), представленный в виде ДАИ-ГФА, генерирует самую большую фракцию мелкодисперсных частиц, что обеспечивает большую легочную депозицию (52% отпущенной дозы) и равномерное распределение препарата в дыхательных путях с некоторой преимущественной депозицией в дистальных бронхах.
- Благодаря низкой депозиции и активации циклесонида в области рта и глотки частота возникновения нежелательных побочных эффектов со стороны ротоглотки у пациентов, получающих циклесонид, минимальна, что делает его препаратом выбора у пациентов, имеющих высокий риск развития локальных побочных реакций на ИГКС и уже отмечавших такие нежелательные явления ранее при применении ИГКС.
1. Report Global Strategy for Asthma Management and Prevention. GINA, 2011 // www.ginasthma.org/guidelines-gina-report-global-strategy-for-asthma.html.
2. Suissa S., Ernst P., Benayoun S. et al. Low-dose inhaled corticosteroids and the prevention of death from asthma // N. Engl. J. Med. 2000. Vol. 343. № 5. P. 332–336.
3. Leung D.Y., Bloom J.W. Update on glucocorticoid action and resistance // J. Allergy Clin. Immunol. 2003. Vol. 111. № 1. P. 3–22.
4. Barnes P.J. How corticosteroids control inflammation: Quintiles Prize Lecture 2005 // Br. J. Pharmacol. 2006. Vol. 148. № 3. P. 245–254.
5. Derendorf H., Nave R., Drollman A. et al. Relevance of pharmacokinetics and pharmacodynamics of inhaled corticosteroids to asthma // Eur. Respir. J. 2006. Vol. 28. № 5. P. 1042–1050.
6. Kelly H.W. Comparison of inhaled corticosteroids: an update // Ann. Pharmacother. 2009. Vol. 43. № 3. P. 519–527.
7. Deeks E.D., Perry C.M. Ciclesonide: a review of its use in the management of asthma // Drugs. 2008. Vol. 68. № 12. P. 1741–1770.
8. Belvisi M.G., Bundshuh D.S., Stoeck M. et al. Preclinical profile of ciclesonide, a novel corticosteroid for treatment of asthma // J. Pharmacol. Exp. Ther. 2005. Vol. 314. № 2. P. 568–574.
9. Derendorf H. Pharmacokinetic and pharmacodynamic properties of inhaled corticosteroids in relation to efficacy and safety // Respir. Med. 1997. Vol. 91. Suppl. A. P. 22–28.
10. Edsbacker S., Brattsand R. Budesonide fatty-acid esterification: a novel mechanism prolonging binding to airway tissue. Review of available data // Ann. Allergy Asthma Immunol. 2002. Vol. 88. № 6. P. 609–616.
11. Tunek A., Sjödin K., Hallström G. Reversible formation of fatty acid esters of budesonide, an antiasthma glucocorticoid, in human lung and liver microsomes // Drug Metab. Dispos. 1997. Vol. 25. № 11. P. 1311–1317.
12. Nave R., Meyer W., Fuhst R., Zech K. Formation of fatty acid conjugates of ciclesonide active metabolite in the rat lung after 4-week inhalation of ciclesonide // Pulm. Pharmacol. Ther. 2005. Vol. 18. № 6. P. 390–396.
13. Nave R., Fisher R., Zech K. In vitro metabolism of ciclesonide in human lung and liver precision-cut tissue slices // Biopharm. Drug Dispos. 2006. Vol. 27. № 4. P. 197–207.
14. Nonaka T., Nave R., McCracken N. et al. Ciclesonide uptake and metabolism in human alveolar type II epithelial cells (A549) // BMC Pharmacol. 2007. Vol. 7. P. 12.
15. Chapman K.R., Patel P., D'Urzo A.D. et al. Maintenance of asthma control by once-daily inhaled ciclesonide in adults with persistent asthma // Allergy. 2005. Vol. 60. № 3. P. 330–337.
16. Langdon C.G., Adler M., Mehra S. et al. Oncedaily ciclesonide 80 or 320 microg for 12 weeks is safe and effective in patients with persistent asthma // Respir. Med. 2005. Vol. 99. № 10. P. 1275–1285.
17. Boulet L.P., Drollmann A., Magyar P. Comparative efficacy of once-daily ciclesonide and budesonide in the treatment of persistent asthma // Respir. Med. 2006. Vol. 100. № 5. P. 785–794.
18. Boero S., Sabatini F., Silversti M. et al. Modulation of human lung fibroblast functions by ciclesonide: evidence for its conversion into the active metabolite desisobutyryl-ciclesonide // Immunol. Lett. 2007. Vol. 112. № 1. P. 39–46.
19. Silversti M., Serpero L., Petecchia L. et al. Cytokine-activated bronchial epithelial cell pro-inflammatory functions are effectively downregulated in vivo by ciclesonide // Pulm. Pharmacol. Ther. 2006. Vol. 19. № 3. P. 210–217.
20. Stoeck M., Reiedel R., Hochhaus G. et al. In vitro and in vivo antiinflammatory activity of the new glucocorticoid ciclesonide // J. Pharmacol. Exp. Ther. 2004. Vol. 309. № 1. P. 249–258.
21. Erin E.M., Zacharasiewisz A.S., Nicholson G.C. et al. Rapid antiinflammatory effect of inhaled ciclesonide in asthma: a radomised, placebo-controlled study // Chest. 2008. Vol. 134. № 4. P. 740–745.
22. Kanniess F., Richter K., Böhme S. et al. Effect of inhaled ciclesonide on airway responsiveness to inhaled AMP, the composition of induced sputum and exhaled nitric oxide in patients with mild asthma // Pulm. Pharmacol. Ther. 2001. Vol. 14. № 2. P. 141–147.
23. Wilson A.M., Duong M., Pratt B. et al. Anti-inflammatory effects of once daily low dose inhaled ciclesonide in mild to moderate asthmatic patients // Allergy. 2006. Vol. 61. № 5. P. 537–542.
24. Cohen J., Douma W.R., ten Hachen N.H. et al. Ciclesonide improves measures of small airway involvement in asthma // Eur. Respir. J. 2008. Vol. 31. № 6. P. 1213–1220.
25. Gauvreau G.M., Watson R.M., Postma D.S. et al. Effect of ciclesonide 40 μg and 80 μg on early and late asthmatic reaction, and sputum eosinophils after allergen challenge in patients with mild asthma [abstract] // J. Allergy Clin. Immunol. 2005. Vol. 115. Is. 2. P. 210.
26. Peet C.F., Enos T., Nave R. et al. Identification of enzymes involved in phase I metabolism of ciclesonide by human liver microsomes // Eur. J. Drug Metab. Pharmacokinet. 2005. Vol. 30. № 4. P. 275–286.
27. Newman S., Salmon A., Nave R., Drollmann A. High lung deposition of 99mTc-labeled ciclesonide administered via ГФА-MDI to patients with asthma // Respir. Med. 2006. Vol. 100. № 3. P. 375–384.
28. Leach C.L., Bethke T.D., Boudreau R.J. et al. Two-dimensional and three-dimensional imaging show ciclesonide has high lung deposition and peripheral distribution: a nonrandomized study in healthy volunteers // J. Aerosol. Med. 2006. Vol. 19. № 2. P. 117–126.
29. Nave R., Zech K., Bethke T.D. Lower oropharyngeal deposition of inhaled ciclesonide via hydrofluoroalkane metered-dose inhaler compared with budesonide via chlorofluorocarbon metered-dose inhaler in healthy subjects // Eur. J. Clin. Pharmacol. 2005. Vol. 61. № 3. P. 203–208.
30. Richter K., Kanniess F., Biberger C. et al. Comparison of the oropharyngeal deposition of inhaled ciclesonide and fluticasone propionate in patients with asthma // J. Clin. Pharmacol. 2005. Vol. 45. № 2. P. 146–152.
31. Saetta M., Di Stefano А., Rosina C. et al. Quantitative structural analysis of peripheral airways and arteries in sudden fatal asthma // Am. Rev. Resp. Dis. 1991. Vol. 143. № 1. P. 138–143.
32. Carroll N., Cooke C., James A. The distribution of eosinophils and lymphocytes in the large and small airways of asthmatics // Eur. Respir. J. 1997. Vol. 10. № 2. P. 292–300.
33. Caroll N., Carello S., Cooke C., James A. Airway structure and inflammatory cells in fatal attacks of asthma // Eur. Respir. J. 1996. Vol. 9. № 4. P. 709–715.
34. Mauad T., Silva L.F., Santos M.A. et al. Abnormal alveolar attachments with decreased elastic fiber content in distal lung in fatal asthma // Am. J. Respir. Crit. Care Med. 2004. Vol. 170. P. 857–862.
35. Hamid Q., Song Y., Kotsimbos T.C. et al. Inflammation of small airways in asthma // J. Allergy Clin. Immunol. 1997. Vol. 100. № 1. P. 44–51.
36. Balzar S., Wenzel S.E., Chu H.W. Transbronchial biopsy as a tool to evaluate small airways in asthma // Eur. Respir. J. 2002. Vol. 20. № 2. P. 254–259.
37. Hamid Q.A. Peripheral inflammation is more important than central inflammation // Respire Med. 1997. Vol. 91. Suppl. A. P. 11–12.
38. Mitchell H.W., Cvetkovski R., Sparrow M.P. et al. Concurrent measurement of smooth muscle shortening, lumen narrowing and flow to acetylcholine in large and small porcine bronchi // Eur. Respir. J. 1998. Vol. 12. № 5. P. 1053–1061.
39. Ellis J.L., Hubbard W.C., Meeker S., Undem B.J. Ragweed antigen E and anti-IgE in human central versus peripheral isolated bronchi // Am. J. Respir. Crit. Care Med. 1994. Vol. 150. № 3. P. 717–723.
40. Wenzel S.E., Szefler S.J., Leung D.Y. et al. Bronchoscopic evaluation of severe asthma. Persistent inflammation associated with high dose glucocorticoids // Am. J. Respir. Crit. Care Med. 1997. Vol. 156. № 3. Pt. 1. P. 737–743.
41. Lipworth B.J. Targets for inhaled treatment // Respir. Med. 2000. Vol. 94. Suppl. D. P. 13–16.
42. Esposito-Festen J.E., Zanen P., Tiddens H.A., Lammers J.W. Pharmacokinetics of inhaled monodisperse beclomethasone as a function of particle size // Br. J. Clin. Pharmacol. 2007. Vol. 64. № 3. P. 328–334.
43. Lindstroem M. Particles in small airways: mechanisms for deposition and clearance. Thesis, Stockholm: Karolinska Institute, 2004. 52 p.
44. Schuepp K.G., Jauernig J., Janssens H.M. et al. In vitro determination of the optimal particle size for nebulised aerosol delivery to infants // J. Aerosol. Med. 2005. Vol. 18. № 2. P. 225–235.
45. Colice G.L. The newly developed inhaled corticosteroid ciclesonide for the treatment of asthma // Expert Opin. Pharmacother. 2006. Vol. 7. № 15. P. 2107–2117.
46. Rohatagi S., Appajosyula S., Derendorf H. et al. Risk-benefit value of inhaled glucocorticoids: a pharmacokinetic/pharmacodynamic perspective // J. Clin. Pharmacol. 2004. Vol. 44. № 1. P. 37–47.
47. De Vries T.W., Rottier B.L., Gjaltema D. et al. Comparative in vitro evaluation of four corticosteroid metered dose inhalers: Consistency of delivered dose and particle size distribution // Respir. Med. 2009. Vol. 103. № 8. P. 1167–1173.
48. Barry P.W., O’Callaghan C. A comparative analysis of the particle size output of beclomethasone dipropionate, salmeterol xinafoate and fluticasone dipropionate metered dose inhalers used with the Babyhaler, Volumatic and Aerochamber spacer // Br. J. Clin. Pharmacol. 1999. Vol. 47. № 4. P. 357–360.
49. Stein S.W. Size distribution measurements of metered dose inhalers using Andersen Mark II cascade impactors // Int. J. Pharm. 1999. Vol. 186. № 1. P. 43–52.
50. Hoshino М. Comparison of effectiveness in ciclesonide and fluticasone propionate on small airway function in mild asthma // Allergol. Int. 2010. Vol. 59. № 1. P. 59–66.
51. Dahl R. Ciclesonide for the treatment of asthma // Ther. Clin. Risk Manag. 2006. Vol. 2. № 1. P. 25–38.
52. Stoloff S.W., Kelly H.W. Updates on the use of inhaled corticosteroids in asthma // Curr. Opin. Allergy Clin. Immunol. 2011. Vol. 11. № 4. P. 337–344.
53. Langdon C.G., Adler M., Mehra S. et al. Once-daily ciclesonide 80 or 320 microg for 12 weeks is safe and effective in patients with persistent asthma // Respir. Med. 2005. Vol. 99. № 10. P. 1275–1285.
54. Pearlman D., Creticos P., Lampl K. et al. Once-daily ciclesonide is effective and well-tolerated in adult and adolescent patients with mildto-moderate asthma [abstract] // J. Allergy Clin. Immunol. 2005. Vol. 115. P. 845.
55. Postma D.S., Sevette C., Martinat Y. et al. Treatment of asthma by the inhaled corticosteroid ciclesonide given either in the morning or evening // Eur. Respir. J. 2001. Vol. 17. № 6. P. 1083–1088.
56. Ukena D., Biberger C., Steinijans V. et al. Ciclesonide is more effective than budesonide in the treatment persistant asthma // Pulm. Pharmacol. Ther. 2007. Vol. 20. № 5. P. 562–570.
57. Adachi M., Ishihara K., Inoue H. et al. Efficacy and safety of ciclesonide compared with chlorofluorocarbone beclometasone dipropionate in adults with moderate to severe persistent asthma // Respirology. 2007. Vol. 12. № 4. P. 573–580.
58. Dahl R., Engelstatter R., Trebas-Pietraś E., Kuna P. A 24-week comparison of low-dose ciclesonide and fluticasone propionate in mild to moderate asthma // Respir. Med. 2010. Vol. 104. № 8. P. 1121–1130.
59. Bateman E.D., Linnhof A.E., Homik L. et al. Comparison of twice-daily inhaled ciclesonide and fluticasone propionate in patients with moderate-to-severe persistent asthma // Pulm. Pharmacol. Ther. 2008. Vol. 21. № 2. P. 264–275.
Новости на тему
28.12.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.