Цитологическая и иммуноцитохимическая диагностика злокачественных опухолей яичника
- Аннотация
- Статья
- Ссылки
В статье представлено собственное исследование, проведенное врачами ГУЗ «Алтайский краевой онкологический диспансер» Алтайского филиала ФГБУ «РОНЦ им Н.Н. Блохина» РАМН.
Исследовалось развитие карциноматозного плеврита как одного из самых часто встречаемых осложнений при раке яичников. Также с использованием цитологического метода диагностики определялись маркеры для дифференциации рака яичника и метастатичекого поражения в яичник при других видах рака.
В статье представлено собственное исследование, проведенное врачами ГУЗ «Алтайский краевой онкологический диспансер» Алтайского филиала ФГБУ «РОНЦ им Н.Н. Блохина» РАМН.
Исследовалось развитие карциноматозного плеврита как одного из самых часто встречаемых осложнений при раке яичников. Также с использованием цитологического метода диагностики определялись маркеры для дифференциации рака яичника и метастатичекого поражения в яичник при других видах рака.
Проблема диагностики и лечения опухолей и опухолевидных образований яичников чрезвычайно актуальна не только в связи с ростом частоты заболевания, но и по причине тяжести вызываемых ими нарушений репродуктивной и других систем организма. По данным различных авторов, частота опухолей яичников возрастает и за последние 10 лет увеличилась с 6–11% до 19–25% среди других опухолей половых органов [6, 7]. Опухоли яичников являются причиной утраты трудоспособности, что обусловливает социальный и экономический аспект данной патологии.
Существует зависимость частоты возникновения рака яичника от таких факторов, как географическое положение и принадлежность к определенным этническим группам. Так, высокий уровень заболеваемости отмечен в Северной Европе и Соединенных Штатах Америки, а низкий – в Японии. Большинство случаев возникают спорадически, однако в 5–10% наблюдений возникновение рака яичника связано с наследственными факторами. Этиология рака яичника изучена плохо. Важное значение в канцерогенезе рака яичника имеет количество циклов овуляции, являющееся индексом развития рака яичника. При этом способствующий фактор – высокий гормональный фон. Определенную роль в патогенезе рака яичника может играть воздействие различных канцерогенных веществ.
Эпидемиологические и молекулярно-генетические исследования определяют многочисленные факторы риска возникновения рака яичника. При исследовании молекулярно-генетических факторов установлено, что мутации в BRCA1 и BRCA2 ответственны за большинство случаев его возникновения. Пятилетнее использование оральных противозачаточных средств может сократить наполовину риск развития заболевания, что актуально для женщин с наследственным раком яичника. При мультимодальном подходе в лечении, с учетом агрессивной циторедуктивной хирургии и комбинированной химиотерапии, удается добиться следующих показателей пятилетней выживаемости: стадия I – 93%, стадия II – 70%, стадия III – 37% и стадия IV – 25% [8].
Очень важно диагностировать рак яичника на ранней стадии заболевания и таким образом продлить выживание, однако сделать это очень сложно. На основании клинических, морфологических и молекулярно-генетических данных опухоли яичника делят на две группы – I и II типа. Опухоли I типа медленно растут, возникают из пограничных опухолей. К ним относятся микропапиллярные, серозные, муцинозные, эндометриоидные аденокарциномы. Они характеризуются мутациями в различных генах, включая KRAS, BRAF, PTEN. Опухоли II типа отличаются быстрым ростом, очень агрессивны, как правило, не связаны с предшествующими пограничными опухолями. Обычно они диагностируются на поздних стадиях. К ним относятся опухоли высокой степени злокачественности – серозные аденокарциномы, злокачественные мезодермальные опухоли (карциносаркомы) и недифференцированные карциномы. Опухоли II типа характеризуются мутацией гена р53 и высокой генетической неустойчивостью и составляют большинство опухолевых образований яичника [9].
На начальных этапах заболевания рак яичника не имеет клинических симптомов [5]. Даже при наличии диссеминации метастазов в брюшной полости клиника заболевания носит «стертый» характер. Так, от 75 до 80% случаев рак яичника диагностируется только на III–IV стадиях болезни. Клиническое обследование малого таза с помощью ректовагинального исследования нередко позволяет идентифицировать новообразование яичника. Далее в алгоритме обследования при подозрении на опухоли яичника используется ультразвуковое исследование малого таза, которое стало рутинным методом диагностики. Достоинством ультразвукового метода в диагностике опухолей яичников является его высокая информативность, простота, быстрота, безболезненность, возможность многократного проведения исследования.
Следующим этапом углубленной диагностики является рентгеновская компьютерная томография. Магнитно-резонансная томография как более совершенный метод диагностики используется для оценки степени распространения злокачественного опухолевого процесса. Большое значение в диагностике опухолей яичников отводится биохимическому и иммунологическому определению опухолевых маркеров [10]. В заключение обследования пациенток с подозрением на наличие злокачественной опухоли яичников показано рентгенологическое исследование грудной полости для исключения метастатического плеврита. Также необходимо исключить рак желудка с вторичным поражением яичников или прорастание ректо-сигмоидного отдела кишки опухолью яичника. Окончательный диагноз может быть поставлен только при морфологическом исследовании [11]. Опухоли яичников характеризуются быстрым ростом и ранней диссеминацией опухолевых клеток по серозным оболочкам.
Стандартной терапией рака яичника является двустороннее удаление матки с придатками и шесть курсов внутривенной химиотерапии карбоплатином и паклитакселом. 75% пациентов изначально диагностируются с распространенной формой болезни (III или IV стадии). В 80% наблюдений отмечен эффект от первой линии химиотерапии, рецидив опухоли происходит у этих пациенток в среднем через 15 месяцев с момента постановки диагноза. Вторая линия химиотерапии может улучшить результаты выживаемости и качество жизни, но не лечит. Достижения в области выбора химиотерапии и понимание молекулярного патогенеза рака яичников, а также разработка новых препаратов таргетной терапии (таких как бевацизумаб) и внутрибрюшинное введение препаратов являются перспективными для улучшения результатов лечения пациенток [12, 13].
Материалы и методы исследования
В исследование включены 94 женщины в возрасте 34–78 лет с наличием плеврита при раке яичников, находившиеся на лечении в ГУЗ «Алтайский краевой онкологический диспансер» (АКОД), Алтайский филиал ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН. Развитие карциноматозного плеврита при раке яичников отмечено у 5,1% пациенток от абсолютного числа больных (n = 1861) с прижизненно установленным диагнозом за данный период. У 71 (75,5%) больной на момент развития плеврита в анамнезе отмечен рак яичника, 23 (24,5%) женщины с наличием карциноматозного плеврита обратились за медицинской помощью впервые. Цитологически в утвердительной или предположительной форме метастатическое поражение плевры расценивали как метастаз рака яичника, что впоследствии было подтверждено в окончательном диагнозе.
При раке яичника карциноматозный плеврит в течение года возник у 69 (73,4%) пациенток, через 2–3 года – у 16 (17,0%), через 5 и 6 лет – у 3 (3,2%) и 5 (5,3%) соответственно. Отмечено единственное наблюдение (1,1%) возникновения плеврита через 17 лет с момента установления диагноза рака яичника. Во всех случаях цитологически установлена аденокарцинома, других форм злокачественных опухолей в плеврите не наблюдали. У 32 (34,0%) пациенток при констатации аденокарциномы в плевритах цитологически диагноз на метастазирование из яичников был утвердительным, что было особенно важно для 23 (24,5%) женщин с наличием карциноматозного плеврита, обратившихся за медицинской помощью
впервые.
В 3 (3,2%) наблюдениях проведена дифференциальная диагностика между высокодифференцированной аденокарциномой яичника и эпителиоидной мезотелиомой. Опухолевые клетки располагались по препарату раздельно, не образуя типичных для аденокарциномы яичника железистоподобных структур. При проведении окрашивания на муцикармин опухолевые клетки имели положительную реакцию, что позволило предполагать первоисточник опухоли в яичнике. В соответствии с особенностями преобладающих в жидкости опухолевых клеток выделяют 3 основных цитологических варианта аденокарцином: серозная, муцинозная и эндометриоидная.
Серозный рак яичника в карциноматозном плеврите
Среди злокачественных эпителиальных опухолей яичников главенствующая роль принадлежит серозному раку. Серозный рак – наиболее частая (около 1/3 всех эпителиальных новообразований) злокачественная опухоль яичника [11]. Серозный рак обычно диссеминирует по брюшине, часто метастазирует по плевральным листкам, вызывая обильную экссудацию. Серозная аденокарцинома цитологически установлена в 92 (97,9%) наблюдениях. Высокодифференцированная папиллярная аденокарцинома отмечена чаще всего – в 44 (47,8%) наблюдениях. В 27 (29,3%) случаях диагностирована умеренно дифференцированная папиллярная аденокарцинома и в 5 (5,4%) – низкой степени дифференцировки. В 16 (17,5%) случаях степень дифференцировки в практической работе не была указана.
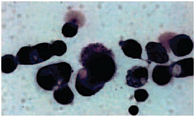
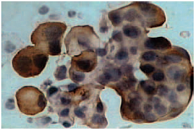
При высокодифференцированных серозных аденокарциномах среди клеток пролиферирующего мезотелия отмечаются компактные сосочковые структуры, железистые комплексы небольшой величины. Опухолевые клетки – мелкие и средние по размеру (около 20 мкм в диаметре), округлой и овальной формы. Ядра занимают большую часть клеточных тел, имеют ровные четкие контуры. Хроматин интенсивно окрашен, сетчатый, равномерно распределен под ядерной мембраной. Ядрышки просматриваются редко. Цитоплазма скудная, базофильная, в единичных клетках мелкозернистая. При дифференцированных формах серозного рака яичников отмечаются секретирующие клетки. В цитологических препаратах наблюдаются клетки с признаками секреции в виде венчика тонких волоконец с одного полюса, подобно ресничкам (рис. 1).
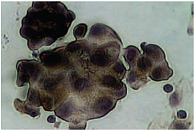
Этот признак принято считать патогномоничным для рака яичника, встречается он еще лишь при карциноматозе серозного папиллярного рака эндометрия, ни при каких других аденокарциномах этот признак не отмечен. Вспомогательным диагностическим признаком рака яичника являются псаммомные тельца – известковые образования, напоминающие осколки битого стекла или слоистые кольцевидные массы (рис. 2). В окрашенных препаратах они располагаются, как правило, в центре железистоподобных и папиллярных структур [14]. Подобные образования наблюдаются при папиллярных раках щитовидной железы с кистообразованием и карциноматозном плеврите бронхиоло-альвеолярного рака легкого. Такие цитологические признаки, как «венчикоподобная» секреция и псаммомы, отмечены в 23 (25,0%) наблюдениях.
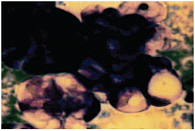
В цитологическом материале при умереннодифференцированной серозной аденокарциноме отмечаются многочисленные железистые и железисто-папиллярные комплексы. Железистые комплексы состоят из клеток разного размера, форм, интенсивности окраски в пределах одного комплекса. Отмечается большое число изолированных клеток, нередко уродливых, одно-, двух- и многоядерных. Особенностью рака яичника является усиление вакуолизации цитоплазмы, вплоть до образования огромных пузырей с четкими очертаниями. На границе клетки располагаются ядра овальной формы, так как смещены к краю прозрачным содержимым, отмечаются крупные оптически «пустые» вакуоли (рис. 3). Этот признак, по нашим данным, является наиболее частым характерным для серозного рака яичника, в сравнении с аденокарциномой при других локализациях. Выраженная вакуолизация цитоплазмы наблюдалась у 57 (62,0%) включенных в исследование пациентов.
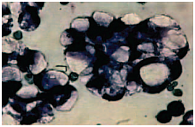
Серозная аденокарцинома яичника низкой дифференцировки отличается клеточными скоплениями с резко выраженным полиморфизмом клеток. Размер клеток опухоли варьировал от мелких до гигантских. Ядра клеток – неправильной формы, уродливые, разной окраски. В ядрах просматривались гипертрофированные ядрышки. Хроматин в одних клетках компактный и гиперхромный, в других – рыхлый, неравномерно распределенный. Отмечалось также большое количество митозов и разрушенных клеток.
Муцинозный рак яичника в карциноматозном плеврите
Муцинозные и эндометриоидные аденокарциномы яичников встречаются значительно реже серозных. В настоящем исследовании в 2 (2,1%) случаях, по данным морфологического исследования, в удаленном яичнике выявлена муцинозная аденокарцинома. В препаратах преобладали слизистые массы, в которых располагались лимфоциты, гистиоциты, макрофаги, клетки мезотелия, а также небольшие комплексы средних по величине раковых клеток. Такие наблюдения были отмечены в асцитической жидкости. В плевральной жидкости у данных женщин слизистых масс не наблюдали. Цитологические картины в этих случаях были аналогичны серозному раку, по всей видимости, клетки опухоли утрачивают способность продуцировать слизь.
Эндометриоидный рак яичника в карциноматозном плеврите
Эндометриоидные аденокарциномы яичника морфологически всегда напоминают эндометриоидные аденокарциномы эндометрия [11, 15]. Эндометриоидную аденокарциному яичника в данной работе в плевральной жидкости не наблюдали. В практической работе чаще диагностируется рак яичника в материале, полученном при пункции через задний свод влагалища, или в асцитической жидкости.
Результаты и их обсуждения
Особенности диагностики рака яичника в карциноматозном плеврите
Имеются наблюдения, при которых цитологическое исследование плевральной жидкости позволило не только диагностировать высокодифференцированный аденогенный рак, но и констатировать рак яичника по имеющимся цитологическим признакам. При обследовании 33-летней женщины в плевральной жидкости были обнаружены клетки высокодифференцированной аденокарциномы. Больная была направлена в онкологический стационар для дальнейшего обследования и лечения. При микроскопии препаратов в отдельных комплексах выявлены псаммомные тельца, также единичные секретирующие элементы с характерным расположением «венчикоподобных» слизистых масс по поверхности клетки в виде тонких волоконец. Неоднократные процедуры обследования не позволяли диагностировать рак яичника. Первичный очаг опухоли установить было затруднительно. При лапароскопии на правом яичнике обнаружено образование около 10 мм в диаметре, при удалении и исследовании которого установлен рак яичника. Данным примером показано, что иногда первичная причина обращения больного к врачу является следствием основного заболевания, причину которого установить весьма затруднительно.
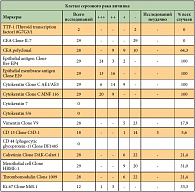
В сложных для диагностики случаях, при обнаружении опухолевых клеток в плеврите, существенную помощь оказывают иммуноцитохимические исследования. Иммуноцитохимические исследования при раке яичника с карциноматозным плевритом с целью уточнения первичной локализации опухолевого процесса проведены у 29 женщин, обратившихся за медицинской помощью впервые, в одном случае для дифференциальной диагностики карциноматозного плеврита у пациентки при синхронном раке яичника и молочной железы (табл. 1).
TTF-1 (thyroid transcription factor) В карциноматозном плеврите при раке яичника в проведенных исследованиях TTF-1 был отрицательным.
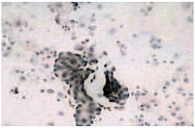
Моно- и поликлональные CEA Отрицательная реакция с моноклональным раково-эмбриональным антигеном (СЕА) (Clone II-7) оказалась наиболее ценной. Во всех 29 наблюдениях карциноматозного плеврита при раке яичника она была негативной (рис. 4). Подтверждение наших данных мы нашли в статье W. Zhu и соавт. [16], в которой моноклональный CEA также не наблюдался у 20 женщин при карциноматозном плеврите (0/20, 0%). Данная реакция позволила дифференцировать рак яичника и молочной железы (табл. 1). Реакция на поликлональный СЕА в половине наблюдений была слабо и умеренно положительной (64,3%).
Эпителиальный антиген (Clone Ber-EP4) Из 29 исследуемых жидкостей реакция на эпителиальный антиген была положительной в 100% случаев (рис. 5), ярко выраженной – в 24 наблюдениях, умеренной – в 3 и слабой – в 2 наблюдениях.
Эпителиальный мембранный антиген (Clone Е29) Цитоплазматическое иммуноокрашивание эпителиального мембранного антигена оценивали в 29 наблюдениях, оно было умеренной или выраженной (100%) экспрессии.
Цитокератины Цитокератины MNF116 и АЕ1/АЕ3 при раке яичника были положительны во всех 29 наблюдениях (100%). Более выраженное окрашивание отмечено на пан-цитокератины MNF116. Реакция на Cytokeratin 7 и Cytokeratin 5/6 не проводилась.
Виментин Из 28 наблюдений при серозном раке яичника виментин отмечен (+) в 5 (17,9%) случаях.
Лейкоцитарный антиген CD 15 В работе маркер CD 15 использован у 18 больных при карциноматозном плеврите при раке яичника. В 14 случаях реакция иммунонегативна, в 1 случае отмечена слабая цитоплазматическая реакция. Чувствительность составила 5,6%. CD 44 не использовали.
Мезотелин, калретинин и тромбомодулин При серозной аденокарциноме на мезотелиальные антитела отмечена слабая положительная реакция в 21,4–31,0% случаев (рис. 6). Некоторые авторы отмечают как важные компоненты иммуноцитохимической панели использование для определения рака из яичника СА-125 и НВМЕ-1 [17].
Ki-67 Ki-67 изучен у женщин в 12 плевритах, индекс ядерного окрашивания маркера пролиферации отмечен в 33,3%. Подобные результаты (индекс 33,1 ± 16,7) отмечены в работе M. Choudhury и соавт. [18]. По другим данным, средний пролиферативный индекс составлял приблизительно 10,5% [19].
Для метастазов аденогенных раков в серозные полости в большинстве наблюдений характерна иммунопозитивная реакция на поликлональный раково-эмбриональный антиген, эпителиальный и эпителиально-мембранный антигены, цитокератины, в то время как реакция на калретинин, мезотелин и тромбомодулин почти всегда негативна. Для серозной аденокарциномы яичника характерна отрицательная реакция на моноклональный раково-эмбриональный антиген.
В последнее время в литературе появились сообщения об использовании в диагностике плевритов при раке яичника маркера CDX-2 в дифференциальном диагнозе между первичным муцинозным раком яичника и метастатическими (интестинальными) опухолями. Дифференциальный диагноз представляется чрезвычайно сложной задачей, тем не менее он важен для определения характера хирургического вмешательства, назначения химиотерапии и предвидения прогноза. CDX-2 – специфический и чувствительный маркер, который может помочь морфологам в получении дифференциального диагноза (p = 0,003 и p < 0,005 соответственно), поскольку СЕА, СК20, СА125 недостаточно убедительны, чтобы определить первичные и метастатические муцинозные опухоли [20]. В данной работе эти маркеры не использовались.
Сочетание СК7+/СК20- характерно для первичных эндометриоидных аденокарцином, обратный профиль встречается в большинстве метастатических интестинальных аденокарцином со схожей псевдоэндометриоидной аденокарциномой морфологически, хотя подобное сочетание отмечено во многих случаях. Это сочетание малоинформативно при дифференциальной диагностике первичных и метастатических муцинозных форм рака [21].
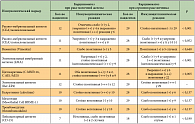
Проведено сравнение использования иммуноцитохимических исследований в плевральной жидкости при раке яичника и молочной железы (табл. 2). Наиболее ценной оказалась реакция с моноклональным раково-эмбриональным антигеном (Clone II-7), которая во всех наблюдениях карциноматозного плеврита при раке яичника была негативной. Точный диагноз особенно важен, так как медиана выживаемости с момента установления карциноматозного плеврита при раке яичника составила 7 месяцев. По данным литературы при раке яичника рекомендуется использовать маркер WT1, который в своей работе мы не применяли. Серозный рак яичника практически в 100% имеет положительную реакцию на WT1, а муцинозные и светлоклеточные формы рака яичника к нему отрицательны. Эндометриоидные аденокарциномы могут быть как отрицательными для WT1, так и положительными в 50% случаев. [22].
Метастаз рака молочной железы в яичник трудно отличить от первичного рака яичника. Эта проблема нередко возникает у больных при раке молочной железы с появлением образования в яичниках. ЭР и ПР могут быть положительными при многих опухолях молочной железы и раке яичника и поэтому не могут использоваться в дифференциальной диагностике. WT1 и СА125 были оценены как возможные маркеры для рака яичника. Однако исследований, которые бы более определенно сравнивали иммунофенотип рака молочной железы, метастазирующего в яичник и первичный рак яичника еще не осуществлялось, были проведены исследования только иммуногистохимическим методом с использованием WT1, СА125, СЭА, MUC2, MUC1, и GCDFP. Для рака яичника 76% были положительны для WT1, из них 31 из 33 (94%) оказались серозными аденокарциномами. В большинстве наблюдений отмечено выраженное окрашивание. Ни в одном из наблюдений рака молочной железы, первичном или метастазирующем в яичник, не выявлена экспрессия WT1.
90% случаев рака яичника были положительны на СА125, большая часть из них с выраженным окрашиванием. При исследовании рака молочной железы реакция на большинство карцином груди была отрицательной на СА125, только в 16% первичных и 12% метастатических раков имели слабое и умеренное окрашивание. При исследовании клеток рака яичника на GCDFP результаты были отрицательными, а при раке молочной железы 14% первичных и 43% метастазов в яичник – положительны для GCDFP. 21% случаев при раке яичника, 22% первичных рака молочной железы и 33% метастазов в яичник были положительны для СЭА.
Почти все исследованные опухоли были положительны для MUC1 – 100% карцином яичника, 100% первичного рака молочной железы и 95% метастатического рака молочной железы в яичник. MUC2 был положителен в 24% случаев рака яичника, в 8% при первичном раке молочной железы и 30% при метастазах в яичник. Иммунореактивность для WT1 и СА125 выражена при раке яичника. В большинстве наблюдений рак яичника положителен для обоих маркеров, тогда как большинство метастазов рака молочной железы в яичник отрицательны. GCDFP может быть дополнительным маркером в этом отличительном диагнозе [23].
Серозная папиллярная аденокарцинома яичников или эндометрия и папиллярный рак молочной железы морфологически имеют некоторые общие признаки. При возникновении этих опухолей синхронно или метахронно у одной пациентки трудно диагностировать, является ли это одной формой рака и его метастазов или двумя самостоятельными опухолями. При оценке 23 серозных папиллярных аденокарцином (16 из яичника, 5 из эндометрия и 2 первичные серозные опухоли брюшины) и 37 папиллярных карцином молочной железы (12 чистых и 25 смешанного типа) проводилось иммуногистохимическое исследование с использованием антигена опухоли Вильма 1 (WT1), СА125 и маркера GCDFP-15, которые были полезны в дифференциальном диагнозе первичного рака яичника и метастаза рака молочной железы в яичник.
Иммунореактивность WT1, СА125 и GCDFP-15 в серозных папиллярных аденокарциномах яичника составляла 78, 78 и 0%, а в агрессивных микропапиллярных раках молочной железы – 3, 40 и 38% соответственно. СА125-положительный уровень агрессивной папиллярной карциномы молочной железы был выше, чем уровень при других типах рака молочной железы. В связи с этим СА125 не может являться полезным маркером в дифференциальном диагнозе этих опухолей. Хотя положительный уровень WT1 был значительно выше в серозной папиллярной аденокарциноме, чем в агрессивной папиллярной карциноме молочной железы, экспрессия WT1 в серозной папиллярной эндометриальной аденокарциноме наблюдалась в 20,0%. WT1 и GCDFP-15 могли быть полезными маркерами для отличительного диагноза рака яичника и первичной серозной папиллярной аденокарциномы брюшины при дифференциальной диагностике с агрессивной папиллярной аденокарциномой молочной железы [23].
Выживаемость больных с карциноматозным плевритом при раке яичника
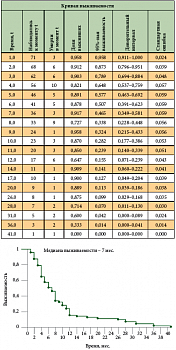
Продолжительность жизни за изучаемый период после возникновения карциноматозного плеврита у женщин при раке яичника до 1 года отмечена у 54 (57,4%) пациенток, 1–2 года – у 9 (9,6%), 3 года – у 5 (5,3%), более 3 лет – у 3 (3,2%) пациенток (рис. 7). Продолжительность жизни 4 (4,3%) женщин проследить не удалось: пациентки выехали за пределы края и России. При поддерживающей химиотерапии в условиях ГУЗ АКОД 19 (20,2%) пациенток живы без признаков прогрессирования опухолевого процесса.
Таким образом, развитие карциноматозного плеврита при раке яичника отмечено у 5,1% пациенток от абсолютного числа больных. Использование цитологического метода диагностики с применением иммуноцитохимических методик является высокоинформативным методом, позволяющим предположить первичную локализацию опухолевого процесса у женщин с наличием карциноматозного плеврита, впервые обратившихся за медицинской помощью. Высокая дифференцировка клеток аденокарциномы яичников (47,8% наблюдений) не исключает плохой прогноз течения заболевания.
Исследовалось развитие карциноматозного плеврита как одного из самых часто встречаемых осложнений при раке яичников. Также с использованием цитологического метода диагностики определялись маркеры для дифференциации рака яичника и метастатичекого поражения в яичник при других видах рака.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.