Автономная нейропатия
VI Национальный конгресс терапевтов: Стеатоз печени, анемия и сахарный диабет в практике врача-терапевта. Что общего?
- Аннотация
- Статья
- Ссылки



Диабет – глобальная неинфекционная эпидемия XXI века. Об этом свидетельствует статистика распространенности данного заболевания в мире. Профессор Т.Ю. ДЕМИДОВА (д.м.н., кафедра эндокринологии и диабетологии РМАПО, Москва) в начале своего выступления привела данные, отражающие масштабы и динамику роста заболеваемости сахарным диабетом (СД). «Число пациентов с сахарным диабетом 2 типа в мире в 2007 г. составляло 246 млн, а к 2030 г. достигнет 500 млн, – сообщила профессор Т.Ю. Демидова. – Это заболевание занимает 4-е место в мире по частоте смертности. В развивающихся странах сахарный диабет 2 типа является наиболее частой причиной слепоты и ампутации конечностей и повышает риск развития сердечно-сосудистых заболеваний в 2–4 раза».
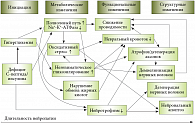
Ключевым патогенетическим фактором поражения органов-мишеней при СД является гипергликемия, которая запускает каскад метаболических нарушений, ведущих к развитию тяжелых осложнений: ретинопатии, глаукомы, катаракты, нефропатии, сердечно-сосудистой патологии, диабетической нейропатии. Патогенез диабетической нейропатии – многофакторный процесс. В основе его лежит хроническая гипергликемия, которая приводит к накоплению глюкозы и продуктов ее обмена внутри клетки, повреждению нейронов и эндоневральных кровеносных сосудов и в конечном итоге – к дегенерации и демиелинизации нервных волокон (рис. 1).
Механизмы повреждения нервных волокон при СД хорошо изучены – это активация полиолового пути обмена глюкозы с накоплением сорбитола, снижение содержания миоинозитола, неферментативное гликирование белков и окислительный стресс. Сорбитол и фруктоза, накапливаясь в структурах периферических и вегетативных нервов, вызывают их дегенерацию, сегментарную демиелинизацию или аксонопатию. Миоинозитол – субстрат для синтеза мембранного фосфатидилинозитола – эндогенного регулятора почечной микросомальной Na+-K+-АТФ-азы. Снижение содержания миоинозитола и активности Na+-K+-АТФ-азы приводит к задержке жидкости, отеку миелиновой оболочки, уменьшению количества глиальных клеток и дегенерации периферических нервов.
Неферментативное гликирование белков нейронов способствует аксональной дистрофии, структурному повреждению нервов, нарушению аксонального транспорта. В результате снижается скорость проведения возбуждения по нерву. Гипергликемия и недостаточность инсулина приводят к развитию окислительного стресса, который сопровождается образованием большого количества свободных радикалов, и нарушению функции клеточных мембран нейронов. Повышение проницаемости митохондриальной мембраны увеличивает количество свободных радикалов кислорода, что ведет к уменьшению синтеза АТФ и нарушениям ДНК, а в итоге – к апоптозу и некрозу клеток.
Наиболее частое осложнение СД – диабетическая автономная нейропатия (ДАН), распространенность которой при СД 2 типа составляет 25–40%. Риск развития ДАН зависит от длительности СД, возраста больного, степени выраженности и длительности гипергликемии. Дополнительными факторами являются малоподвижный образ жизни, атеросклероз, изменение реологических свойств крови, нарушения липидного обмена, длительные статические нагрузки, курение, злоупотребление алкоголем. Автономная нервная система (АНС) – одна из ведущих систем, обеспечивающих регуляцию витальных функций и поддержание гомеостаза. Поражение АНС проявляется вариабельной клинической картиной, которая определяется преимущественным повреждением тех или иных отделов АНС.
Наиболее распространенной формой ДАН является кардиальная автономная нейропатия (КАН), к клиническим проявлениям которой относят тахикардию покоя, фиксированный ригидный сердечный ритм (синдром денервации сердца), аритмию, ортостатическую гипотензию, безболевую ишемию и инфаркт миокарда, артериальную гипертензию, сосудистую гиперчувствительность к катехоламинам, снижение толерантности к физической нагрузке, изменения ЭКГ (увеличение интервала QT), кардиореспираторную остановку сердца, дисфункцию левого желудочка, отечный синдром, внезапную смерть. Развитие КАН резко ухудшает прогноз заболевания и повышает риск смерти.
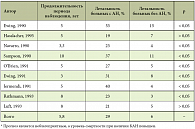
Влияние КАН на прогноз (средние данные по совокупности 9 исследований): за период наблюдения продолжительностью 5,8 лет летальность больных с КАН составила 29%, без КАН – 6% (табл. 1). Таким образом, уровень смертности больных СД при наличии КАН повышен почти в 5 раз. У больных с субклинической стадией КАН прогноз более благоприятный: смертность в этой группе за 10 лет составляет 9,3–10,5%. По данным профессора А.М. Вейна (2000), пациенты, страдающие ДАН, погибают в течение 5–7 лет, причем половина из них умирает в первые 2,5 года1.
Неблагоприятный прогноз ДАН становится особенно актуальным в случаях «молчащей» ишемии и безболевого инфаркта миокарда. В исследовании Valensi и соавт. (2001), продолжавшемся 4,5 года, зарегистрировано развитие серьезных кардиоваскулярных осложнений у 50% больных с ДАН, протекающей с бессимптомной ишемией. «Говоря об автономной нейропатии, хотелось бы обратить внимание на современные классификации данной патологии. Мы можем констатировать метаболические, васкулярные, нейроваскулярные, гастроэндокринные, мочеполовые проявления автономной нейропатии. Однако наибольшую опасность представляет кардиальная форма ДАН», – отметила профессор Т.Ю. Демидова. Ранняя диагностика КАН необходима не только в связи с тяжелым прогнозом, но и потому, что лечение более эффективно на ранней стадии, когда еще не произошли необратимые изменения нервных волокон. Диагностика КАН относительно проста и основана на использовании 4 проб:
- проба с глубоким дыханием (соотношение наибольшего интервала RR на выдохе к наименьшему на вдохе);
- проба 30:15 – отношение 30-го и 15-го интервалов RR после вставания;
- проба Вальсальвы – отношение наибольшего интервала RR после пробы к наименьшему во время пробы;
- измерение ортостатической гипотензии – определение разницы систолического артериального давления до и после вставания, диастолического артериального давления – до и после изометрического сокращения.
Снижение вариабельности частоты сердечных сокращений (ЧСС) – наиболее ранний маркер КАН. Другие признаки, позволяющие диагностировать КАН неинвазивными методами, – изменение артериального давления (АД) при вставании, удлинение интервала QT, фиксируемое при ЭКГ, вариабельность интервала RR при глубоком дыхании, изменения при пробе Вальсальвы. Скрининг на автономную нейропатию следует начинать через 5 лет после установления диагноза СД 1 типа или на момент установления диагноза СД 2 типа. Нужно расспрашивать пациентов о симптомах, проводить необходимые исследования. Если по результатам проб КАН не выявлена, пробы все равно следует повторять ежегодно. Если результаты проб положительные, требуется лечение. «На сегодняшний день вопрос жесткого гликемического контроля является чрезвычайно актуальным. У всех больных необходимо поддерживать нормальный уровень гликемии», – подчеркнула профессор Т.Ю. Демидова.
С позиций доказательной медицины единственным действенным медикаментозным средством против КАН является альфа-липоевая (тиоктовая) кислота. Препарат принимают по 800 мг/сут на протяжении 4 месяцев. По словам профессора Т.Ю. Демидовой, альфа-липоевая кислота оказывает как патогенетическое, так и симтоматическое действие. Результаты исследования ALADIN (1995) подтвердили высокую клиническую безопасность альфа-липоевой кислоты, была определена эффективная дозировка – 600 мг/сут. Отмечено, что кратковременная терапия альфа-липоевой кислотой внутривенно в дозе 600 мг/сут способствует клиническому регрессу основных проявлений диабетической нейропатии2. В более позднем исследовании DEKAN (1997) доказана эффективность альфа-липоевой кислоты в терапии и профилактике КАН. Рекомендована ежедневная доза 800 мг в течение 4 месяцев3. Установлено положительное влияние тиоктовой кислоты на вариабельность сердечного ритма. Под влиянием Тиогаммы в 2,5 раза уменьшился показатель снижения систолического АД при ортопробе. Основные механизмы действия альфа-липоевой кислоты:
- Влияние на энергетический метаболизм, обмен глюкозы и липидов, участие в окислительном декарбоксилировании альфа-кетокислот с активацией цикла Кребса; усиление захвата и утилизация глюкозы клеткой; увеличение потребления кислорода; повышение основного обмена; нормализация глюконеогенеза и кетогенеза; торможение образования холестерина.
- Цитопротективное действие: повышение антиоксидантной активности (прямое и опосредованное через системы витаминов C, E и глютатионовую); стабилизация митохондриальных мембран.
- Гепатопротективное действие: накопление гликогена в печени; повышение активности ряда ферментов; оптимизация функции печени.
- Дезинтоксикационное действие (при отравлениях фосфорорганическими соединениями, свинцом, мышьяком, ртутью, сулемой, цианидами, фенотиазидами и др.).
Наиболее эффективным признано курсовое лечение препаратом Тиогамма, при котором пациенты после внутривенного введения препарата (600 мг/сут в течение 2–3 недель) переводятся на его пероральный прием в течение 2–3 месяцев (также по 600 мг/сут). Как отметил в своем выступлении к.м.н. И.Ю. ГАДАЕВ (доцент кафедры госпитальной терапии № 1 Первого МГМУ им. И.М. Сеченова, Москва), состояния, связанные с дефицитом железа, относятся к числу серьезных нарушений, определяющих здоровье и качество жизни человека. Анемия является достаточно распространенным явлением. Количество пациентов с анемией в мире приближается к 1 млрд, т.е. у каждого 7-го жителя планеты отмечается это состояние. Анемия – патологическое состояние, характеризующееся снижением уровня гемоглобина и (или) числа эритроцитов в единице объема крови.
Железодефицитные состояния при гастроэнтерологических заболеваниях в практике терапевта
Железодефицитные анемии (ЖДА) – заболевания, при которых снижается содержание железа в сыворотке крови, костном мозге и тканевом депо, в результате чего нарушается образование гемоглобина, а в дальнейшем и эритроцитов. ЖДА становятся причиной прогрессирующей гипохромной анемии и нарушения трофики тканей. ЖДА является частым осложнением болезней кишечника. Распространенность ЖДА при некоторых гастроэнтерологических заболеваниях варьирует от 6 до 74%4. Иногда встречаются более редкие причины ЖДА (например, болезнь Маркиафавы). Основные механизмы развития дефицита железа: хронические кровопотери, нарушение всасывания, алиментарный фактор, повышенная потребность в железе, дефект транспортных систем железа, хронический гемодиализ. Причиной устойчивости к терапии железом могут быть мутации гена, отвечающего за синтез белка гепсидина. Гепсидин – одновременно и медиатор воспаления, и белок-регулятор всасывания железа (тормозит всасывание).
Прежде чем приступить к лечению ЖДА, необходимо установить причину заболевания. Для этого проводят исследование всех отделов желудочно-кишечного тракта, а у женщин – также гинекологическое обследование. «Подход к диагностике железодефицитной анемии подразумевает необходимость определения максимального количества всех показателей обмена железа», – отметил к.м.н. И.Ю. Гадаев. Следует учитывать, что возместить дефицит железа только с помощью диетотерапии невозможно. Лечение ЖДА осуществляется преимущественно пероральными препаратами железа. Восполнение железа при пероральном и внутривенном введении практически одинаково, но внутривенное введение всегда сопряжено с определенными рисками. Гемотрансфузии при ЖДА должны проводиться только по жизненным показаниям. Целесообразно продолжение лечения после нормализации клинико-гематологических показателей.
Требования к препарату железа для приема внутрь: эффективность, безопасность и отсутствие побочных эффектов; оптимальная биодоступность; достаточное содержание железа; наличие других компонентов, влияющих на кроветворение. «При серьезном дефиците железа рекомендуется использование препаратов солей железа, достаточно быстро повышающих уровень гемоглобина. Если необходимо решать терапевтическую задачу восполнения депо железа, можно применять комплексные соединения железа, которые обеспечивают более медленный прирост уровня гемоглобина», – отметил к.м.н. И.Ю. Гадаев. Преимуществом комплексного антианемического препарата Ферро-Фольгамма является взаимодополняющее действие активных компонентов – сульфата железа (112,6 мг), фолиевой кислоты (5,0 мг), цианокобаламина (0,010 мг), аскорбиновой кислоты (100 мг).
Из всех солевых препаратов лучше всего всасывается сульфат железа. Аскорбиновая кислота улучшает всасывание железа в кишечнике, предотвращает переход из двухвалентной формы в трехвалентную, ускоряет транспортировку железа и его включение в молекулу гема. Цианокобаламин и фолиевая кислота – дополнительные стимуляторы эритропоэза и гемопоэза – участвуют в образовании и созревании эритроцитов. Комплексное действие активных компонентов препарата обеспечивает:
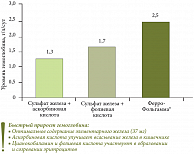
- наибольшую скорость прироста уровня гемоглобина среди всех препаратов сульфата железа (2,5 г/л в сутки);
- хорошую переносимость;
- стабильность достигнутых результатов в течение месяца после завершения курса лечения;
- высокую эффективность5.
По скорости прироста уровня гемоглобина Ферро-Фольгамма превосходит другие препараты сульфата железа в 1,5–2 раза (рис. 2). Хорошая переносимость объясняется содержанием ионов железа только в двухвалентном состоянии. Высокая биодоступность обусловлена наличием капсулы, обеспечивающей всасывание в верхнем отделе тонкой кишки. За счет жировой основы (твердый жир, рапсовое масло) уменьшается раздражающее действие на стенки кишечника. После прекращения приема Ферро-Фольгаммы положительный эффект сохраняется в течение месяца. Мерой эффективности препарата является полная клиническая и гематологическая ремиссия у 92,6% пациентов после 3 недель терапии. «Отсутствие побочных явлений продемонстрировано у 95% пациентов», – подчеркнул к.м.н. И.Ю. Гадаев. Показаниями к применению Ферро-Фольгаммы являются анемии вследствие хронических кровопотерь (желудочных и кишечных кровотечений), хронический алкоголизм, инфекции и воспалительные заболевания желудка и кишечника, анемии при беременности и кормлении грудью у женщин с патологией желудочно-кишечного тракта, анемии со смешанным механизмом развития (ЖДА и анемия при хронических заболеваниях).
Препарат также применяют в профилактических целях для предотвращения дефицита железа и фолиевой кислоты при повышенном их потреблении. К противопоказаниям относятся все аллергические состояния. При легкой форме ЖДА принимают по 1 капсуле Ферро-Фольгаммы 3 раза в день в течение 3–4 недель. При среднетяжелом течении ЖДА рекомендуется более длительный (8–12 недель) курс терапии препаратом в той же дозировке. При тяжелой форме назначают 2 капсулы 3 раза в день на протяжении 16 недель и более. В качестве поддерживающего и профилактического курса рекомендуется прием 1 капсулы Ферро-Фольгаммы 2 раза в неделю. Поскольку в период беременности угроза возникновения ЖДА велика, женщинам для профилактики недостатка железа и фолиевой кислоты рекомендуется принимать по 1 капсуле 3 раза в день во 2-м и 3-м триместрах. Ферро-Фольгамму можно использовать и в послеродовом периоде во время кормления грудью.
Применение тиоктовой кислоты при лечении болезней печени
Профессор А.П. ПОГРОМОВ (д.м.н., кафедра госпитальной терапии № 1 Первого МГМУ им. И.М. Сеченова, Москва) в начале своего доклада указал на сходство механизмов повреждения печени при различных заболеваниях, таких как стеатоз, анемия и др., которые связаны с образованием большого количества свободных радикалов. Основные механизмы повреждения печени:
- повреждение плазматической мембраны и нарушение цитоскелета клетки;
- дисфункция митохондрий;
- нарушение внутриклеточного ионного гомеостаза;
- активация ферментов деградации веществ;
- оксидативный стресс.
Иммунные механизмы гепатотоксичности реализуются с участием иммуногенных комплексов, цитотоксических лимфоцитов, цитокинов (ИФН-γ, ФНО-α, ИЛ-1, ИЛ-6), системы комлемента. Как следствие, наступает некроз либо апоптоз гепатоцитов. Лечение заболеваний печени включает этиотропную и патогенетическую терапию. Однако, как отметил профессор А.П. Погромов, этиотропный подход пока разработан лишь для немногих заболеваний печени, таких как вирусный гепатит B и C. В большинстве случаев лечение является патогенетическим, а иногда даже симптоматическим. Для лечения заболеваний печени используются следующие группы лекарственных препаратов:
- Средства, влияющие на процессы тканевого обмена (витамины, аминокислоты и гидролизаты белков, пептиды, стероидные и нестероидные анаболики, адаптогены).
- Средства, повышающие дезинтоксикационную функцию печени и других органов (адсорбенты, антидоты).
- Желчегонные средства.
- Противовирусные и антимикробные средства.
- Иммуномодуляторы.
- Противовоспалительные препараты (стероидные и нестероидные).
- Ингибиторы и индукторы микросомальных систем, осуществляющих метаболизм ксенобиотиков.
- Гепатопротекторы.
- Антиоксиданты.
Эти группы препаратов, по мнению профессора А.П. Погромова, используются в практике врачей в разной степени. Так, иммуномодуляторы фактически почти не применяются. Основные требования к идеальному гепатопротектору (по R. Preisig)6:
- высокая степень абсорбции;
- наличие эффекта «первого прохождения» через печень;
- выраженная способность связывать или предупреждать образование высокоактивных повреждающих соединений;
- возможность уменьшать чрезмерно выраженное воспаление;
- подавление фиброгенеза;
- стимуляция регенерации печени;
- естественный метаболизм при патологии печени;
- экстенсивная энтерогепатическая циркуляция.
Как подчеркнул профессор А.П. Погромов, ни один из современных гепатопротекторов не обладает всеми перечисленными свойствами. Среди современных гепатопротекторов средства растительного происхождения (на основе расторопши, клюквы, одуванчика и др.) составляют до 54%, фосфолипидные препараты – 16%, синтетические препараты, органопрепараты и препараты аминокислот – 30%. Всего насчитывается более 1000 лекарств. Согласно выводам профессора А.П. Погромова, большое количество препаратов доказывает, что «мы еще далеки от того, чтобы найти и создать ту группу препаратов, которая действительно обладала бы мощным воздействием».
Наибольшую эффективность в клинических условиях продемонстрировала альфа-липоевая кислота (выделена японскими учеными из говяжьей печени в 1950 г., в 1953 г. получен синтетический аналог альфа-липоевой кислоты). Терапию альфа-липоевой кислотой при алкогольной интоксикации впервые в 1960-х гг. описали немецкие клиницисты. Они показали, что альфа-липоевая кислота – эффективный препарат при лечении печеночной комы и гепатита. Общие свойства препарата Тиогамма: нейротропное и нейропротективное действие; гиполипидемическое действие; гипогликемическое действие; влияние на энергетический обмен; влияние на обмен глюкозы и липидов; антиоксидантный эффект; гепатопротективное действие; детоксикационное действие. Тиогамма применяется при гиперхолестеринемии, гиперлипидемии, алкогольном поражении печени, циррозе печени, ПБЦ, отравлении грибами.
Существует несколько причин развития стеатоза печени: алкоголизм, побочное действие лекарственных препаратов, сахарный диабет (основная причина неалкогольной жировой болезни печени (НАЖБП)) и др. НАЖБП встречается у людей различных возрастных групп, но чаще в возрастных группах 40–49 и 50–59 лет. Выявляется НАЖБП, как правило, при скрининговом обследовании. Как показали клинические исследования, Тиогамма эффективна как при неалкогольной, так и при алкогольной жировой дистрофии печени. При НАЖБП через 3 недели лечения Тиогаммой наблюдалась нормализация уровня аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ), показателей содержания глюкозы и холестерина. При лечении алкогольной жировой дистрофии печени 3-недельная терапия альфа-липоевой кислотой приводила к нормализации уровня АЛТ, АСТ и глюкозы.
В настоящее время количество наименований лекарственных препаратов, токсичных для печени, превысило 2 тысячи. Поражение печени в результате побочного действия различных лекарств становится все более распространенным явлением. В этих случаях также рекомендовано применение Тиогаммы. В заключение докладчик отметил, что введение Тиогаммы внутривенно-капельно в суточной дозе 600 мг в течение 3 недель является эффективным методом лечения неалкогольной жировой дистрофии печени. Форма выпуска препарата – готовые флаконы для инфузий, которые не требуют предварительного разведения, – позволяет осуществлять этот метод введения. Профессор А.П. Погромов подчеркнул, что эта форма выпуска является уникальной и есть только у препарата Тиогамма. Затем А.П. Погромов рекомендует проведение перорального приема Тиогамма 600 мг (1 таблетка) утром, натощак, в течение 2 месяцев. При невозможности проведения процедур, например, не в условиях стационара, предложена схема терапии таблетированной формой Тиогаммы в течение 3 месяцев. При алкогольном стеатогепатите и лекарственных поражениях печени положительный эффект Тиогаммы проявляется в более короткие временные сроки. Осложнений от проводимого лечения не наблюдалось.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.