Субфовеолярная толщина хориоидеи как маркер преэклампсии у беременных с сахарным диабетом 1-го типа
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Ретроспективно проанализированы данные 32 беременных (64 глаза) с СД 1-го типа и 10 небеременных (20 глаз) контрольной группы. Пациентки с СД 1-го типа были поровну разделены на две группы – с развившейся преэклампсией и без преэклампсии. В первую группу вошли две пациентки без признаков диабетической ретинопатии (ДР), три пациентки с непролиферативной ДР (НДР) и 11 пациенток с пролиферативной (ПДР). У четырех пациенток первой группы с ПДР диагностирован диффузно-кистозный отек, потребовавший введения препарата Озурдекс. Вторую группу составили три пациентки без признаков ДР, пять пациенток с НДР, восемь – с ПДР. Всем пациенткам проведена оптическая когерентная томография с измерением СФТХ в динамике на протяжении беременности.
Результаты. Средние значения СФТХ в контрольной группе составили 410 ± 92 мкм, что значительно ниже, чем у беременных с СД, особенно на фоне ДР и преэклампсии. У пациенток второй группы наблюдалось увеличение СФТХ ко второму триместру с последующим снижением в третьем триместре. У пациенток, которым выполнялась ПРЛКС, отмечалось значимое снижение СФТХ через 8–12 недель после процедуры. В первой группе зафиксировано прогрессивное увеличение СФТХ на протяжении всей беременности без характерного снижения в третьем триместре. Важно, что у пациенток с преэклампсией ПРЛКС не приводила к ожидаемому снижению СФТХ, которое наблюдалось у пациенток без преэклампсии.
Выводы. Полученные результаты свидетельствуют о том, что отсутствие снижения СФТХ в третьем триместре беременности и после ПРЛКС у пациенток с ПДР может служить дополнительным офтальмологическим маркером развития преэклампсии. Включение в исследование контрольной группы позволило установить базовые значения СФТХ и оценить степень отклонения этого показателя у беременных с различными патологиями.
Материал и методы. Ретроспективно проанализированы данные 32 беременных (64 глаза) с СД 1-го типа и 10 небеременных (20 глаз) контрольной группы. Пациентки с СД 1-го типа были поровну разделены на две группы – с развившейся преэклампсией и без преэклампсии. В первую группу вошли две пациентки без признаков диабетической ретинопатии (ДР), три пациентки с непролиферативной ДР (НДР) и 11 пациенток с пролиферативной (ПДР). У четырех пациенток первой группы с ПДР диагностирован диффузно-кистозный отек, потребовавший введения препарата Озурдекс. Вторую группу составили три пациентки без признаков ДР, пять пациенток с НДР, восемь – с ПДР. Всем пациенткам проведена оптическая когерентная томография с измерением СФТХ в динамике на протяжении беременности.
Результаты. Средние значения СФТХ в контрольной группе составили 410 ± 92 мкм, что значительно ниже, чем у беременных с СД, особенно на фоне ДР и преэклампсии. У пациенток второй группы наблюдалось увеличение СФТХ ко второму триместру с последующим снижением в третьем триместре. У пациенток, которым выполнялась ПРЛКС, отмечалось значимое снижение СФТХ через 8–12 недель после процедуры. В первой группе зафиксировано прогрессивное увеличение СФТХ на протяжении всей беременности без характерного снижения в третьем триместре. Важно, что у пациенток с преэклампсией ПРЛКС не приводила к ожидаемому снижению СФТХ, которое наблюдалось у пациенток без преэклампсии.
Выводы. Полученные результаты свидетельствуют о том, что отсутствие снижения СФТХ в третьем триместре беременности и после ПРЛКС у пациенток с ПДР может служить дополнительным офтальмологическим маркером развития преэклампсии. Включение в исследование контрольной группы позволило установить базовые значения СФТХ и оценить степень отклонения этого показателя у беременных с различными патологиями.
Введение
Преэклампсия (ПЭ) – системное осложнение беременности, характеризующееся повышением артериального давления и протеинурией после 20-й недели гестации. У пациенток с сахарным диабетом (СД) риск развития ПЭ значительно повышен, что ассоциировано с увеличением материнской и перинатальной заболеваемости и смертности [1, 2]. Для снижения этих показателей крайне важна своевременная диагностика ПЭ. В последние годы все больше внимания уделяется поиску ранних предикторов развития ПЭ, включая офтальмологические маркеры.
Хориоидея представляет собой высоковаскуляризированную ткань, изменения которой могут отражать системные сосудистые нарушения. Измерение субфовеолярной толщины хориоидеи (СФТХ) с помощью оптической когерентной томографии стало ценным инструментом для мониторинга микрососудистых изменений при различных заболеваниях [3, 4]. В ряде исследований продемонстрированы изменения толщины хориоидеи на фоне нормальной беременности. Так, исследование Z. Dadaci и соавт. показало, что толщина хориоидеи в третьем триместре значительно уменьшается по сравнению с первым триместром во всех измеренных точках. По данным S. Goktas и соавт., наибольшая толщина хориоидеи наблюдается во втором триместре, что связано со снижением артериального давления и сосудистого сопротивления в этом периоде [5, 6].
Вместе с тем характер изменений толщины хориоидеи у беременных с СД, особенно на фоне ПЭ, недостаточно изучен. Представляет интерес и влияние панретинальной лазеркоагуляции сетчатки (ПРЛКС), которая часто проводится беременным с пролиферативной диабетической ретинопатией (ПДР), на толщину хориоидеи. Предыдущие исследования показали, что ПРЛКС способствует значимому снижению СФТХ через 8–12 недель после процедуры [7, 8].
Цель – изучить динамику изменения СФТХ у беременных с СД 1-го типа в зависимости от наличия ПЭ и проведения ПРЛКС в сравнении с небеременными контрольной группы.
Материал и методы
Дизайн исследования
Ретроспективное исследование проводилось на базе офтальмологического отделения ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» в период с 2022 по 2025 г. В него было включено 32 беременных (64 глаза) с СД 1-го типа, а также 10 небеременных (20 глаз) контрольной группы. Пациентки с осевой миопией (длина глаза > 24 мм) не включались в исследование, поскольку у данной категории пациенток возможно истончение хориоидеи, что может исказить статистические данные и привести к неверному представлению о динамике толщины хориоидеи у беременных с СД 1-го типа. Пациенток с СД разделили на две равные группы – с развившейся ПЭ и без ПЭ. В первую группу вошли две пациентки без признаков диабетической ретинопатии (ДР), три пациентки с непролиферативной ДР (НДР), 11 – с ПДР. У четырех пациенток с ПДР был диагностирован диффузно-кистозный диабетический макулярный отек (ДМО), который потребовал интравитреального введения препарата Озурдекс. Вторую группу представляли три пациентки без признаков ДР, пять пациенток с НДР, восемь – с ПДР. Контрольная группа состояла из десяти небеременных сопоставимого возраста (1994–2002 годы рождения) без СД и офтальмологической патологии.
Методы обследования
Всем пациенткам выполнялось комплексное офтальмологическое обследование, включавшее стандартные методы (визометрия по таблицам С.С. Головина и Д.А. Сивцева, тонометрия, биомикроскопия, офтальмоскопия в условиях медикаментозного мидриаза с использованием высокодиоптрийной линзы 78–90 дптр), а также измерение переднезадней оси глаза и специальную диагностику – оптическую когерентную томографию с измерением СФТХ. Измерения СФТХ у беременных проводились в первом (до 12 недель), втором (13–27 недель) и третьем (28–40 недель) триместрах. У пациенток, которым выполнялась ПРЛКС, дополнительные измерения проводили через 4–6 и 8–12 недель после процедуры. В контрольной группе СФТХ измеряли однократно. Кроме того, всем пациенткам на каждом визите измеряли уровень артериального давления. Диагноз ПЭ, который устанавливал акушер-гинеколог во время родоразрешения, был подтвержден выписным эпикризом из родильного дома.
Статистический анализ
Статистический анализ проводился с использованием программы SPSS Statistics v. 25.0. Количественные данные представлены в виде среднего значения ± стандартное отклонение. Для сравнения групп использовались t-критерий Стьюдента и дисперсионный анализ ANOVA с поправкой Бонферрони для множественных сравнений. Корреляции между переменными оценивали на основании коэффициента корреляции Пирсона. Значение p < 0,05 считалось статистически значимым.
Результаты
Демографические и клинические характеристики
Средний возраст пациенток первой группы составил 32,4 ± 5,6 года, второй – 31,8 ± 6,2 года, контрольной – 24,5 ± 3,1 года. Различия в возрасте между группами не были статистически значимы (p > 0,05), хотя пациентки контрольной группы были несколько моложе (p < 0,05).
В контрольной группе средняя СФТХ составила 410 ± 92 мкм, диапазон от 289 до 581 мкм.
Динамика СФТХ у пациенток без преэклампсии (группа 2)
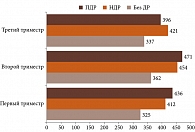
У пациенток без ПЭ наблюдалась следующая динамика СФТХ (рис. 1):
- пациентки без ДР: первый триместр – 325 ± 58 мкм, второй триместр – 362 ± 63 мкм, третий триместр – 337 ± 59 мкм;
- пациентки с НДР: первый триместр – 412 ± 66 мкм, второй триместр – 454 ± 72 мкм, третий триместр – 421 ± 68 мкм;
- пациентки с ПДР до ПРЛКС: первый триместр – 436 ± 74 мкм, второй триместр – 471 ± 79 мкм;
- пациентки с ПДР после ПРЛКС (8–12 недель): снижение СФТХ достигло 396 ± 65 мкм (p < 0,01 по сравнению с показателями до ПРЛКС).
Таким образом, у пациенток без ПЭ наблюдалось увеличение СФТХ ко второму триместру с последующим снижением в третьем триместре. У пациенток с ПДР после ПРЛКС отмечалось статистически значимое снижение СФТХ через 8–12 недель после процедуры.
Сравнение с контрольной группой показало, что СФТХ у беременных без ДР была сопоставима с показателями контрольной группы (p > 0,05), тогда как у пациенток с НДР и ПДР СФТХ была статистически значимо выше (p < 0,05).
Динамика СФТХ у пациенток с преэклампсией (группа 1)
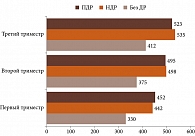
У пациенток с ПЭ наблюдалась иная динамика СФТХ (рис. 2):
- пациентки без ДР: первый триместр – 330 ± 61 мкм, второй триместр – 375 ± 68 мкм, третий триместр – 412 ± 72 мкм;
- пациентки с НДР: первый триместр – 442 ± 75 мкм, второй триместр – 498 ± 82 мкм, третий триместр – 535 ± 88 мкм;
- пациентки с ПДР до ПРЛКС: первый триместр – 452 ± 78 мкм, второй триместр – 495 ± 83 мкм;
- пациентки с ПДР после ПРЛКС (8–12 недель): увеличение СФТХ до 523 ± 89 мкм (p < 0,05 по сравнению с показателями до ПРЛКС).
В отличие от пациенток без ПЭ у пациенток с ПЭ наблюдалось прогрессивное увеличение СФТХ на протяжении всей беременности. Крайне важно, что у пациенток с ПДР и ПЭ ПРЛКС не приводила к ожидаемому снижению СФТХ, а, напротив, сопровождалась дальнейшим увеличением этого показателя.
Сравнение с контрольной группой выявило статистически значимые различия СФТХ во всех подгруппах пациенток с ПЭ (p < 0,01). При этом наиболее выраженные различия зафиксированы у пациенток с НДР и ПДР.
Пациентки с ДМО, получавшие Озурдекс
У четырех пациенток первой группы с ПДР и ДМО, которым проводилось интравитреальное введение Озурдекса, наблюдалась следующая динамика СФТХ: до введения Озурдекса – 502 ± 85 мкм, через четыре недели после введения – 480 ± 82 мкм (временное снижение), к концу беременности – 515 ± 88 мкм (возобновление тенденции к увеличению).
Таким образом, интравитреальное введение Озурдекса приводило лишь к временному снижению СФТХ, после чего показатель демонстрировал тенденцию к увеличению.
Корреляционный анализ
Анализ корреляций между различными параметрами выявил:
- у беременных без ПЭ – положительную корреляцию между СФТХ и сроком беременности во втором триместре (r = 0,62; p < 0,01) и отрицательную – в третьем триместре (r = -0,45; p < 0,05);
- у беременных с ПЭ – сильную положительную корреляцию между СФТХ и сроком беременности во всех триместрах (r = 0,75; p < 0,001) и положительную корреляцию между СФТХ и уровнем артериального давления (r = 0,68; p < 0,01).
Обсуждение
Результаты нашего исследования демонстрируют четкие различия в динамике изменения СФТХ у беременных с СД 1-го типа в зависимости от наличия ПЭ и проведения ПРЛКС и в сравнении с показателями небеременных контрольной группы.
Сравнение с контрольной группой
Анализ данных контрольной группы показал, что у небеременных без офтальмологической патологии средняя СФТХ составила 410 ± 92 мкм, что согласуется с данными литературы.
Включение контрольной группы позволило установить базовые значения СФТХ и оценить степень отклонения этого показателя у беременных с различными патологиями. Так, у беременных без ДР и без ПЭ значения СФТХ были сопоставимы с показателями контрольной группы, что может указывать на отсутствие значимого влияния физиологической беременности на толщину хориоидеи в первом триместре.
Физиологические изменения СФТХ при беременности
У пациенток без ПЭ наблюдалась физиологическая динамика изменения СФТХ: увеличение во втором триместре с последующим снижением в третьем триместре. Эти данные соответствуют результатам исследований Z. Dadaci и соавт. и S. Goktas и соавт. [5, 6], которые наблюдали аналогичную динамику у здоровых беременных. Увеличение СФТХ во втором триместре может быть связано со снижением артериального давления и сосудистого сопротивления в этом периоде, а снижение в третьем триместре – с физиологическим повышением артериального давления и сосудистого сопротивления.
Влияние ПРЛКС на СФТХ
У пациенток с ПДР без ПЭ ПРЛКС приводила к статистически значимому снижению СФТХ через 8–12 недель после процедуры. Это может быть обусловлено уменьшением ишемии сетчатки и снижением продукции вазопролиферативных факторов, в частности фактора роста эндотелия сосудов (VEGF), который способствует увеличению проницаемости сосудов и влияет на толщину хориоидеи.
Полученные данные соотносятся с результатами других исследований, которые показали, что лазерная коагуляция сетчатки способствует снижению уровня VEGF и других проангиогенных факторов, что в свою очередь может влиять на сосудистую проницаемость и толщину хориоидеи [9, 10].
Особенности изменения СФТХ при преэклампсии
У пациенток с ПЭ наблюдалось прогрессивное увеличение СФТХ на протяжении всей беременности, без характерного снижения в третьем триместре. Наши наблюдения согласуются с результатами J.W. Kim и соавт. [11], которые отметили значительное увеличение толщины хориоидеи у пациенток с ПЭ по сравнению с нормотензивными беременными. Однако наше исследование впервые продемонстрировало взаимосвязь между ПЭ и реакцией хориоидеи на ПРЛКС у пациенток с СД. Более того, выполнение ПРЛКС этим пациенткам не приводило к ожидаемому снижению СФТХ, а, напротив, сопровождалось дальнейшим увеличением показателя.
Такие различия могут быть обусловлены патофизиологическими механизмами ПЭ, включающими генерализованную эндотелиальную дисфункцию, вазоспазм и нарушение плацентарной перфузии. ПЭ сопровождается повышением уровня циркулирующих антиангиогенных факторов, таких как растворимая fms-подобная тирозинкиназа 1, которая связывает VEGF и плацентарный фактор роста (PlGF), нарушая их взаимодействие с эндотелиальными рецепторами [12]. Это приводит к эндотелиальной дисфункции и может влиять на сосуды хориоидеи, способствуя увеличению ее толщины. Повышение уровня АД, характерное для ПЭ, также может способствовать увеличению СФТХ через механизмы, связанные с нарушением ауторегуляции хориоидального кровотока и повышением гидростатического давления в хориокапиллярах [13].
Отсутствие ожидаемого снижения СФТХ после ПРЛКС у пациенток с ПЭ может быть обусловлено тем, что системные факторы, ассоциированные с ПЭ, преобладают над локальными эффектами лазерной коагуляции сетчатки. Эти наблюдения указывают на то, что динамика изменения СФТХ может служить дополнительным офтальмологическим маркером развития ПЭ у беременных с СД.
Влияние интравитреального введения Озурдекса
У пациенток с ДМО, получавших интравитреальные инъекции Озурдекса, наблюдалось лишь временное снижение СФТХ, после чего продолжалось увеличение данного показателя. Это может быть связано с тем, что противовоспалительный и антиангиогенный эффекты дексаметазона являются локальными и временными, в то время как системные факторы, ассоциированные с ПЭ, продолжают влиять на сосуды хориоидеи.
Корреляции между СФТХ и другими параметрами
Проведенный корреляционный анализ выявил взаимосвязи между СФТХ и другими параметрами. Особенно важной представляется положительная корреляция между СФТХ и уровнем артериального давления у пациенток с ПЭ, что может отражать взаимосвязь между системной гемодинамикой и состоянием хориоидальных сосудов.
Заключение
Результаты настоящего исследования свидетельствуют о том, что у беременных с СД 1-го типа без ПЭ наблюдается увеличение СФТХ ко второму триместру с последующим снижением в третьем триместре, а ПРЛКС приводит к значимому снижению СФТХ через 8–12 недель после процедуры. У пациенток с ПЭ, напротив, наблюдается прогрессивное увеличение СФТХ на протяжении всей беременности, без характерного снижения в третьем триместре и после ПРЛКС.
Сравнение с данными небеременных контрольной группы позволило установить базовые значения СФТХ и выявить, что у беременных с СД 1-го типа и ПЭ этот показатель значительно выше нормальных значений, особенно в третьем триместре, а также на фоне ДР.
Отсутствие снижения СФТХ в третьем триместре беременности и после ПРЛКС у пациенток с ДР может служить дополнительным офтальмологическим маркером развития ПЭ и требует более тщательного наблюдения за такими пациентками.
Полученные результаты расширяют понимание патофизиологических механизмов ПЭ и могут способствовать разработке новых подходов к ранней диагностике этого опасного осложнения беременности у женщин с СД 1-го типа.
Финансирование. Авторы не получали конкретного гранта на это исследование от какого-либо финансирующего агентства в государственном, коммерческом и некоммерческом секторах.
A.A. Afanasyeva, I.A. Loskutov, PhD
M.F. Vladimirsky Moscow Regional Scientific Research Clinical Institute
Contact person: Anna A. Afanasyeva, anna_amor@mail.ru
The aim is to evaluate the dynamics of subfoveal choroidal thickness (SFCT) changes in pregnant patients with type 1 diabetes mellitus depending on the presence of preeclampsia and panretinal photocoagulation compared to a control group.
Material and methods. Data from 32 pregnant patients (64 eyes) with type 1 diabetes mellitus and 10 non-pregnant women (20 eyes) in the control group were retrospectively analyzed. Diabetic patients were divided into two groups: those with who developed preeclampsia (group 1, n = 16) and those without preeclampsia (group 2, n = 16). Group 1 included 2 patients without signs of diabetic retinopathy, 3 patients with non-proliferative diabetic retinopathy, and 11 patients with proliferative diabetic retinopathy. Four patients in group 1 with proliferative diabetic retinopathy were diagnosed with diffuse cystoid macular edema requiring Ozurdex injection. Group 2 included 3 patients without signs of diabetic retinopathy, 5 patients with non-proliferative diabetic retinopathy, and 8 patients with proliferative diabetic retinopathy. All patients underwent optical coherence tomography with SFCT measurement dynamically throughout pregnancy.
Results. Mean SFCT values in the control group were 410 ± 92 μm, which was significantly lower than in pregnant women with diabetes mellitus, especially in the presence of diabetic retinopathy and preeclampsia. Patients in group 2 showed an increase in SFCT by the second trimester followed by a decrease in the third trimester. Patients who underwent panretinal photocoagulation showed significant SFCT reduction 8–12 weeks after the procedure. Group 1 patients demonstrated progressive SFCT increase throughout pregnancy without the characteristic third-trimester decrease. Importantly, in patients with preeclampsia, panretinal photocoagulation did not lead to the expected SFCT reduction observed in patients without preeclampsia.
Conclusions. The results indicate that the absence of SFCT reduction in the third trimester of pregnancy and after panretinal photocoagulation in patients with proliferative diabetic retinopathy may serve as an additional ophthalmological marker for preeclampsia development. The inclusion of a control group allowed establishment of baseline SFCT values and assessment of the degree of deviation of this parameter in pregnant women with various pathologies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.