Вирильный синдром у подростков: этиопатогенез и клинико-диагностические особенности
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведен поиск литературы в базах данных PubMed, Embase, Cochrane Library и Google Scholar. В обзор включены систематические обзоры, когортные и рандомизированные контролируемые исследования, серии случаев, опубликованные c 2014 до 2024 г.
Результаты. Анализ литературы показал, что вирильный синдром является полиэтиологическим состоянием, обусловленным как врожденными, так и приобретенными факторами, включая нарушение функции надпочечников, яичников, а также генетические и гормональные дисфункции. Клиническая картина синдрома характеризуется широким спектром проявлений: гирсутизмом, алопецией, изменением тембра голоса, гипертрофией клитора и нарушением менструального цикла. Современные методы диагностики, в том числе гормональные исследования, визуализационные методы (ультразвуковое исследование, магнитно-резонансная томография) и молекулярно-генетические тесты, позволяют точно установить причину вирилизации и разработать персонализированный подход к лечению.
Материал и методы. Проведен поиск литературы в базах данных PubMed, Embase, Cochrane Library и Google Scholar. В обзор включены систематические обзоры, когортные и рандомизированные контролируемые исследования, серии случаев, опубликованные c 2014 до 2024 г.
Результаты. Анализ литературы показал, что вирильный синдром является полиэтиологическим состоянием, обусловленным как врожденными, так и приобретенными факторами, включая нарушение функции надпочечников, яичников, а также генетические и гормональные дисфункции. Клиническая картина синдрома характеризуется широким спектром проявлений: гирсутизмом, алопецией, изменением тембра голоса, гипертрофией клитора и нарушением менструального цикла. Современные методы диагностики, в том числе гормональные исследования, визуализационные методы (ультразвуковое исследование, магнитно-резонансная томография) и молекулярно-генетические тесты, позволяют точно установить причину вирилизации и разработать персонализированный подход к лечению.
Введение
Вирильный синдром представляет собой сложное эндокринное расстройство, характеризующееся появлением мужских вторичных половых признаков у женщин, что обусловлено избыточным воздействием андрогенов на органы-мишени. Такое состояние рассматривается как результат дисбаланса в синтезе, метаболизме или рецепции андрогенов, что приводит к маскулинизации организма. Вирильный синдром может возникать под воздействием различных этиологических факторов, включая поликистоз яичников, адреналовые опухоли, врожденную дисфункцию коры надпочечников (ВДКН), а также ятрогенные причины.
Этиопатогенез вирильного синдрома тесно связан с нарушением работы гипоталамо-гипофизарно-надпочечниковой и гипоталамо-гипофизарно-яичниковой систем. В случае ВДКН дефицит ферментов, таких как 21-гидроксилаза, способствует избыточному синтезу андрогенов в коре надпочечников.
Клинические проявления вирильного синдрома зависят от степени гиперандрогении и возраста пациенток. У женщин наиболее характерными симптомами являются гирсутизм (избыточный рост волос по мужскому типу), алопеция (облысение по мужскому типу), акне, себорея, изменение тембра голоса (барифония), увеличение мышечной массы и клиторомегалия. У подростков вирильный синдром может сопровождаться нарушением менструального цикла, задержкой полового развития или, наоборот, преждевременным половым созреванием.
Диагностика вирильного синдрома требует комплексного подхода, включающего сбор анамнеза, физикальное обследование, лабораторные и инструментальные методы. Лабораторная диагностика направлена на определение уровня андрогенов (тестостерона, дегидроэпиандростерона сульфата, андростендиона) и других гормонов (фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ), пролактина, кортизола). Инструментальные методы, в частности ультразвуковое исследование (УЗИ) органов малого таза, компьютерная или магнитно-резонансная томография (МРТ) надпочечников, позволяют выявить структурные изменения, такие как кисты яичников или опухоли надпочечников.
Цель – систематизировать актуальные данные о вирильном синдроме, его этиологии, патогенезе, клинических проявлениях и методах диагностики.
Этиология
Вирильный синдром характеризуется появлением мужских вторичных половых признаков у женщин и вызывается избыточным воздействием мужских половых гормонов на органы-мишени. Источниками мужских половых гормонов в организме женщины служат надпочечники и яичники. Кроме того, андрогены образуются в результате периферического метаболизма в печени, мышцах, коже и жировой ткани. Основными андрогенами, синтезируемыми надпочечниками, являются дегидроэпиандростерон (ДГЭА) и его сульфат (ДГЭАС). В яичниках вырабатываются тестостерон, андростендион, андростендиол и дигидротестостерон.
В нормальных физиологических условиях андрогены в женском организме выполняют функцию анаболических факторов и служат прекурсорами для синтеза женских половых гормонов. Под влиянием фермента ароматазы андрогены преобразуются в эстрогены. Они способствуют овуляции, участвуют в поддержании либидо, влияют на поведение, формируют когнитивные функции, способствуют росту костей и закрытию зон роста, а также выполняют множество других важных функций. Действие андрогенов осуществляется через внутриклеточные ядерные рецепторы.
Синдром гиперандрогении представляет собой обширную группу эндокринных заболеваний, обусловленных различными патогенетическими механизмами, но объединенных сходной клинической картиной.
Абсолютная гиперандрогения, возникающая на фоне избытка андрогенов, может быть следствием клинических состояний, например синдрома поликистозных яичников (СПКЯ), андрогенпродуцирующих опухолей яичников, адреногенитального синдрома, болезни или синдрома Кушинга, нарушений жирового обмена, сахарного диабета, гиперпролактинемии, гипер- или гипотиреоза, а также ятрогенной гиперандрогении, связанной с приемом ряда лекарственных препаратов [1].
Относительная гиперандрогения, развивающаяся при повышенной чувствительности органов-мишеней на фоне нормального уровня гормонов, может быть вызвана усиленной активностью фермента 5-альфа-редуктазы 1-го типа, повышенной плотностью ядерных дигидротестостерон-рецепторов, а также увеличением свободной фракции тестостерона в крови из-за снижения синтеза транспортных пептидов в печени [1].
Выделяют несколько типов гиперандрогении:
- яичниковый;
- надпочечниковый;
- центральный;
- смешанный;
- периферический.
В частности, яичниковая гиперандрогения обусловлена нарушением гормональной регуляции менструального цикла и углеводного обмена.
Надпочечниковая гиперандрогения возникает вследствие генетического дефицита активности ферментных систем, участвующих в синтезе стероидных гормонов.
Опухоли гипофиза и андрогенпродуцирующие опухоли надпочечников также способны провоцировать центральную форму гиперандрогении. Транспортная гиперандрогения связана с изменением уровня белков-транспортеров половых гормонов. Связывание тестостерона происходит с альбумином и секс-стероидсвязывающим глобулином (СССГ). На уровень СССГ влияют различные факторы, например эстрогены, гормоны щитовидной железы, состояние печени, гиперинсулинемия и прием некоторых прогестинов. Рецепторная гиперандрогения обусловлена повышенной активностью внутриклеточных ферментов.
К наиболее частым заболеваниям, связанным с гиперандрогенией, относят:
СПКЯ. Это основная причина гиперандрогении – до 70% случаев, по данным различных авторов. СПКЯ сопровождается увеличением частоты пульсовых выбросов гонадотропин-рилизинг-гормона, что приводит к повышенной секреции ЛГ и относительной недостаточности ФСГ. В результате увеличивается синтез андрогенов в яичниках, что в свою очередь усугубляется генетическими факторами и инсулинорезистентностью [2, 3];
идиопатический гиперандрогенизм. Данный синдром встречается в 5–17% случаев гирсутизма и характеризуется регулярным менструальным циклом и неизмененными яичниками по данным ультрасонографии, но с повышенным уровнем андрогенов [3]. Выраженность гирсутизма зависит от этнической принадлежности и географической области, о чем свидетельствует оценка по шкале Ферримана – Галлвея [3]. Исследования показывают, что уровень оволосения среди различных этнических групп частично объясняется чувствительностью волосяных фолликулов к ферменту 5-альфа-редуктазе и полиморфизмом андрогеновых рецепторов [4];
идиопатический гирсутизм. Определяется как диагноз исключения и встречается у женщин с нормальным менструальным циклом и морфологией яичников, а также с уровнем андрогенов в крови, не выходящим за пределы нормы [5]. Согласно данным литературы, около 50% женщин имеют идиопатический характер гирсутизма;
ВДКН. На ее долю приходится около 8% всех случаев гиперандрогенных состояний. Заболевание наследуется по аутосомно-рецессивному типу и связано с дефицитом ферментов, участвующих в синтезе стероидных гормонов надпочечников, что приводит к преобразованию предшественников гормонов в андрогены. Гиперплазия надпочечников часто встречается среди таких этнических групп, как евреи-ашкеназы, латиноамериканцы и славяне;
стромальный текоматоз яичников. Характеризуется наличием очагов лютеинизированных тека-клеток в гиперплазированной строме яичников, обусловленных дифференцировкой интерстициальных клеток яичников в активные стероидсинтезирующие лютеинизированные стромальные клетки. Заболевание редко встречается у подростков, но может сочетаться с СПКЯ [1];
вирилизирующие опухоли. В частности, андрогенсекретирующие опухоли яичников или надпочечников редко становятся причиной гирсутизма. Более чем в 50% случаев они оказываются злокачественными [1]. В случае надпочечникового генеза опухоли обычно имеют место гиперкортизолемия и повышение уровней ДГЭА и ДГЭАС, что может привести к синдрому Кушинга.
Более редкие эндокринные нарушения, например гиперпролактинемия, заболевания щитовидной железы, акромегалия и синдром Кушинга, также способны приводить к гиперандрогении. Симптомы гиперандрогении могут наблюдаться при заболеваниях печени, желчевыводящих путей, дефиците витаминов и микроэлементов, порфирии, дерматомиозите, хронических заболеваниях почек и легких. Повышение уровня андрогенов может быть связано с нарушением в развитии центральных и периферических звеньев репродуктивной системы.
Ятрогенная гиперандрогения нередко возникает на фоне применения лекарственных средств с андрогенными свойствами. Речь идет об анаболических стероидах, андрогенах, гестагенах, антигонадотропных препаратах, противотуберкулезных средствах, глюкокортикостероидах, транквилизаторах и седативных веществах, противоэпилептических препаратах, циклоспоринах и интерферонах.
Клиническая картина
Клиническая картина вирильного синдрома включает разнообразные проявления. Наиболее распространенные из них – гирсутизм, акне, ожирение, клиторомегалия, ранний апокринный запах, повышенная жирность волос, нарушения менструального цикла и психоэмоциональные расстройства [1]. Гирсутизм, или чрезмерный рост волос в андрогензависимых зонах, таких как лицо, грудь и спина, наблюдается у 5–10% подростков с гиперандрогенными состояниями, включая СПКЯ и ВДКН [5, 6]. Избыток андрогенов стимулирует рост терминальных волос в областях, которые в норме у женщин содержат лишь мягкие пушковые волосы. Как следствие – выраженные косметические дефекты и значительный психологический дискомфорт, в том числе тревожные и депрессивные состояния. Страх стигматизации (от греч. στíγμα – ярлык, клеймо) и непринятие подростковым окружением также усугубляют психоэмоциональные нарушения. Психические расстройства при гиперандрогении связаны не только с внешними проявлениями, но и с биохимическими изменениями в организме, влияющими на работу нейротрансмиттерных систем мозга. Эти аспекты необходимо учитывать при назначении комплексной терапии вирильного синдрома и предусматривать обязательное психосоциальное сопровождение. Оценка степени гирсутизма обычно проводится по модифицированной шкале Ферримана – Галлвея, учитывающей количество и распределение терминальных волос в девяти андрогензависимых зонах. Следует отметить, что, согласно клиническим рекомендациям «Синдром поликистозных яичников» 2024 г., важно оценивать стадию полового развития по шкале Таннера у подростков с СПКЯ, включая оценку молочных желез (В1–5), лобкового оволосения (Р1–5) и менструального цикла (Ме0–3). Между тем балльная система Ферримана – Галлвея не адаптирована для детей, ее нецелесообразно применять для оценки гирсутизма у подростков на основании рекомендаций обществ по гиперандрогении и СПКЯ [6, 7].
В исследовании S. West и соавт. изучали взаимосвязь между нарушением менструального цикла и/или повышением уровней андрогенов в подростковом возрасте и риском развития СПКЯ и бесплодия в зрелом возрасте у 2448 пациенток [8]. Результаты показали, что нарушения менструального цикла и/или гиперандрогения, выявленные в 16 лет, связаны с повышенным риском развития СПКЯ и проблем с фертильностью к 26 годам, но не влияют на показатели зачатия и успешных родов. Среди девушек с нерегулярными менструациями в подростковом возрасте только 10,5% имели СПКЯ к 26 годам. Эти данные подчеркивают значимость раннего выявления нарушений менструального цикла и гормонального дисбаланса для предупреждения долгосрочных репродуктивных осложнений.
Сегодня ожирение признано одной из самых распространенных неинфекционных пандемий, охвативших подростков всего мира. Этот феномен становится все более обсуждаемым как в научных кругах, так и в обществе в целом. Ожирение существенно влияет на развитие и прогрессирование гиперандрогении, а также ухудшает состояние пациенток с вирильным синдромом. Избыточная масса тела, особенно в форме абдоминального ожирения, усиливает инсулинорезистентность, что приводит к компенсаторной гиперинсулинемии. Гиперинсулинемия стимулирует повышенную продукцию андрогенов яичниками и надпочечниками. В результате возрастает уровень свободного тестостерона в плазме крови за счет снижения уровня глобулина, связывающего половые гормоны. Этот процесс усиливает гиперандрогенные проявления, такие как гирсутизм и акне, и усугубляет течение менструальных нарушений, характерных для СПКЯ.
В исследовании A.T. Taşkömür и Ö. Erten анализировали воспалительные и метаболические параметры у подростков с СПКЯ с учетом различий между группами с нормальной и избыточной массой тела [9]. Исследователи установили, что уровни цистатина C, С-реактивного белка (СРБ) и триглицеридов значительно повышены у подростков с СПКЯ по сравнению с пациентками контрольной группы, что свидетельствует о наличии системного воспалительного процесса и метаболических нарушений, характерных для данного синдрома. Показано, что воспалительные маркеры остаются высокими даже у пациенток с нормальной массой тела. Это указывает на воспалительный компонент СПКЯ, независимый от ожирения. Авторы указывают на потенциал цистатина C и СРБ в качестве предикторов будущих кардиометаболических рисков у подростков с СПКЯ, подчеркивая важность раннего вмешательства для профилактики долгосрочных осложнений.
Кроме того, примерно у 60% девочек с ожирением повышен уровень тестостерона. Следовательно, увеличивается вероятность развития СПКЯ [10, 11]. Ожирение усугубляет состояние пациенток, снижая качество их жизни, вызывая депрессию и нарушая социальную адаптацию. Ожирение и инсулинорезистентность у подростков напрямую коррелируют с тяжестью клинических проявлений вирильного синдрома. Лечение таких состояний требует комплексного подхода, включающего коррекцию массы тела, изменение образа жизни и использование медикаментозных средств.
Еще один важный симптом вирильного синдрома – клиторомегалия – патологическое увеличение клитора вследствие гиперандрогении. Подобное состояние развивается как в результате врожденных аномалий, так и под влиянием повышенного уровня андрогенов в постнатальном периоде. Клиторомегалия часто сопровождается другими признаками гиперандрогении, такими как гирсутизм, акне и олигоменорея, и может указывать на серьезные эндокринные нарушения, включая ВДКН или андрогенпродуцирующие опухоли яичников и надпочечников [12]. У девочек 9–12 лет клиторомегалия диагностируется при поперечной ширине головки клитора > 5 мм и длине капюшона > 24,2 мм, а у подростков 13–16 лет – при ширине головки > 8 мм и длине капюшона > 27,4 мм [13].
Нарушения менструального цикла служат важным диагностическим критерием в клинической картине вирильного синдрома у подростков. Диагностика СПКЯ проводится на основании пересмотренных в 2023 г. Роттердамских критериев [14, 15]. У взрослых для постановки диагноза необходимо наличие двух из трех признаков: клинической или лабораторно подтвержденной гиперандрогении, овуляторной дисфункции, поликистозной морфологии яичников по данным УЗИ или повышенного уровня антимюллерова гормона (АМГ). При сочетании нерегулярных менструаций и гиперандрогении ультразвуковая диагностика или определение АМГ необязательны. У подростков диагноз требует одновременного присутствия гиперандрогении и нарушений овуляции, при этом УЗИ и определение АМГ не рекомендуются ввиду их низкой диагностической специфичности. Важно также исключить другие причины симптомов, которые могут имитировать СПКЯ. Первые годы после менархе характеризуются возможными физиологическими колебаниями менструального цикла, что затрудняет дифференциацию нормальных возрастных изменений от патологий. В соответствии с рекомендациями Европейского общества репродукции человека и эмбриологии (ESHRE), менструальные нарушения считаются патологическими, если длительность цикла превышает 90 дней через год после менархе либо если интервалы между циклами менее 21 или более 45 дней в течение первых трех лет после начала менструаций [15]. Первичная аменорея также считается патологией в отсутствие менструаций к 15 годам или спустя три года после начала телархе.
J.J. Kim и соавт. исследовали клинические и метаболические характеристики подростков с диагностированным на основании Роттердамских критериев 2023 г. СПКЯ. Но эти критерии не соответствовали диагностическим критериям международных доказательных рекомендаций 2023 г. [15]. Подростки, не подходившие под обновленные критерии, демонстрировали неблагоприятные метаболические профили, в том числе повышенные уровни артериального давления, триглицеридов и инсулинорезистентность, что было схоже с профилями подростков, соответствовавших критериям СПКЯ. Из 315 девочек с установленным по Роттердамским критериям диагнозом у 79 (25,1%) пациенток с фенотипами гиперандрогении и поликистозных яичников или нерегулярных менструаций и поликистозных яичников не был диагностирован СПКЯ по новым рекомендациям. Эти пациентки были отнесены к группе риска. Хотя большинство девочек из указанной группы не имели ожирения, их метаболические показатели были хуже, чем у пациенток контрольной группы, и сопоставимы с показателями пациенток, соответствовавших критериям СПКЯ. В группе риска также наблюдались повышенные уровни ЛГ и ЛГ/ФСГ, что свидетельствовало о гормональном дисбалансе. При этом использование ультразвуковых признаков поликистозных яичников для диагностики СПКЯ у подростков в течение первых восьми лет после наступления менархе не рекомендуется, поскольку в этом возрасте часто встречается мультифолликулярное строение яичников, что может привести к гипердиагностике. Эти данные подтверждают, что даже без УЗИ можно выявить подростков группы риска развития СПКЯ. Необходимо регулярное наблюдение за метаболическим состоянием для предотвращения прогрессирования заболевания.
Кроме основных признаков, раннее проявление апокринного запаха, повышенная жирность волос, себорея, андрогенетическая алопеция часто встречаются у подростков с вирильным синдромом и являются важными индикаторами гиперандрогенного состояния. Апокринный запах обусловлен активацией апокринных потовых желез под воздействием андрогенов и нередко отмечается в ранней фазе гиперандрогении. Избыточная жирность волос, вызванная гиперпродукцией кожного сала сальными железами, также является характерным признаком данного состояния. Эти изменения могут предшествовать развитию более выраженных симптомов, таких как гирсутизм и акне, и служат ранними маркерами гиперандрогенного фона. Все эти кожные симптомы объединены в группу «андрогенная дермопатия», что отражает системное воздействие андрогенов на кожу и придатки кожи. В настоящее время отсутствуют оценочные шкалы для точного определения степени тяжести акне. Акне и алопеция, хотя и часто встречаются при гиперандрогении, не могут считаться надежными диагностическими критериями для ее подтверждения. У подростков клиническим маркером гиперандрогении следует считать только выраженные, тяжелые формы акне, которые выходят за рамки обычных возрастных физиологических изменений.
Диагностика
Наряду с клиническим обследованием пациенток с признаками вирилизации важная роль в диагностике отводится анализу крови на уровень половых гормонов, функциональным пробам с адренокортикотропным гормоном (его синтетическим полипептидным аналогом тетракозактидом), генетическим анализам, а также инструментальным методам исследования (УЗИ и МРТ органов малого таза, УЗИ, КТ или МРТ надпочечников) для уточнения причины избыточной секреции андрогенов опухолями надпочечников и яичников и точной топической диагностики [16].
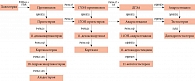
Схема стероидогенеза представляет собой сложную цепочку реакций, поэтому определение уровня поломки и ключевого звена имеет стратегическое значение (рисунок).
Анализ крови на уровень половых гормонов относится к первой линии диагностики и проводится в ранней фолликулярной фазе – не позднее 5–7 суток менструального цикла либо в любой день менструального цикла при аменорее, а в случае приема комбинированных оральных контрацептивов или других препаратов, влияющих на уровень тестостерона (спиронолактон, антиандрогены), – не ранее чем через три месяца после отмены приема препарата [16].
Представителем гормонов с самой высокой андрогенной активностью является тестостерон. Повышение уровня общего тестостерона более чем в три раза часто отмечается у пациенток с андрогенсекретирующими опухолями яичников [4]. Уровни ДГЭАС, а также предшественников андрогенов надпочечников – ДГЭА, андростендиона и глюкокортикостероидов повышены при опухолях надпочечников. Уровень 17-гидроксипрогестерона (17-ОН-П) > 2 нг/мл (или > 6 нмоль/л), но < 10 нг/мл (или < 30 нмоль/л) подтверждает ВДКН вследствие дефицита 21-гидроксилазы, а при пограничных значениях (6–30 нмоль/л или 2–10 нг/мл – так называемая серая зона) анализ проводится повторно [16]. При получении сомнительного результата при повторном тестировании и невозможности проведения пробы с тетракозактидом, а также в целях генетического консультирования на втором этапе рекомендуются генотипирование и выявление мутаций в гене CYP21A2. Описано свыше 200 вариантов CYP21A2. Наиболее часто при вирильной форме встречаются варианты P453S, P30L, I172N. В нашей стране анализ крови на уровень 17-ОН-П с 2006 г. включен в неонатальный скрининг, что позволяет проводить у новорожденных раннюю диагностику классической формы ВДКН, обусловленной дефицитом 21-гидроксилазы, и избежать ошибок при выборе половой идентификации у новорожденных девочек с высокой степенью вирилизации. При положительном результате скрининга проводится ретестирование методом тандемной масс-спектрометрии [14, 15].
У пациенток с умеренным повышением или нормативным значением 17-ОН-П при неклассических формах ВДКН и СПКЯ вирилизация не отмечается, поэтому диагностические критерии данных заболеваний в настоящем обзоре не рассматриваются. Однако важно отметить, что СПКЯ непосредственно связан с высоким уровнем тестостерона яичникового происхождения, что имеет принципиальное значение для исключения иных причин гиперандрогении. Использование прямых методов определения свободного тестостерона, основанных на иммуноферментном и радиометрическом анализах, не рекомендовано из-за низкой чувствительности и специфичности. Оптимальным считается применение расчетных методов определения биодоступности тестостерона с помощью формулы Вермюлена, а также определение индекса свободных андрогенов (ИСА). ИСА отражает отношение общего тестостерона к белку, связывающему половые гормоны (ГСПГ), и рассчитывается по формуле: ИСА = общий тестостерон (нмоль/л) / ГСПГ (нмоль/л) × 100. Нормативное значение ИСА у женщин репродуктивного периода – 0,8–11% [17].
В рамках комплексной диагностики вирильного синдрома оценивают уровни гонадотропинов (ФСГ, ЛГ) и эстрадиола. Результаты интерпретируют в соответствии с возрастными референсными значениями (с учетом стадии полового развития по шкале Таннера). Подавление ЛГ и ФСГ в сыворотке крови отмечается до начала полового созревания или при выраженном избытке андрогенов, приводящем к блокаде гипоталамо-гипофизарно-гонадной оси с отрицательной обратной связью. Повышенные уровни ЛГ и ФСГ сочетаются с первичным гипогонадизмом, в том числе при нарушении полового созревания. Анализ крови на АМГ помогает дифференцировать между собой различные формы нарушения полового созревания – с дисгенезией гонад и без нее [14, 18].
При подозрении на наличие злокачественного новообразования яичников проводятся дополнительные анализы крови на уровень онкомаркеров – альфа-фетопротеина, хорионического гонадотропина бета человека, лактатдегидрогеназы, ингибина В и СА-125. Уровни указанных маркеров могут превышать референсные значения при доброкачественных герминогенных опухолях яичников и оцениваются в совокупности с результатами инструментальных методов диагностики (УЗИ и МРТ органов малого таза, УЗИ, КТ или МРТ надпочечников). Основная роль в топической диагностике отводится УЗИ органов малого таза, КТ и МРТ, с которыми может использоваться селективная катетеризация вен яичников и надпочечников с ретроградной флебографией. В качестве дополнительного метода выполняется селективная катетеризация яичниковых и надпочечниковых вен для установления уровня половых гормонов, секретируемых в кровь, с определением градиента концентрации (в крови, оттекающей от парных органов, в нижней полой и локтевой венах). Несмотря на высокую информативность данного метода, его использование в клинической практике ограничено из-за сложности и инвазивности процедуры. Для гистологической верификации и/или при подозрении на дисгенезию гонад также можно использовать биопсию яичников в ходе диагностической лапароскопии [14, 16, 19].
Генетические тесты признаны стандартом молекулярного подтверждения, генетического консультирования и прогностической оценки. Используются секвенирование (полноэкзомное или геномное), неинвазивный пренатальный тест, пренатальный скрининг с выполнением кордо- или амниоцентеза с установлением кариотипа, а также анализ на различные синдромы, сопровождающиеся образованием опухолей, например DICER1. Оптимальный метод генетического тестирования зависит от предполагаемого диагноза и определяется после консультации генетика [14].
Обсуждение
Вирильный синдром является многофакторным заболеванием, требует ранней комплексной диагностики с учетом не только гормональных, но и метаболических аспектов. Оптимизация терапевтических и хирургических стратегий существенно улучшает прогноз, минимизирует тяжесть клинической симптоматики и предотвращает развитие потенциальных осложнений. Для расширения знаний о патогенезе заболевания необходимы дальнейшие исследования.
Заключение
Вирильный синдром влияет на физическое и психическое состояние подростков, что может привести к значительным долгосрочным последствиям и негативно отразиться на общем здоровье и качестве жизни. Комплексное понимание этиопатогенеза, классификации и клинических проявлений вирилизации имеет решающее значение для дальнейшей разработки корректной диагностической и лечебной стратегии.
Конфликт интересов. Авторы заявляют об отсутствии конфликтов интересов.
Финансирование. Работа выполнена без спонсорской поддержки.
Ye.V. Sibirskaya, PhD, Prof., P.O. Nikiforova, T.S. Panasenko, M.A. Filatova, Ye.D. Burkhanskaya, Ye.A. Volkova, V.V. Bdoyan, A.Yu. Kurmangaleeva
N.I. Pirogov Russian National Research Medical University
Russian Children’s Clinical Hospital – a Branch of N.I. Pirogov Russian National Research Medical University
Chaika Clinic, Moscow
Dolgoprudny Central City Hospital
Morozovskaya Children's City Clinical Hospital, Moscow
Contact person: Yelena V. Sibirskaya, elsibirskaya@yandex.ru
The aim of this review is to systematize current data on virilization syndrome, covering its etiology, clinical presentation, diagnostic methods, and modern therapeutic approaches.
Material and methods. Paper search and analysis was completed using the PubMed, Embase, Cochrane Library and Google Scholar databases. This literature review includes systematic reviews, cohort studies, case series, and randomized controlled trials from 1999 to 2024.
Results. Analysis of the literature has shown that virilizing syndrome is a polyetiological condition caused by both congenital and acquired factors, including dysfunction of the adrenal glands, ovaries, as well as genetic and hormonal dysfunctions. The clinical presentation of the syndrome is characterized by a wide range of manifestations, such as hirsutism, alopecia, voice deepening, clitoral hypertrophy, and menstrual cycle irregularities. Modern diagnostic methods, including hormonal studies, imaging techniques (ultrasound examination, magnetic resonance imaging), and molecular genetic tests, enable accurate identification of the cause of virilization and the development of a personalized treatment approach.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.