Влияние инфликсимаба на коксит у больных анкилозирующим спондилитом
- Аннотация
- Статья
- Ссылки
Результаты. Положительный эффект отмечен у всех пациентов. После трех инфузий инфликсимаба достоверно и клинически значимо снизилась боль в тазобедренных суставах. Она полностью прекратилась у 9 пациентов
в 12 суставах. Интенсивная боль (≥ 40 мм по ВАШ), исходно отмечавшаяся у 21 пациента в 27 суставах, после 3 инфузий инфликсимаба не наблюдалась ни у одного пациента, умеренная боль (≥ 20 и < 40 мм по ВАШ) оставалась только у 2 пациентов в 2 суставах. Уменьшилась величина выпота в этих суставах (по данным ультразвукового исследования), выпот перестал определяться у 9 больных в 12 суставах (36%). Признаки активного коксита отсутствовали в 17 (52%) тазобедренных суставах. После 5–9 инфузий сохранялось полученное улучшение. В ходе лечения развития признаков активного воспаления в тех тазобедренных суставах, которые исходно признавались невоспаленными, не отмечалось.
Заключение. Терапия инфликсимабом эффективна у большинства больных АС с активным кокситом.
Результаты. Положительный эффект отмечен у всех пациентов. После трех инфузий инфликсимаба достоверно и клинически значимо снизилась боль в тазобедренных суставах. Она полностью прекратилась у 9 пациентов
в 12 суставах. Интенсивная боль (≥ 40 мм по ВАШ), исходно отмечавшаяся у 21 пациента в 27 суставах, после 3 инфузий инфликсимаба не наблюдалась ни у одного пациента, умеренная боль (≥ 20 и < 40 мм по ВАШ) оставалась только у 2 пациентов в 2 суставах. Уменьшилась величина выпота в этих суставах (по данным ультразвукового исследования), выпот перестал определяться у 9 больных в 12 суставах (36%). Признаки активного коксита отсутствовали в 17 (52%) тазобедренных суставах. После 5–9 инфузий сохранялось полученное улучшение. В ходе лечения развития признаков активного воспаления в тех тазобедренных суставах, которые исходно признавались невоспаленными, не отмечалось.
Заключение. Терапия инфликсимабом эффективна у большинства больных АС с активным кокситом.



Анкилозирующий спондилит (АС) – хроническое воспалительное заболевание неизвестной этиологии, относящееся к группе серонегативных спондилоартритов. Оно характеризуется поражением различных анатомических структур позвоночника, крестцово-подвздошных суставов, периферических суставов и энтезисов, а также различными системными проявлениями, наиболее частые из которых – это поражение глаз (иридоциклит), сердца (преимущественно проводящей системы и аортального клапана), восходящей части дуги аорты и почек (IgA-нефропатия).
АС является заболеванием, течение и скорость прогрессирования которого трудно прогнозировать. Чаще заболевание протекает волнообразно, причем активность может стихать спонтанно, без лечения, но также известно быстро и медленно прогрессирующее течение. К факторам неблагоприятного прогноза АС относят: поражение тазобедренных суставов, развитие дактилита, низкую эффективность НПВП, увеличение СОЭ более 30 мм/ч, ограничение подвижности позвоночника, олигоартрит, начало заболевания в возрасте до 16 лет [1, 2]. При отсутствии данных факторов более вероятно относительно благоприятное течение болезни. В случае поражения тазобедренных суставов или при наличии любых других трех неблагоприятных факторов больше вероятность быстро прогрессирующего течения.
Лечение АС является актуальной проблемой ревматологии. Основное значение в лечении АС в течение длительного времени придавалось нестероидным противовоспалительным препаратам (НПВП), а в случае наличия артрита периферических суставов также сульфасалазину и внутрисуставному введению глюкокортикостероидов (ГКС). Другие методы фармакотерапии и отдельные лекарственные средства у больных АС, как правило, неэффективны. Список эффективных в лечении АС лекарственных средств пополнился после создания в конце 1990-х ингибиторов фактора некроза опухолей альфа (ФНО-альфа), одного из наиболее активных провоспалительных цитокинов. Инфликсимаб стал одним из первых ингибиторов ФНО-альфа, с успехом применявшимся у больных АС [3, 4].
Для оценки эффекта инфликсимаба при АС используют критерии ASAS [5, 6], а у больных с поражением периферических суставов принимается во внимание также динамика артрита (боль в суставах, число болезненных и припухших суставов). Однако нет должной оценки поражения тазобедренных суставов, определяющего у многих больных АС прогноз болезни. В связи с тем что коксит является одним из самых прогностически неблагоприятных проявлений АС, было решено провести отдельный анализ влияния инфликсимаба на это проявление заболевания. Цель данного исследования – оценить динамику признаков коксита у больных анкилозирующим спондилитом на фоне применения инфликсимаба с использованием УЗИ тазобедренных суставов.
Материалы и методы исследования
В исследование были включены 35 пациентов с АС (23 мужчины и 12 женщин), которым произведено 9 внутривенных инфузий инфликсимаба (препарат Ремикейд компании Centocor, предоставленный фирмой Schering-Plough) в дозе 5 мг/кг массы тела. Схема применения инфликсимаба была следующей: вторая инфузия проводилась через 2 недели после первой, третья – через 4 недели после второй, каждая последующая инфузия осуществлялась через 4–8 недель после предыдущей. Результаты лечения оценивались по принципу назначенного лечения (intent-to-treat), то есть у пациентов, получивших хотя бы одну инфузию инфликсимаба.
Критериями включения в исследование были: достоверный диагноз АС в соответствии с модифицированными Нью-йоркскими критериями [7], возраст старше 18 лет, высокая клиническая активность болезни (BASDAI ≥ 40) и выраженная ночная боль в позвоночнике (≥ 40 мм по 100-мм ВАШ) и/или выраженная боль в периферических суставах (≥ 40 мм по 100-мм ВАШ) и наличие не менее одного припухшего периферического сустава, недостаточная эффективность как минимум двух различных НПВП, применявшихся в течение не менее одного месяца до начала исследования (если они не были противопоказаны и хорошо переносились), а у пациентов с периферическим артритом – также недостаточная эффективность сульфасалазина, применявшегося в суточной дозе 2–3 г в течение как минимум 4 месяцев (если он не был противопоказан и хорошо переносился) и локальной терапии ГКС (не менее двух внутрисуставных или периартикулярных инъекций на протяжении последних трех месяцев).
В качестве фоновой противовоспалительной терапии 34 из 35 пациентов продолжали принимать ранее назначенные НПВП. У одного пациента НПВП и ГКС не применялись вследствие хронического гломерулонефрита. Четыре пациента также принимали ГКС внутрь (в дозах, эквивалентных не более 7,5 мг преднизолона в день), 5 пациентов – метотрексат (в дозе 10–12,5 мг в неделю), 2 пациента – сульфасалазин (в дозе 2 г/сут). Один пациент принимал колхицин (в дозе 1 мг/сут) в связи с амилоидозом. Все эти препараты были назначены больным задолго до включения в исследование и применялись в стабильных дозах.
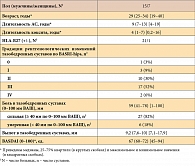
HLA-B27 выявлен у преобладающего большинства (94%) больных. Медиана BASDAI cоставила 65 (0–100 мм по ВАШ). Медиана длительности болезни составляла 9 лет, относительно небольшая длительность АС (менее 5 лет) отмечалась у 4 больных, а значительная длительность (более 15 лет) – у 6 больных. У 33 из 35 больных отмечался сакроилеит 3 и 4 стадии. У подавляющего большинства больных (n = 32) в клинической картине преобладали признаки активного спондилита, о чем свидетельствовали выраженные ночные боли в позвоночнике. У многих больных (n = 23) отмечались ограничения движений во всех отделах позвоночника, но число пациентов с множественными синдесмофитами на рентгенограммах было небольшим (n = 8). У многих больных (74%) также отмечался периферический артрит с типичным для АС преимущественным поражением относительно небольшого числа крупных и средних суставов нижних конечностей. Коксит имел место у 22 больных.
Рентгенологические изменения тазобедренных суставов оценивались с помощью индекса BASRI-hips [8], в соответствии с которым выделяется 5 стадий (0–IV) (табл. 1).
Оценивались боль в тазобедренных суставах (100-мм ВАШ) и динамика выпота в тазобедренных суставах по данным ультразвукового исследования (УЗИ). УЗИ тазобедренных суставов проводилось на аппарате Sono Diagnost 360 (Philips) с использованием линейного (7,5 МГц) и конвексного (5,0 МГц) датчиков. Отдельно оценивались наличие выпота и количество жидкости в полости тазобедренных суставов. Наличие выпота устанавливалось в том случае, если расстояние между сигналами от капсулы сустава и внутренней поверхности шейки бедренной кости составляло более 7 мм [9].
Для целей данного исследования использовалось понятие активного коксита. Коксит считался активным при одновременном наличии двух признаков: боли (спонтанной или возникающей при пассивных движениях в тазобедренном суставе) и выпота в полости тазобедренного сустава.
Результаты
Исходно коксит наблюдался у 22 больных. Признаки, характерные для активного коксита, были выявлены в 33 тазобедренных суставах у 22 больных. У 11 больных отмечался односторонний активный коксит, также у 11 больных имел место двухсторонний активный коксит. Характеристика данной подгруппы больных представлена в таблице 2.
В данной подгруппе больных, так же как и в основной группе, преобладали мужчины. Данная подгруппа больных АС была сопоставима со всей группой больных по возрасту, давности и активности АС (р < 0,05, критерий Манна – Уитни).
18 из 22 больных этой подгруппы получили 9 инфузий инфликсимаба, у остальных 4 больных число инфузий составляло 5–8. Оценка результатов лечения (боль в тазобедренных суставах по 100-мм ВАШ и величина выпота ультрасонографически) проводилась дважды: после первых 3 инфузий (медиана срока оценки 4,5 недели, диапазон 2–8 недель) и после 5–9 инфузий инфликсимаба (медиана срока оценки 7 недель, диапазон 4–9 недель).
Клинически значимым считалось уменьшение боли на ≥ 20 мм по 100-мм ВАШ и уменьшение выпота на ≥ 1 мм.
В качестве фоновой терапии все пациенты с кокситом продолжали принимать ранее назначенные НПВП. Трое из этих пациентов также продолжали принимать ГКС внутрь (в дозах, эквивалентных не более 7,5 мг преднизолона в день), 4 пациента – метотрексат, 1 пациент – сульфасалазин. Модификация фоновой терапии разрешалась только после подведения итогов применения трех инфузий инфликсимаба.
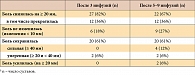
После 3 инфузий инфликсимаба отмечалось статистически и клинически значимое уменьшение боли и выпота в исходно измененных тазобедренных суставах (табл. 3). Боль снизилась клинически значимо в 27 (82%) тазобедренных суставах, в том числе прекратилась в 12 (38%) суставах. Сильная боль (≥ 40 мм по 100-мм ВАШ), исходно отмечавшаяся в 27 суставах, после 3 инфузий инфликсимаба не наблюдалась ни у одного больного. Умеренная боль (≥ 20 мм и < 40 мм по ВАШ) сохранялась только в 2 (6%) тазобедренных суставах. Существенного эффекта не отмечалось со стороны 6 (18%) исходно измененных тазобедренных суставов. Усиления боли не наблюдалось ни в одном тазобедренном суставе.
Выпот после 3 инфузий инфликсимаба значимо уменьшился в 22 (67%) тазобедренных суставах, в том числе значительно (≥ 2 мм) в 16 (49%) суставах, и увеличился только в 2 (6%) суставах. Признаки активного коксита перестали определяться в 16 (49%) исходно измененных тазобедренных суставах (табл. 3).
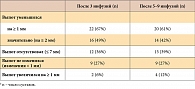
Достигнутый после трех инфузий клинический эффект в основном сохранялся на протяжении последующей терапии (табл. 3). Медианы выраженности боли в тазобедренных суставах после трех и после 5–9 инфузий инфликсимаба были низки и сравнимы. На протяжении времени анализа боль устойчиво прекратилась в 7 (21%) суставах, значимо снизилась и в дальнейшем не усиливалась в 22 (67%) суставах. Интенсивная боль (≥ 40 мм по ВАШ), исходно отмечавшаяся в 27 (82%) тазобедренных суставах у 19 больных, стабильно (на всем протяжении терапии) снизилась в 22 (67%) суставах у 16 больных. Неустойчивый анальгетический эффект (первоначальное снижение боли с последующим ее усилением) отмечался в отношении 6 (18%) тазобедренных суставов.
В основном сохранялось положительное влияние инфликсимаба и на величину выпота в тазобедренных суставах. После 5–9 инфузий препарата выпот устойчиво отсутствовал в 7 (21%) исходно измененных суставах, определялся в меньшем количестве в 20 (61%) суставах, в том числе в значительно меньшем количестве (на ≥ 2 мм) – в 14 (42%) тазобедренных суставах. Выпот не уменьшился (по сравнению с исходным) в 9 (27%) суставах и увеличился в 4 (14%) тазобедренных суставах (табл. 5). В небольшом числе случаев отмечался неустойчивый эффект: первоначальное уменьшение выпота с последующим его накоплением.
Общий эффект лечения (одновременное уменьшение боли и выпота) после 3 инфузий наблюдался в 18 (55%) суставах у 14 больных. После 5–9 инфузий инфликсимаба первоначально достигнутый общий эффект сохранялся или увеличивался (по сравнению с общим эффектом после 3 инфузий) в отношении большинства (23, 70%) суставов и уменьшился в отношении 10 (30%) тазобедренных суставов. Некоторая нестабильность лечебного эффекта инфликсимаба в отношении коксита объяснялась, скорее, уменьшением у некоторых больных длительности сохранения выраженного эффекта по мере продолжения терапии, чем собственно снижением эффективности.
В ходе лечения появление признаков активного воспаления в тех тазобедренных суставах, которые исходно считались неизмененными, не отмечалось.
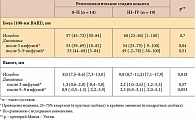
С целью анализа зависимости эффекта инфликсимаба от стадии исходных рентгенологических изменений тазобедренных суставов проведено сравнение динамики проявлений коксита в двух подгруппах: у пациентов с кокситом небольшой стадии (0–II, n = 14) и пациентов со значительной рентгенологической стадией коксита (III–IV, n = 19).
Исходный уровень боли в измененных тазобедренных суставах у больных с различными рентгенологическими стадиями коксита по BASRI-hips был сравним, хотя в цифровом отношении был больше у больных с III–IV рентгенологическими стадиями. Исходная величина выпота в тазобедренных суставах была статистически достоверно больше у больных со значительными рентгенологическими изменениями. Однако статистически значимых различий между динамикой уровня боли и величины выпота у больных с различной стадией коксита установлено не было (табл. 6).
Частота достижения клинически значимого результата лечения (снижение боли в тазобедренных суставах на ≥ 20 мм по 100-мм ВАШ и/или уменьшение выпота на ≥ 1 мм в полости тазобедренных суставов) при разной исходной рентгенологической стадии коксита также оказалась сравнимой (табл. 7).
Применение инфликсимаба характеризовалось положительной динамикой проявлений коксита, причем выраженный эффект наблюдался уже после первых трех инфузий. У преобладающего числа больных значительно (более чем на 90%) снизился уровень боли в тазобедренных суставах, значимо снизился объем выпота в тазобедренных суставах по данным УЗИ, причем в 12 (36%) суставах выпот перестал определяться.
Первоначально достигнутый эффект сохранялся на протяжении всего периода терапии в 23 (70%) суставах у 17 (77%) больных. Длительность сохраняющегося эффекта составляла у большинства больных 8 недель. У трех больных на фоне дальнейшей терапии отмечалось более быстрое начало снижения эффекта инфликсимаба (через 4–5 недель после инфузии), чем объяснялось выявление ухудшения состояния тазобедренных суставов в виде нарастания боли и выпота на момент оценки после 5–9 инфузий, так как срок оценки совпадал с моментом обострения коксита.
Степень выраженности эффекта от применения инфликсимаба не зависела от исходной рентгенологической градации коксита. У больных с более выраженными рентгенологическими изменениями тазобедренных суставов выявлялась более высокая величина выпота по данным УЗИ тазобедренных суставов.
Большинство больных после 3 инфузий инфликсимаба полностью отменили НПВП или уменьшили их дозу на 50%. Эффект, полученный после 3 инфузий инфликсимаба, длительно сохранялся на фоне продолжения терапии у преобладающего числа больных.
Отсутствие положительной динамики боли после 5–9 инфузий инфликсимаба у 10 больных можно объяснить наличием у них выраженных структурных изменений в тазобедренных суставах (счет BASRI II–III).
Обсуждение
Особенностью нашего исследования была детальная оценка динамики коксита, частого и прогностически неблагоприятного проявления АС [10]. Поскольку у многих пациентов коксит отмечался в течение длительного времени перед началом исследования и сопровождался рентгенологическими изменениями тазобедренных суставов, для более точной характеристики противовоспалительного действия инфликсимаба мы применили условное понятие «активный коксит», определяя его как сочетание боли (или болезненности) с выпотом в полости тазобедренного сустава. Исследование выпота мы считали необходимым еще и потому, что это позволяло отграничить эффект инфликсимаба в отношении энтезитов, нередко отмечавшихся в области тазобедренных суставов. Величина выпота уменьшилась достоверно, причем в преобладающем большинстве (в 20 из 33) исходно воспаленных тазобедренных суставов.
Выраженный положительный эффект в отношении коксита наблюдался уже после первых трех инфузий. Достоверно, более чем на 90%, снизился уровень боли в тазобедренных суставах, также достоверно, почти на 20%, снизился уровень выпота в тазобедренных суставах, а в 12 (36%) суставах выпот перестал определяться. Похожие результаты были получены нами в другом исследовании после внутривенного применения высоких доз глюкокортикостероидов у больных АС [11].
У двух больных после 3 инфузий инфликсимаба отмечалось значительное снижение уровня боли в тазобедренных суставах при одновременном увеличении выпота в этих суставах, что, возможно, объясняется техническими погрешностями ультразвукового метода определения выпота. При дальнейшем наблюдении за этими больными выявлялся клинически значимый эффект как по уровню боли, так и по величине выпота в тазобедренных суставах. Сохранение боли после 5–9 инфузий инфликсимаба у 10 больных можно объяснить наличием у них выраженных структурных изменений в тазобедренных суставах (счет BASRI II–III).
Первоначально достигнутый положительный эффект сохранялся на протяжении всего периода терапии в 26 тазобедренных суставах у 18 (82%) больных. Длительность эффекта составляла у большинства больных 8 недель. У трех больных на фоне дальнейшей терапии отмечалось более быстрое начало снижения эффекта инфликсимаба (через 4–5 недель после инфузии), чем объяснялось выявление ухудшения состояния тазобедренных суставов (нарастание боли и выпота).
Степень выраженности лечебного эффекта инфликсимаба не зависела от исходной рентгенологической градации коксита. У больных с более выраженными рентгенологическими изменениями тазобедренных суставов выявлялся более значительный выпот по данным УЗИ тазобедренных суставов. Подобное сопоставление проводилось в исследовании А.Г. Бочковой и соавт. при изучении коксита у больных АС, в котором были получены аналогичные результаты [10].
Заключение
Результаты проведенного исследования инфликсимаба при АС свидетельствуют о высокой эффективности препарата в отношении коксита у преобладающего большинства больных. Применение инфликсимаба характеризовалось положительной динамикой проявлений коксита, причем выраженный эффект наблюдался уже после первых трех инфузий и длительно сохранялся на фоне продолжения терапии у преобладающего числа больных. Таким образом, полученные нами результаты показали, что инфликсимаб эффективен у большинства больных АС с кокситом.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.