Патогенетическая терапия спондилоартритов на современном этапе
- Аннотация
- Статья
- Ссылки
- English

Введение
Спондилоартриты (СпА) представляют собой достаточно разнообразную группу заболеваний, объединяемых по основным клиническим проявлениям и ассоциации с иммуногенетическим маркером HLA-B27. К данной группе заболеваний относятся аксиальный спондилоартрит (аксСпА), представленный вариантами рентгенологического (анкилозирующий спондилит (АС)) и нерентгенологического аксиального спондилоартрита (нр-аксСпА), псориатический артрит (ПсА), включая псориатический спондилит, а также другие состояния – реактивные артриты, ассоциированный с воспалительными заболеваниями кишечника спондилоартрит, недифференцированный (неклассифицируемый) спондилоартрит.
Концепция этой группы заболеваний, первоначально названной серонегативными спондилоартритами, впервые была представлена в 1974 г. [1], теперь она известна как спондилоартриты. В дальнейшем было обнаружено, что ее основной характеристикой является развитие энтезита [2, 3] как первичного поражения суставов при воспалении, связанном с СпА [4]. Общими также признаны молекулярные механизмы иммунного воспаления.
За последние несколько лет в ходе генетических, экспериментальных и клинических работ собраны доказательства того, что ось провоспалительных цитокинов «интерлейкин 23/интерлейкин 17» (ИЛ-23/ИЛ-17) играет критическую роль в патогенезе СпА. К таковым относятся полногеномные ассоциативные исследования и идентификация клеток, продуцирующих ИЛ-23 и ИЛ-17, у людей, экспериментальные исследования на животных, которые подтверждают функциональную роль активации оси «ИЛ-23/ИЛ-17» в формировании энтезита и энтезиальной кости [5–7]. Уникальный костный фенотип, который наблюдается при ПсА и АС, представляет собой сосуществование системной потери костной массы и новообразования периостальной и энтезиальной костей, что, вероятно, является результатом совместного действия ИЛ-23 и ИЛ-17 на кость [6, 7].
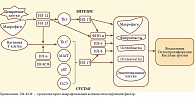
При очевидном синергизме биологических эффектов характеристики ИЛ-23 и ИЛ-17 существенно различаются (рисунок). Гиперпродукция ИЛ-23 наблюдается на ранних этапах активации адаптивного иммунного ответа. ИЛ-23 продуцируется в основном активированными миелоидными клетками (дендритными клетками, моноцитами/макрофагами), ИЛ-17 – Т-клетками и врожденными лимфоидными клетками [6].
ИЛ-23 принадлежит к семейству ИЛ-12 и действует как мост между врожденным и адаптивным компонентами иммунной системы [8].
ИЛ-17 играет ключевую роль в иммунитете к бактериальным и грибковым патогенам [9]. Семейство ИЛ-17 состоит из нескольких цитокинов: ИЛ-17A, ИЛ-17B, ИЛ-17C, ИЛ-17D, ИЛ-17E и ИЛ-17F, из которых лучше всего изучен ИЛ-17A.
ИЛ-17A – провоспалительный цитокин, который помимо индукции воспалительных реакций также способен стимулировать ангиогенез и остеокластогенез [10]. Он необходим и для модулирования взаимодействия между комменсальными микробами и эпителиальными клетками в кишечнике, на коже и слизистых оболочках. Процесс взаимодействия между микробиотой и клетками, продуцирующими ИЛ-17A, является звеном патогенеза иммуноопосредованных воспалительных и онкологических заболеваний [11]. На сегодняшний день дисбиоз кишечника и кожи рассматривается как один из вероятных путей индукции иммуновоспалительного процесса при СпА и псориазе, поэтому роль продукции ИЛ-17 возможна уже на этапе предболезни.
Помимо ИЛ-17A во взаимодействие организма с микробиотой вовлечены и другие цитокины этого семейства [11]. Наиболее близкий к ИЛ-17А белок ИЛ-17F. Он связывается с тем же рецепторным комплексом – гетеродимером «ИЛ-17-рецептор А/ИЛ-17-рецептор С» и индуцирует качественно, но не количественно сходный сигнал, поскольку биологические эффекты ИЛ-17А гораздо более выражены, чем эффекты ИЛ-17F [10, 11].
Получено множество доказательств участия продуцирующих ИЛ-17 клеток в патогенезе СпА. Так, уровни Т-хелперов, продуцирующих ИЛ-17 (Th17), в периферической крови у пациентов с АС и ПсА были выше, чем у здоровых лиц [12]. Сообщалось об увеличении количества Th17 в синовиальной жидкости у больных СпА [13]. Иммуногистологический анализ фасеточных суставов у лиц с АС также выявил более высокую экспрессию ИЛ-17+ Т-лимфоцитов [14]. При АС установлена корреляция между количеством Th17 и активностью заболевания, оцениваемой по BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) [15].
Цитокины семейства ИЛ-17 продуцируются Th17-лимфоцитами (ИЛ-17+CD4+ T-лимфоцитами, идентифицированными в 2005 г.), γδT-клетками, мукозо-ассоциированными инвариантными Т-клетками (MAIT), врожденными лимфоидными клетками 3-го типа (ILC3), а также резидентными Т-клетками памяти, CD3-CD56+NK-клетками и тучными клетками [7].
Считается, что ИЛ-23 является основным фактором, который регулирует дифференцировку CD4+-нативных Т-клеток в Th17 (см. рисунок). Однако в ряде исследований показано, что ИЛ-23 не является необходимым для этого процесса [16, 17].
В нескольких исследованиях, посвященных СпА, установлено, что активация врожденной иммунной системы может иметь большее значение, чем адаптивной [18].
Как было отмечено ранее, существенный вклад в продукцию ИЛ-17А при СпА вносят такие функционирующие в качестве компонентов системы врожденного иммунитета источники, как тучные клетки [14, 19], MAIT [20], γδT [9, 21, 22], ILC3 [23]. В частности, ИЛ-17-продуцирующие MAIT были идентифицированы в коже и крови у пациентов с псориазом [24], а также в синовиальной жидкости у пациентов с ПсА [25]. Доля ИЛ-17+-MAIT была повышена в крови и синовиальной жидкости при АС [26, 27], причем наблюдалась корреляция количества активированных MAIT и активности заболевания, оцениваемой по ASDAS (Ankylosing Spondylitis Disease Activity Score) [26]. Повышенные уровни ILC3 были выявлены в периферической крови у пациентов с ПсА по сравнению со здоровым контролем, при этом они коррелировали с активностью заболевания [28]. ILC3 идентифицировали в энтезисе у пациентов с АС [29]. Высокие уровни ILC3 были обнаружены в периферической крови, кишечнике, костном мозге и синовиальной жидкости больных АС [30]. Локальная активация ILC3 может быть обусловлена генетически и эпигенетически, механическим стрессом, а также воспалительными реакциями, вызванными дисбиозом кишечника [5].
Это подчеркивает значение разных, в том числе связанных с дисфункцией врожденных механизмов иммунитета, путей гиперпродукции ИЛ-17 в патогенезе СпА.
ИЛ-17A участвует в патогенезе не только СпА, но и ревматоидного артрита. ИЛ-17A является мощным индуктором других провоспалительных цитокинов, в частности ИЛ-1, ИЛ-6, фактора некроза опухоли α (ФНО-α) [31]. В целом как ИЛ-17A, так и ИЛ-17F действуют синергически с ФНО-α [32]. В то же время клинические данные свидетельствуют о том, что блокада ФНО-α у пациентов с АС не влияла на ось «ИЛ-23/ИЛ-17» [33, 34].
Особого внимания заслуживает регуляторное влияние ИЛ-17A на гомеостаз кости, которое осуществляется посредством активации сложных клеточных и молекулярных взаимодействий. ИЛ-17A может оказывать прямое положительное или отрицательное воздействие на остеокластогенез в зависимости от его концентрации in vitro. Косвенное стимулирование остеокластогенеза ИЛ-17A реализуется за счет продукции или индукции экспрессии рецептора-активатора лиганда ядерного фактора κB. Кроме того, ИЛ-17A обладает различными эффектами в отношении созревания клеток-предшественников остеобластов в остеобласты в зависимости от стадии дифференцировки клеточного предшественника. Полагают, что именно ИЛ-17A действует как связующее звено между костной тканью и иммунной системой. Это объясняет, почему блокада ИЛ-17A, с одной стороны, ингибирует костную эрозию и может замедлять системную потерю костной массы при ПсА и АС, а с другой – уменьшает остеопролиферацию и образование энтезофитов/синдесмофитов при ПсА [6, 35].
Таким образом, получено значительное количество данных в пользу того, что ИЛ-17A, а возможно, и другие представители семейства ИЛ-17 могут претендовать на роль самостоятельного фактора развития хронического воспаления и костной ремодуляции при СпА. Кроме того, имеются доказательства независимой от ИЛ-23 продукции ИЛ-17 [10, 14, 16–30]. Стратегии блокирования ИЛ-23 на моделях у животных способствовали предотвращению развития СпА, но не подавляли уже развившееся заболевание, что, возможно, указывает на роль ИЛ-23 в инициации врожденного иммунного заболевания, тогда как персистирующее заболевание зависит от активации Т-клеток памяти, которые стимулируют выработку ИЛ-17А независимо от ИЛ-23 [36]. Это может быть объяснением недостаточной эффективности ингибиторов ИЛ-23 при аксСпА [37].
Знание иммунологических механизмов развития воспаления при СпА лежит в основе наиболее эффективных методов современной терапии генно-инженерными биологическими препаратами (ГИБП) и таргетными синтетическими базисными противовоспалительными препаратами (тсБПВП). Более глубокое понимание патогенетической роли оси «ИЛ-23/ИЛ-17», клеточных источников этих цитокинов и их молекулярной регуляции при СпА необходимо для разработки новых терапевтических стратегий, нацеленных на эти механизмы [38].
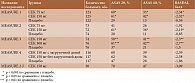
Спектр клинических показаний для назначения ГИБП и тсБПВП в соответствии с официальными инструкциями по применению [39] представлен в табл. 1.
Поскольку регистрация показаний базируется на результатах специально проведенных клинических исследований, только шесть препаратов из двух групп зарегистрированы для лечения основных форм СпА (аксСпА/АС, нр-аксСпА и ПсА): из ингибиторов ФНО-α – этанерцепт, адалимумаб, цертолизумаба пэгол и голимумаб, из ингибиторов ИЛ-17А – секукинумаб и иксекизумаб.
Исходя из приведенных выше данных о ключевой роли ИЛ-17А в патогенезе СпА, особое внимание следует обратить на группу ингибиторов этого цитокина. Среди них наиболее изученным является секукинумаб (СЕК), активно применяющийся в нашей стране с 2016 г.
Секукинумаб при аксиальном спондилоартрите и анкилозирующем спондилите
Еще в первом пилотном исследовании СЕК продемонстрировал способность быстро снижать выраженность клинико-лабораторной активности АС при хорошей переносимости [40]. Эффективность СЕК при аксСпА оценивалась в пяти многоцентровых исследованиях серии MEASURE фазы III [41], включая четыре рандомизированных двойных слепых исследования: MEASURE 1 – двухлетнее исследование с продлением на три года [42], MEASURE 2 – пятилетнее исследование [42, 43], MEASURE 3 – трехлетнее исследование [44], MEASURE 4 – двухлетнее исследование [45], а также открытое исследование MEASURE 2-J в японской популяции [46]. Основные характеристики и результаты исследований серии MEASURE представлены в табл. 2 [41].
В исследования включали пациентов 18 лет и старше с активным АС по модифицированным Нью-Йоркским критериям, с активностью процесса 4 балла и более по BASDAI и болью в позвоночнике 4 см и более по Визуальной аналоговой шкале (ВАШ), несмотря на лечение максимально переносимыми дозами нестероидных противовоспалительных препаратов (НПВП). Пациенты, ранее получавшие не более одного ингибитора ФНО, допускались в исследование, если наблюдались недостаточный ответ на препарат в стабильной дозе в течение трех месяцев и более или непереносимость хотя бы одной его дозы. Во всех исследованиях средний возраст пациентов составлял 40–45 лет. От 61 до 78% ранее не получали ингибиторы ФНО. Первичной конечной точкой во всех исследованиях была доля больных, которые на 16-й неделе соответствовали критериям 20%-ного ответа по ASAS (Аssessment of SpondyloArthritis International Society) (ASAS 20). Помимо этого применялся критерий хорошего ответа (ASAS 40) и оценивалась динамика BASDAI.
Пациенты в исследованиях MEASURE 1–4 были рандомизированы в одну из двух групп с разными режимами дозирования СЕК или группу плацебо. Рандомизация была стратифицирована по исходному использованию ингибиторов ФНО [41].
Начиная с 16-й недели больные, первоначально рандомизированные в группу плацебо, переводились на активную терапию СЕК.
Как видно из табл. 2, лечение СЕК было высокоэффективным по сравнению с применением плацебо в отношении ответа на терапию по ASAS 20, ASAS 40 и BASDAI.
Одним из важнейших выводов из исследований серии MEASURE было структурно-модифицирующее действие СЕК. В исследовании MEASURE 1 СЕК в дозе 150 мг уменьшал выраженность воспаления (отека костного мозга/остеита) в крестцово-подвздошных суставах (КПС) у пациентов с АС по данным магнитно-резонансной томографии (МРТ) [42, 47]. Кроме того, применение СЕК ассоциировалось с более выраженным средним снижением активности спондилита относительного исходного показателя по данным МРТ (ASspi-MRI-a) [42]. Достигнутое на 16-й неделе применения СЕК уменьшение воспаления сохранялось в течение четырех лет лечения [47]. МРТ-ремиссия (оценка спондилита по Берлинской шкале < 2) была достигнута у 33% пациентов [47].
Терапия СЕК в дозе 150 мг обусловливала низкую скорость рентгенологического прогрессирования при длительном использовании [47]. В исследовании MEASURE 1 среди 78 пациентов, которые первоначально были рандомизированы для приема СЕК в дозе 150 мг и проводили лечение на протяжении четырех лет, у 79% не было определено рентгенологического прогрессирования – изменение mSASSS (modified Stoke Ankylosing Spondylitis Spinal Score) < 2 по сравнению с исходным уровнем [47].
Секукинумаб при нерентгенологическом аксиальном спондилоартрите
СЕК изучался при нр-аксСпА в исследовании PREVENT. Из 555 рандомизированных пациентов большинство были НLA-B27-позитивные [48]. Больные получали СЕК в дозе 150 мг еженедельно в течение четырех недель подкожно с и без загрузочной дозы либо плацебо. Ответ по ASAS 40 у ранее не получавших ингибиторы ФНО был значительно выше в группе СЕК 150 мг с загрузочной дозой (41,5%) по сравнению с группой плацебо (29,2%) на 16-й неделе (р = 0,0197) и значительно выше в группе СЕК 150 мг без загрузочной дозы (39,8%) по сравнению с группой плацебо (19,9%) на 52-й неделе (р < 0,0021). Доля достигших BASDAI 50 была значительно выше среди получавших СЕК 150 мг с загрузкой (37,3%) или без нее (37,5%) по сравнению с принимавшими плацебо (21,0%) (р = 0,0001 и р = 0,0002 соответственно). Обе схемы назначения СЕК по сравнению с применением плацебо значительно снижали выраженность внутрикостного отека в области КПС по данным МРТ – -1,68 и -1,03 против -0,39 (р < 0,0001 в обоих случаях) [48].
При субанализе результатов эффективности в разных подгруппах больных нр-аксСпА частота ответа по ASAS 40 на 16-й неделе в подгруппе с повышением уровня С-реактивного белка и наличием активного сакроилиита по данным МРТ (СРБ+/МРТ+) составила 52,3% на фоне лечения СЕК и 21,8% на фоне применения плацебо (р < 0,0001). Частота ответа по ASAS 40 для СЕК и плацебо составила 43,9 и 32,6% в подгруппах HLA-B27-позитивных больных, 32,7 и 16,4% в подгруппах HLA-B27-негативных, 51,2 и 30,8% у мужчин и 31,7 и 25,3% у женщин соответственно [49].
Секукинумаб при псориатическом артрите
При псориазе и ПсА в коже и суставах ИЛ-17A действует на клеточные мишени, включая кератиноциты, нейтрофилы, эндотелиальные клетки, фибробласты, остеокласты, хондроциты и остеобласты, стимулируя выработку хемокинов, провоспалительных и про-пролиферативных цитокинов, которые способствуют развитию воспаления и ремоделированию костной ткани [50]. Поэтому применение СЕК также активно изучалось при ПсА. Исследование фазы II показало высокую клиническую эффективность при 24-недельном применении СЕК у 42 больных ПсА [51], что было подтверждено дальнейшими исследованиями серии FUTURE фазы III.
В двойном слепом исследовании FUTURE 1 были рандомизированы 606 пациентов с ПсА в соотношении 1:1:1 на два режима дозирования СЕК или плацебо [52]. Частота ответа по АCR 20 (American College of Rheumatology) на 24-й неделе была значительно выше в группах СЕК 150 мг (50,0%) и СЕК 75 мг (50,5%), чем в группе плацебо (17,3%) (р < 0,001 для обоих сравнений с плацебо). По показателям «достижение ответа по ACR 50» и «замедление структурного повреждения суставов» (вторичные конечные точки исследования) группы СЕК значительно превосходили группу плацебо. Улучшение сохранялось в течение 52 недель.
В двойном слепом исследовании FUTURE 2 были рандомизированы 397 пациентов для получения СЕК 300 мг (n = 100), СЕК 150 мг (n = 100), СЕК 75 мг (n = 99) или плацебо (n = 98). Значительно более высокая доля пациентов достигла ACR 20 на 24-й неделе при применении СЕК в дозе 300 мг по сравнению с применением СЕК в дозе 150 и 75 мг или плацебо – 54% (p < 0,0001 по сравнению с плацебо), 51% (p < 0,0001 по сравнению с плацебо), 29% (p = 0,0399 по сравнению с плацебо) и 15% [53].
В исследовании FUTURE 3, в котором больные стратифицировались в зависимости от применения ингибиторов ФНО в анамнезе (n = 414), в общей группе частота ответа по ACR 20 на 24-й неделе была значительно выше в группах СЕК 300 мг (48,2%; p < 0,0001) и СЕК 150 мг (42%; p < 0,0001) по сравнению с группой плацебо (16,1%) [54]. Достигнутый результат сохранялся в течение 52 недель. Частота ответа по ACR 50 через 24 недели также была значительно выше в группах СЕК 300 мг (34,5%; p < 0,0001) и СЕК 150 мг (18,8%; p < 0,05) по сравнению с группой плацебо (8,8%).
В исследовании FUTURE 5, в котором использовались четыре варианта дозирования СЕК без плацебо-контроля, у 996 рандомизированных больных наблюдались аналогичные с предыдущими исследованиями клинические результаты [55]. В данном исследовании фокус делался на рентгенологическом прогрессировании. Доля пациентов без рентгенологического прогрессирования (изменение vdH-mTSS по сравнению с исходным уровнем ≤ 0,5) составила 91,8, 85,2 и 87,2% в группах СЕК 300 мг с нагрузкой и СЕК 150 мг с нагрузкой и без нагрузки соответственно на 52-й неделе, что свидетельствовало об очень низкой степени рентгенологического прогрессирования в периферических суставах при ПсА.
Обобщенный анализ результатов исследований FUTURE 2 и 3 показал высокую эффективность СЕК в отношении периферических энтезитов [56]. Так, препарат обеспечивал раннее и стойкое разрешение энтезита у 89% пациентов с ПсА в течение двух лет.
Наконец, рандомизированное исследование MAXIMISE было посвящено оценке СЕК у больных псориатическим спондилитом [57]. В это двойное слепое плацебо-контролируемое многоцентровое 52-недельное исследование фазы IIIb были включены пациенты 18 лет и старше с диагнозом ПсА, классифицированные по критериям CASPAR (ClASsification criteria for Psoriatic ARthritis), а также имеющие такие признаки псориатического спондилита, как воспалительная боль в позвоночнике интенсивностью ≥ 40 мм по ВАШ и BASDAI ≥ 4 балла, несмотря на использование по крайней мере двух НПВП. У больных псориатическим спондилитом на 12-й неделе СЕК в дозах 300 и 150 мг значительно улучшал ответ по ASAS 20 по сравнению с плацебо – 63 и 66 против 31% (p < 0,0001). При оценке динамики данных МРТ относительно исходного уровня по Берлинскому индексу на 12-й неделе средние наименьшие квадраты разницы по сравнению с плацебо для всего позвоночника составили -0,4 в группе СЕК 300 мг (p < 0,01) и -0,4 в группе СЕК 150 мг (р < 0,05), для КПС – -0,5 в группе СЕК 300 мг (p < 0,01) и -0,5 в группе СЕК 150 мг (p < 0,01).
Заключение
Приведенные данные подтверждают, что СЕК как яркий представитель группы ингибиторов ИЛ-17А является одним из наиболее перспективных препаратов для лечения больных СпА [58], а общее направление ингибиции ИЛ-17 – магистральным для данной тяжелой и распространенной категории пациентов.
D.E. Karateev, MD, PhD, Prof., E.L. Luchikhina, PhD
Moscow Regional Research and Clinical Institute
Contact person: Dmitry E. Karateev, dekar@inbox.ru
Suppression of the biological effects of interleukin 17A (IL-17A) is one of the most promising methods for suppressing immune inflammation in sponoarthritis (SpA). There is a significant amount of scientific evidence that IL-17A (and possibly another member of the IL-17 family) can reasonably claim to be an independent key factor of the development of chronic inflammation and bone remodulation in SpA. Despite the presence of the pathogenetic axis "IL-23/IL-17A", reliable confirmation of the production of IL-17A independent from IL-23 has recently been received. Probably, it is IL-17A that acts as a link between bone tissue and the immune system. This is an explanation why blockade of IL-17A on the one hand inhibits the development of bone erosions and can also slow down systemic bone loss, and on the other hand, reduce osteoproliferation and the formation of enthesophytes/syndesmophytes in SpA. Theoretical considerations are supported by the big number of clinical studies of the secukinumab, the first IL-17A inhibitor approved for the practical use. Randomized trials MEASURE 1–4 and MEASURE 2-J in ankylosing spondylitis, PREVENT in nonradiological axial spondyloarthritis, FUTURE 1–5 and MAXIMISE in psoriatic arthritis and psoriatic spondylitis demonstrated the high efficiency of IL-17A blockade in all these diseases in relation to clinical symptoms and the progression of structural lesions in the joints and spine.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.