количество статей
7261
Пожалуйста, авторизуйтесь:
Исследования
Влияние нейропротективной терапии на развитие поздних осложнений сахарного диабета: данные клинических и экспериментальных исследований
Эффективная фармакотерапия. Эндокринология. СПЕЦВЫПУСК №1.
- Аннотация
- Статья
- Ссылки
В статье приведены результаты экспериментальных и клинических исследований, подтверждающие высокую эффективность и безопасность использования препарата Актовегин, обладающего антиоксидантным, антигипоксантным, нейропротективным, комплексным метаболическим действием, в патогенетической терапии сосудистых и нейропатических осложнений сахарного диабета.
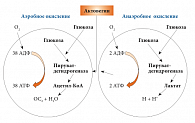
Рис. 1. Механизм действия Актовегина на процессы внутриклеточного метаболизма
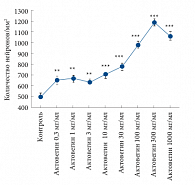
Рис. 2а. Изменение числа нейронов (зафиксировано с помощью окрашивания ядер) в зависимости от концентрации Актовегина по сравнению с контрольной культурой (без Актовегина)
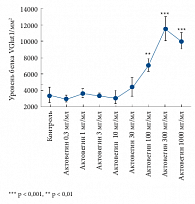
Рис. 2б. Изменение числа синапсов, сопряженное с увеличением уровня маркера VGlut1, в зависимости от концентрации Актовегина по сравнению с контрольной культурой клеток (без Актовегина)
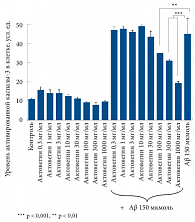
Рис. 2в. Развитие апоптоза на основании измерения уровня каспазы-3 в культурах нейронов крыс в зависимости от концентрации Актовегина и после добавления пептида Аβ25–35 концентрации 150 мкмоль, индуцирующего апоптоз, по сравнению с контрольной культурой к
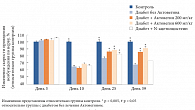
Рис. 3а. Изменение скорости проведения возбуждения по нерву в различных группах крыс в 3, 10, 25, 39-й дни после индуцирования стрептоцидом
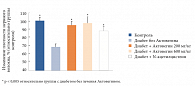
Рис. 3б. Изменение плотности нервного волокна в различных экспериментальных группах

Рис. 3в. Определение количества PARP в различных группах исследования
К основным причинам развития поздних осложнений СД относятся нарушения внутриклеточного метаболизма, а также оксидативный стресс, что предполагает использование в качестве патогенетической терапии препаратов, обладающих антиоксидантными свойствами [1, 2, 3]. Среди известных и активно применяемых препаратов с мощным антиоксидантным и нейропротективным действием особого внимания заслуживает Актовегин.
Актовегин представляет собой депротеинизированный гемодиализат, полученный из крови телят методом ультрафильтрации, с содержанием низкомолекулярных веществ с массой ниже 5000 Да [4, 5, 6]. Препарат содержит олигопептиды, аминокислоты, нуклеозиды, продукты углеводного и жирового обмена, микроэлементы и электролиты (Na, K, P, Mg, Si, Ca, Cu).
Актовегин оказывает влияние на различные процессы в клетке: препарат активирует ферменты окислительного фосфорилирования; повышает активность щелочной фосфатазы, кислой фосфатазы и лизосомальную активность; ускоряет синтез углеводов, белков; увеличивает приток ионов калия в клетку; стимулирует распад продуктов анаэробного гликолиза; улучшает аэробный энергообмен; высвобождает простациклин и NO [5, 7, 8, 9].
Обладая высокой активностью в отношении клеточного метаболизма, препарат ускоряет захват и потребление глюкозы, а также способствует повышению доступности креатинфосфокиназы и аденозинтрифосфата (АТФ) – важных макроэргических соединений (рис. 1).
В нескольких экспериментальных исследованиях было показано: Актовегин характеризуется инсулиноподобным действием. Обнаружено, что после внутривенного введения препарата у крыс активизируется захват глюкозы клетками [5, 9, 10, 11]. Было также установлено, что Актовегин содержит особые вещества – инозитолфосфоолигосахариды (ИФО), участвующие в переносе глюкозы в клетки независимо от инсулина. В результате происходит повышение утилизации глюкозы, напрямую влияющее на ее метаболизм и баланс энергии в клетках [11, 12, 13, 14].
Особый интерес представляет способность Актовегина влиять на поступление энергии в клетку. Препарат активирует внутриклеточные окислительные процессы и ускоряет энергетический и резервный метаболизм, что сопровождается накоплением гликогена и калия в сердце и печени [11, 15, 16, 17].
Этот факт нашел подтверждение в двойном слепом многоцентровом плацебоконтролируемом клиническом исследовании с участием больных СД 2 типа с диабетической полинейропатией. Через 24 недели терапии Актовегином наблюдалось уменьшение нарушений чувствительности, улучшение скорости проведения нервного импульса, снижение порога вибрационной чувствительности по сравнению с группой плацебо [10, 18].
Нейропротективный эффект Актовегина был продемонстрирован в исследовании, проведенном под руководством M. Elmlinger. Оценивалось влияние препарата на первичную культуру нейронов крыс со стрептоцидиндуцированным диабетом [10, 11]. Первичные нейроны культивировали в течение 10 дней в присутствии возрастающих доз Актовегина (0,3–1000 мг/мл). Под влиянием Актовегина наблюдалось увеличение числа нейронов, синаптических связей между нервными клетками (выделение белка VGlut1, использующегося для маркировки синапсов), ингибирование процесса апоптоза путем влияния на активность фермента каспазы-3, а также снижение уровня свободных радикалов (рис. 2 а, б, в).
В другом экспериментальном исследовании изучалось нейропротективное действие Актовегина на модели животных со стрептоцидиндуцированным СД и диабетической нейропатией с определением скорости проведения нервного импульса и плотности нервного волокна [13].
Животные с признаками диабетической полинейропатии были разделены на группы, получавшие Актовегин в дозе 200 мг/кг, 600 мг/кг или N-ацетилцистеин (в дозе 0,2 г/л в составе питьевой воды со 2-го по 40-й день исследования). Оценивались скорость проведения возбуждения по нерву, внутриэпидермальная плотность нервного волокна, уровень фермента поли(АДФ-рибоза)-полимеразы (PARP) [13].
Скорость проведения возбуждения по нерву у всех исследуемых животных с СД была снижена на 35% по сравнению со здоровыми животными. Применение Актовегина позволяло максимально сохранить скорость проведения возбуждения по нервным волокнам по сравнению с группой, не получавшей Актовегин (рис. 3а).
В группе животных с диабетом без терапии Актовегином отмечалось снижение внутриэпидермальной плотности нервного волокна по сравнению со здоровыми животными. Лечение Актовегином в значительной степени затормозило снижение плотности нервного волокна в группах, получавших 200 мг/кг и 600 мг/кг препарата (рис. 3б).
Один из важных механизмов развития оксидативного стресса связан с влиянием ядерного фермента PARP [13, 19]. Активация этого фермента сопряжена с множеством реакций, вызывающих снижение кровоснабжения нерва, скорости проведения нервного возбуждения, уменьшение плотности нервного волокна и нейропатическую боль [19, 20]. Актовегин способствовал ингибированию PARP, особенно в дозе 600 мг/кг (рис. 3в), препятствовал потере плотности нервного волокна и улучшал скорость проведения импульса [13]. Таким образом, исследование продемонстрировало способность Актовегина уменьшать проявления диабетической полинейропатии через предотвращение активации PARP.
В масштабном многоцентровом рандомизированном двойном слепом исследовании, включавшем 567 пациентов c СД 2 типа с диабетической полинейропатией, изучались безопасность, эффективность и патогенетическая обоснованность применения Актовегина. В исследовании принимали участие 26 исследовательских центров, работа которых координировалась Институтом клинической диабетологии Немецкого диабетологического центра Университета им. Генриха Гейне (Institute for Clinical Diabetology, German Diabetes Center at the Heinrich Heine University; Дюссельдорф, Германия) (под руководством профессора D. Ziegler) [4, 9, 10, 18].
Пациенты получали Актовегин сначала внутривенно по 2000 мг/сут в течение 20 дней, в дальнейшем – перорально в дозе 1800 мг/сут (по 1 таблетке 3 раза в сутки) в течение 140 дней.
Критериями эффективности служили шкала оценки симптомов (Total Symptom Score, TSS) и порог вибрационной чувствительности (Vibration Perception Threshold, VPT). Кроме того, использовали комбинированную шкалу нейропатических повреждений для нижних конечностей (Neuropathy Impairment Score of the Lower Limb, NISS-LL) и шкалу качества жизни (SF-36). Основными результатами исследования явились снижение нейропатической симптоматики по шкале TSS (уменьшение общей суммы баллов); статистически достоверное уменьшение баллов по отдельным симптомам полинейропатии (боль, жжение); достоверная положительная динамика спонтанных сенсорных ощущений; достоверное уменьшение неврологического дефицита (по шкале NISS-LL – улучшение различных видов чувствительности, коленных и ахилловых рефлексов, силы мышц ног); достоверное снижение порогов вибрационной чувствительности при исследовании на биотензиометре. В исследовании также была отмечена хорошая переносимость терапии Актовегином (сравнение производилось относительно группы плацебо) [4, 18].
Целесообразность и эффективность применения Актовегина у больных с нейроишемическим болевым синдромом при периферической ангиопатии всегда вызывали повышенный интерес среди клиницистов. Командой исследователей под руководством И.В. Гурьевой было проведено открытое сравнительное исследование, продемонстрировавшее достоверное увеличение функциональной способности к ходьбе у больных СД с перемежающейся хромотой [4, 10]. Пациенты получали Актовегин внутривенно в дозе 2000 мг/сут в течение 2 недель с последующим переходом на пероральный прием препарата в дозе 1200 мг в день в течение 6 недель. Результаты исследования показали увеличение времени ходьбы до появления болевых ощущений при прохождении тредмил-теста по протоколу Gardner, а также достоверное улучшение состояния периферических нервов и скорости проведения возбуждения [4, 10, 18].
Влияние Актовегина на проявления диабетической полинейропатии и макроангиопатии изучалось также на базе эндокринологического отделения ЦКБ № 2 им. Н.А. Семашко. Т.А. Мелешкевич и соавт. обследовали пациентов с СД 1 и 2 типов с нейроишемическими поражениями нижних конечностей, получавших курс лечения Актовегином 1000 мг/сут внутривенно в течение 10 дней с последующим пероральным приемом в течение 6 недель в дозе 1800 мг/сут в 3 приема. В результате нейропротективной терапии выраженность симптомов диабетической полинейропатии статистически достоверно снизилась к концу исследования (с 7,66 ± 2,32 до
4,32 ± 1,66; p < 0,005 по шкале TSS). Пороги всех видов чувствительности также достоверно снизились по сравнению с исходным уровнем (с 15,5 ± 5,0 до 12,0 ± 4,0; p < 0,05) [19]. Плече-лодыжечный индекс (ПЛИ) достоверно увеличился с
0,9 ± 3,0 до 0,7 ± 3,0 к концу исследования. Было показано, что терапия Актовегином повышает качество жизни пациентов с СД, а также безопасно и эффективно уменьшает выраженность нейропатических симптомов и достоверно снижает порог сенсорной чувствительности, улучшает кровоток в артериях нижних конечностей, значительно снижая риск развития язвенных поражений стоп [18].
Обладая множеством уникальных эффектов, Актовегин зарекомендовал себя в качестве мощного антигипоксанта, антиоксиданта и метаболического средства, являясь препаратом выбора у пациентов с микро- и макрососудистыми осложнениями СД, с диабетической полинейропатией, синдромом диабетической стопы, нуждающихся в эффективной нейропротекции.
Приведенные данные экспериментальных и клинических исследований подтверждают целесообразность использования Актовегина в патогенетической терапии сосудистых осложнений и поражения нервной системы при СД. Однако необходимы дальнейшие исследования для детального изучения универсальных эффектов препарата и возможных точек их приложения, например, механизма ингибирования активации PARP.
1. Boulton A.J., Vinik A.I., Arezzo J.C., Bril V., Feldman E.L., Free- man R., Malik R.A., Maser R.E., Sosenko J.M., Ziegler D.; Ameri- can Diabetes Association. Diabetic neuropathies: a statement by the American Diabetes Association // Diabetes Care. 2005. Vol. 28. No 4. P. 956–962.
2. Cameron N.E., Eaton S.E., Cotter M.A., Tesfaye S. Vascular factors and metabolic interactions in the pathogenesis of diabetic neuropathy // Diabetologia. 2001. Vol. 44. No 11. P. 1973–1988.
3. Ziegler D. Current concepts in the management of diabet- ic polyneuropathy // Curr. Diabetes Rev. 2011. Vol. 7. No 3. P. 208–220.
4. Гурьева И.В., Дымочка М.А., Аметов А.С. От диабетической периферической нейропатии до диабетической стопы. Применение Актовегина в патогенетическом лечении // Вестник Всероссийского общества специалистов по медико-социальной экспертизе, реабилитации и реабилитационной индустрии. 2010. No 2. С. 7–13.
5. Buchmayer F., Pleiner J., Elmlinger M.W., Lauer G., Nell G., Sitte H.H. Actovegin®: a biological drug for more than 5 decades // Wien Med. Wochenschr. 2011. Vol. 161. No 3–4. P. 80–88.
6. Cameron N.E., Cotter M.A., Horrobin D.H., Tritschler H.J. Effects of alpha-lipoic acid on neurovascular function in diabetic rats: interaction with essential fatty acids // Diabetologia. 1998. Vol. 41. No 4. P. 390–399.
7. Bordet T., Buisson B., Michaud M., Abitbol J.L., Marchand F., Grist J., Andriambeloson E., Malcangio M., Pruss R.M. Specific antinocicep- tive activity of cholest-4-en-3-one, oxime (TRO19622) in experimental models of painful diabetic and chemotherapy-induced neuropathy // J. Pharmacol. Exp. Ther. 2008. Vol. 326. No 2. P. 623–632.
8. Kanowski S., Kinzler E., Lehmann E., Schweizer A., Kuntz G. Confirmed clinical efficacy of Actovegin in elderly patients with organic brain syn- drome // Pharmacopsychiatry. 1995. Vol. 28. No 4. P. 125–133.
9. Ziegler D., Movsesyan L., Mankovsky B., Gurieva I., Abylaiuly Z., Strokov I. Treatment of symptomatic polyneuropathy with Аctovegin in type 2 diabetic patients // Diabetes Care. 2009. Vol. 32. No 8. P. 1479–1484.
10. Гурьева И.В., Кузина И.В., Бегма И.В. диабетическая сенсомоторная нейропатия и диабетическая стопа: новые данные о лечении Актовегином // Эффективная фармакотерапия в эндокринологии. 2010. No 2. C. 6–9.
11. Elmlinger M.W., Kriebel M., Ziegler D. Neuroprotective and anti-oxida- tive effects of the hemodialysate actovegin on primary rat neurons in vitro // Neuromolecular Med. 2011. Vol. 13. No 4. P. 266–274.
12. Cameron N.E., Eaton S.E., Cotter M.A., Tesfaye S. Vascular factors and metabolic interactions in the pathogenesis of diabetic neuropathy // Diabetologia. 2001. Vol. 44. No 11. P. 1973–1988.
13. Dieckmann A., Kriebel M., Andriambeloson E., Ziegler D., Elmlinger M. Treatment with Actovegin® improves sensory nerve function and pa- thology in streptozotocin-diabetic rats via mechanisms involving in- hibition of PARP activation // Exp. Clin. Endocrinol. Diabetes. 2012. Vol. 120. No 3. P. 132–138.
14. Ziegler D., Siekierka-Kleiser E., Meyer B., Schweers M. Validation of a novel screening device (NeuroQuick) for quantitative assessment of small nerve fiber dysfunction as an early feature of diabetic polyneu- ropathy // Diabetes Care. 2005. Vol. 28. No 5. P. 1169–1174.
15. Beiswenger K.K., Calcutt N.A., Mizisin A.P. Dissociation of thermal hy- poalgesia and epidermal denervation in streptozotocin-diabetic mice // Neurosci. Lett. 2008. Vol. 442. No 3. P. 267–272.
16. Jacob S., Dietze G.J., Machicao F., Kuntz G., Augustin H.J. Improvement of glucose metabolism in patients with type II diabetes after treatment with a hemodialysate // Arzneimittelforschung. 1996. Vol. 46. No 3. P. 269–272.
17. Klementiev B., Novikova T., Novitskaya V., Walmod P.S., Dmytriyeva O., Pakkenberg B., Berezin V., Bock E. A neural cell adhesion molecule- derived peptide reduces neuropathological signs and cognitive impair- ment induced by Abeta25-35 // Neuroscience. 2007. Vol. 145. No 1. P. 209–224.
18. Мелешкевич Т.А., Лучина Е.И., Лукашова М.Е. двойной эффект Актовегина в лечении поздних осложнений диабета // РМЖ. 2011. Т. 9. No 13. С. 858–600.
19. Ilnytska O., Lyzogubov V.V., Stevens M.J., Drel V.R., Mashtalir N., Pacher P., Yorek M.A., Obrosova I.G. Poly(ADP-ribose) polymerase inhibition alleviates experimental diabetic sensory neuropathy // Diabetes. 2006. Vol. 55. No 6. P. 1686–1694.
20. Obrosova I.G., Xu W., Lyzogubov V.V., Ilnytska O., Mashtalir N., Vareniuk I., Pavlov I.A., Zhang J., Slusher B., Drel V.R. PARP inhibi- tion or gene deficiency counteracts intraepidermal nerve fiber loss and neuropathic pain in advanced diabetic neuropathy // Free Radic. Biol. Med. 2008. Vol. 44. No 6. P. 972–981.
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


