Актовегин в терапии когнитивных нарушений у пациентов, перенесших новую коронавирусную инфекцию COVID-19 (опыт клинических наблюдений)
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проведен ретроспективный анализ результатов нейропсихологического тестирования по Монреальской шкале оценки когнитивных функций (MoCA) и шкале астенического состояния (ШАС) у пациентов с умеренными когнитивными нарушениями, перенесших COVID-19, до и после применения Актовегина. Длительность терапии Актовегином 200 мг (одна таблетка) три раза в сутки внутрь составила шесть недель. При сравнении результатов нейропсихологического тестирования использовали критерий Манна – Уитни. Корреляционный анализ проводили с помощью критерия Спирмена.
Результаты. Проанализированы данные десяти пациентов (шесть мужчин и четыре женщины). Медиана возраста составила 62,5 [59,5; 64,8] года. По шкале МоСА выявлено увеличение балла после терапии Актовегином (p < 0,05): 24 [23; 24] балла – до терапии, 26 [25; 26] баллов – после терапии. Отмечено уменьшение числа пациентов с баллом менее 26: 10 (100%) – до лечения, 4 (40%) – после лечения. По шкале ШАС зафиксировано снижение выраженности астении после терапии Актовегином (p < 0,05): 80,5 [78; 86,5] – до терапии, 74,5 [74; 82,3] – после терапии. Число пациентов с умеренной астенией уменьшилось: 10 (100%) – до лечения, 3 (30%) – после лечения. Корреляционных связей между результатами по шкалам не обнаружено.
Заключение. Выявленная на фоне терапии Актовегином тенденция к уменьшению выраженности когнитивных нарушений и астении у пациентов после СOVID-19 подтверждает целесообразность дальнейшего изучения данного вопроса. Необходимы разработка и проведение исследований влияния Актовегина на нарушенные после COVID-19 когнитивные функции и астенический синдром.
Материал и методы. Проведен ретроспективный анализ результатов нейропсихологического тестирования по Монреальской шкале оценки когнитивных функций (MoCA) и шкале астенического состояния (ШАС) у пациентов с умеренными когнитивными нарушениями, перенесших COVID-19, до и после применения Актовегина. Длительность терапии Актовегином 200 мг (одна таблетка) три раза в сутки внутрь составила шесть недель. При сравнении результатов нейропсихологического тестирования использовали критерий Манна – Уитни. Корреляционный анализ проводили с помощью критерия Спирмена.
Результаты. Проанализированы данные десяти пациентов (шесть мужчин и четыре женщины). Медиана возраста составила 62,5 [59,5; 64,8] года. По шкале МоСА выявлено увеличение балла после терапии Актовегином (p < 0,05): 24 [23; 24] балла – до терапии, 26 [25; 26] баллов – после терапии. Отмечено уменьшение числа пациентов с баллом менее 26: 10 (100%) – до лечения, 4 (40%) – после лечения. По шкале ШАС зафиксировано снижение выраженности астении после терапии Актовегином (p < 0,05): 80,5 [78; 86,5] – до терапии, 74,5 [74; 82,3] – после терапии. Число пациентов с умеренной астенией уменьшилось: 10 (100%) – до лечения, 3 (30%) – после лечения. Корреляционных связей между результатами по шкалам не обнаружено.
Заключение. Выявленная на фоне терапии Актовегином тенденция к уменьшению выраженности когнитивных нарушений и астении у пациентов после СOVID-19 подтверждает целесообразность дальнейшего изучения данного вопроса. Необходимы разработка и проведение исследований влияния Актовегина на нарушенные после COVID-19 когнитивные функции и астенический синдром.
Введение
Вирус SARS-CоV-2 может быть причиной поражения центральной нервной системы и развития синдрома энцефалопатии [1–3], одним из ведущих проявлений которого считаются когнитивные нарушения. С точки зрения патогенеза неврологические нарушения при COVID-19 могут быть обусловлены «цитокиновым штормом», гипоксемией, нарушением микроциркуляции, расстройствами гомеостаза, нейротропностью и нейровирулентностью SARS-CoV-2, а также комбинированным воздействием перечисленных факторов [1, 4]. К наиболее распространенным подтипам энцефалопатии при COVID-19 относятся гипоксически-ишемический и ишемический/гипоперфузионный [1].
По данным E. Gulko и соавт., у 78 (72,8%) из 107 пациентов, перенесших инфекцию, вызванную SARS-CoV-2, на магнитно-резонансной томограмме головного мозга выявлялся «сосудистый» паттерн изменений без клинических проявлений инсульта [5].
Когнитивные нарушения (КН) у пациентов с COVID-19 способны не только развиваться впервые на фоне инфекции [6], но и усугубляться вследствие дыхательной недостаточности и гипоперфузионных нарушений [7]. Их выраженность различна, но вероятность развития увеличивается на фоне поражения легких [3], артериальной гипертензии, ишемической болезни сердца и сахарного диабета [3, 8]. Когнитивные нарушения могут развиваться и при легком течении COVID-19 [9]. У ряда больных они носят нейродинамический характер и входят в состав «постковидного» синдрома, включая нарушения памяти и трудности с концентрацией внимания [10]. При этом спектр встречаемых расстройств когнитивных функций гетерогенен и затрагивает нарушения памяти (особенно оперативной), внимания, расстройства фонетической и семантической активности речи, регуляторных функций.
Для пациентов с COVID-19 наиболее характерен лобно-подкорковый подтип КН [6]. В качестве ведущей причины их развития рассматривается церебральная гипоперфузия [10]. Значение также имеют патогенетические механизмы, особенно активно реализующиеся в остром периоде COVID-19, такие как повреждение гематоэнцефалического барьера и нарушение микроциркуляции, общая гипоксия вследствие дыхательной недостаточности, остаточные явления которых наблюдаются и после выздоровления [11]. Определенную роль в развитии когнитивных расстройств играет эндотелиальная дисфункция, вызываемая SARS-CoV-2 [12]. Пациенты, у которых в остром периоде COVID-19 происходит цереброваскулярное событие или развиваются КН, нуждаются в динамическом наблюдении вследствие риска их развития и прогрессирования после выздоровления [12]. Нередко расстройства когнитивных функций полностью регрессируют на фоне терапии основного заболевания в остром периоде [7], но могут носить стойкий характер [12] и требовать симптоматического лечения, поскольку влияют на повседневную жизнедеятельность.
В структуру «постковидного» синдрома входит также астения, ощущение затуманенности [10]. По данным литературы, частота встречаемости астенического синдрома после перенесенной инфекции колеблется от 16,7% [9] до 52,3% [13]. Как известно, астенический синдром, для лечения которого предлагаются несколько групп нейропротекторов с разным механизмом действия, способен существенно влиять и на когнитивные функции [14].
Одним из препаратов для лечения КН является Актовегин, согласно инструкции по его применению [15]. Он характеризуется полимодальным механизмом действия (антигипоксическим, нейропротективным, ангиопротективным) [16–18], улучшает реологические свойства крови [19]. Это позволяет говорить о его потенциальной эффективности в коррекции КН вследствие перенесенной гипоксии/ишемии и сохраняющейся гипоперфузии после острого периода COVID-19. Интересной представляется оценка влияния Актовегина на астенический синдром у этой группы пациентов с учетом имеющихся научных данных о его способности уменьшать астению у больных хронической ишемией головного мозга [19].
Цель работы – проанализировать собственный опыт применения Актовегина в амбулаторных условиях в лечении когнитивных нарушений у пациентов с перенесенной новой коронавирусной инфекцией.
Материал и методы
Исследование носило ретроспективный характер. Критериями включения в исследование были:
- наличие синдрома КН, объективно подтвержденного результатами нейропсихологического обследования после COVID-19, и отсутствие в них очевидных указаний до инфекции;
- проведение пациентом полного шестинедельного курса терапии Актовегином в таблетках;
- наличие у пациента объективных данных нейропсихологического обследования после курса терапии Актовегином.
С целью оценки когнитивных расстройств пациентам с жалобами на расстройства памяти, внимания, повышенную утомляемость и сниженную работоспособность проводилось нейропсихологическое тестирование по Монреальской шкале оценки когнитивных функций (MoCA). В анализ включались пациенты с баллом по MoCA менее 26. Наличие и степень выраженности астении определялись по шкале астенического состояния (ШАС) (шкала Л.Д. Малковой, адаптированная Т.Г. Чертовой): 30–50 баллов – отсутствие астении; 51–75 баллов – слабая астения; 76–100 баллов – умеренная; 101–120 баллов – выраженная астения. Оценка по шкалам MoCA и ШАС проводилась дважды (до и после терапии Актовегином). Актовегин назначали по показанию «симптоматическое лечение когнитивных нарушений». Курс терапии на амбулаторном этапе после проведенного основного лечения по поводу COVID-19 состоял в назначении таблеток Актовегина 200 мг три раза в сутки внутрь в течение шести недель. Данные представлены с использованием методов описательной статистики: категориальные показатели – в виде абсолютных значений и в процентном соотношении; для описания выборок применяли медиану и квартили (Me [25-й; 75-й перцентили]). Различия количественных параметров между исследуемыми группами выявляли с помощью критерия Манна – Уитни. При проведении корреляционного анализа использовали критерий Спирмена. Уровень статистической значимости для всех тестов принимался при p < 0,05.
Результаты и обсуждение
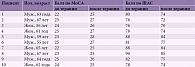
В анализ были включены данные десяти пациентов (6 (60%) мужчин и 4 (40%) женщины). Медиана возраста составила 62,5 [59,5; 64,8] года. Пациенты перенесли новую коронавирусную инфекцию COVID-19 средней степени тяжести [20]. У всех больных зафиксировано как минимум одно сердечно-сосудистое заболевание. Девять (90%) из десяти больных имели в анамнезе гипертоническую болезнь, 5 (50%) – ишемическую болезнь сердца, 4 (40%) – признаки атеросклероза церебральных артерий. По степени выраженности расстройства когнитивных функций соответствовали критериям умеренных КН у всех десяти пациентов при первичном обследовании [21]. Результаты проведенного нейропсихологического тестирования по MoCA и ШАС до и после терапии Актовегином представлены в таблице.
Показатель по MoCA у пациентов до терапии Актовегином составил 24 [23; 24] балла, после терапии – 26 [25; 26] баллов. При сравнении показателей по МоСА выявлено статистически значимое увеличение балла после терапии Актовегином (критерий Манна – Уитни, p < 0,05). После лечения только у 4 (40%) из десяти больных балл был менее 26. До терапии соответствующий показатель составлял 100%.
Показатель по ШАС до терапии составил 80,5 [78; 86,5] балла, после терапии – 74,5 [74; 82,3] балла. При сравнении показателей по ШАС выявлено их статистически значимое снижение после применения Актовегина (критерий Манна – Уитни, p < 0,05). При интерпретации результатов все десять пациентов до лечения по ШАС имели астению умеренной выраженности (76–100 баллов). После терапии только у 3 (30%) пациентов сохранялась умеренная астения по ШАС. У 7 (70%) из десяти пациентов показатели по ШАС варьировались от 51 до 76 баллов, что соответствовало слабой степени астении.
При проведении анализа по Спирмену статистически значимых корреляционных связей между показателями по MoCA и ШАС как до терапии Актовегином, так и после нее не зафиксировано. Коэффициент корреляции при оценке показателей до терапии составил -0,382 (умеренная обратная связь, p > 0,05), после лечения – -0,045 (слабая обратная связь, p > 0,05).
На фоне терапии Актовегином в группе пациентов с умеренными КН после перенесенной новой коронавирусной инфекции COVID-19 отмечалось как статистически значимое увеличение балла по MoCA, так и уменьшение числа пациентов с баллом по шкале MoCA менее 26 на 60%.
Способность препарата улучшать когнитивные функции хорошо известна и описана в научной литературе [16, 22]. Основные механизмы, вызывающие энцефалопатию при COVID-19, включают церебральную гипоперфузию, общую гипоксию, эндотелиальную дисфункцию [23]. Мультимодальный (ангипоксантный [24, 25], ангиопротективный [26], нейропротективный [24, 25]) механизм действия препарата Актовегин, а также его способность улучшать реологические свойства крови [19] позволяют воздействовать на большинство потенциальных звеньев патогенеза КН у пациентов с перенесенной инфекцией COVID-19, развивающихся в рамках гипоксически-ишемической или ишемической/гипоперфузионной энцефалопатии.
После терапии Актовегином выявлены статистически значимое снижение показателя по ШАС, уменьшение числа пациентов с умеренной астенией на 70% после шестинедельного курса лечения. С учетом значимости астенического синдрома в клинической картине у пациентов после COVID-19 [9, 13], а также предполагаемых гипоперфузионных механизмов в его развитии у данной категории больных [10] можно говорить о перспективах применения Актовегина в лечении «постковидного» астенического синдрома. К тому же препарат продемонстрировал эффективность в отношении астенического синдрома у пациентов с хронической недостаточностью мозгового кровообращения [19].
Улучшение показателей по МоСA и ШАС, с одной стороны, и отсутствие статистически значимых корреляционных связей, с другой, не позволяют сделать однозначные выводы о степени влияния собственно астении на выраженность КН у пациентов с перенесенной инфекцией COVID-19. Тем не менее данные научной литературы [14] о влиянии астении на когнитивные функции подтверждают актуальность изучения данного вопроса у названной категории пациентов, особенно если учитывать, что астенический синдром после перенесенной инфекции COVID-19 может носить длительный персистирующий характер, а его выраженность не всегда связана с тяжестью перенесенной инфекции [13].
Заключение
Результаты ретроспективного анализа данных и маленькая выборка пациентов не позволяют делать какие-либо однозначные выводы. Однако выявленная на фоне терапии Актовегином тенденция к уменьшению выраженности когнитивных нарушений по MoCA и астении по ШАС у пациентов после перенесенной новой коронавирусной инфекции, а также вероятные механизмы их развития, полимодальность действия препарата, патогенетически обусловленная возможность его применения в подобных ситуациях подтверждают актуальность дальнейшего изучения данного вопроса. Целесообразно проведение крупных многоцентровых сравнительных исследований на больших популяциях пациентов с предварительно разработанным дизайном. Перспективным представляется применение Актовегина при правильно проведенном терапевтическом курсе при астеническом синдроме, который у пациентов после перенесенной инфекции COVID-19 может быть длительным [13], существенно нарушать и ограничивать жизнедеятельность.
V.S. Krasnov, PhD
Academician I.P. Pavlov First St. Petersburg State Medical University
Contact person: Vladimir S. Krasnov, krasnov_volod@mail.ru
Purpose – to analyze own experience of using Actovegin in the treatment of cognitive impairment in patients after COVID-19.
Material and methods. A retrospective analysis of the neuropsychological testing results according to Montreal Cognitive Assessment (MoCA) and Asthenic scale in patients with moderate cognitive impairment after COVID-19 was carried out before and after therapy by Actovegin. The duration of therapy was 6 weeks at a dose of 200 mg (1 tablet) 3 times a day by mouth. The Mann-Whitney test was used for comparing the results of neuropsychological testing. Spearman's test was used for correlation analysis.
Results. The data of 10 patients (6 men and 4 women) were analyzed. The age was 62.5 [59.5; 64.8] years. The increase in the score according to the MoCA scale was revealed after therapy by Actovegin (p <0.05): 24 [23; 24] points – before therapy, 26 [25; 26] points – after therapy. The decrease in the number of patients with a score of less than 26 was found: 10 (100%) – before treatment, 4 (40%) – after treatment. The decrease in the severity of asthenia according to Asthenic scale was revealed after therapy by Actovegin (p <0.05): 80.5 [78; 86.5] – before therapy, 74.5 [74; 82.3] – after therapy. The decrease in the number of patients with moderate asthenia was found: 10 (100%) – before treatment, 3 (30%) – after treatment. No correlations were found between the results on the above scales.
Conclusions. The revealed trends to decrease in the severity of cognitive impairment and asthenia in patients after COVID-19 after therapy by Actovegin allow to recommend further study of this issue. It is advisable to develop and conduct further studies to study the effect of Actovegin both on impaired cognitive functions after COVID-19 and on asthenic syndrome.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.