Влияние состава микробиоты кишечника на риск развития неврологического дефицита вследствие острого нарушения мозгового кровообращения у пациентов с ожирением
- Аннотация
- Статья
- Ссылки
- English
Цель – проанализировать состав микробиоты толстого кишечника у пациентов с ожирением и установить зависимость прогрессирования клинического течения неврологических заболеваний от состава микробиоты кишечника и такого фактора риска, как ожирение.
Материал и методы. Проведен сравнительный анализ клинических данных, результатов общеклинических лабораторных исследований. Пациенты были разделены на четыре группы. Первую группу составили 13 пациентов с ОНМК средней степени тяжести (NIHSS – 5–15 баллов) и 1-й степенью ожирения (ИМТ – 30–34,9 кг/м2), вторую – 13 пациентов без ОНМК в анамнезе и с 1-й степенью ожирения (ИМТ – 30–34,9 кг/м2), третью – 13 пациентов с ОНМК средней степени тяжести (NIHSS – 5–15 баллов) и 2-й степенью ожирения (ИМТ – 35–39,9 кг/м2), четвертую – 13 пациентов без ОНМК в анамнезе и с 2-й степенью ожирения (ИМТ – 35–39,9 кг/м2). У каждого участника исследования проводили сбор анамнеза. Кроме того, выполняли анализ кала методом генетического секвенирования 16S-рибосомальной РНК для установления состава микробиоты кишечника.
Результаты. В результате анализа состояния и состава микробиоты у пациентов с ОНМК по сравнению с пациентами без ОНМК была выявлена разница в количественном составе микроорганизмов толстого кишечника, которая соотносится со степенью неврологических проявлений и степенью ожирения. Различия обнаружены в содержании Clostridium saudiense (8 КОЕ/г в первой группе и 4,9 КОЕ/г – во второй) и Catenibacterium mitsuokai (-5,6 КОЕ/г в первой группе и -5,8 КОЕ/г – во второй).
Выводы. Установлено, что у пациентов с ОНМК количественное представительство таких микроорганизмов, как C. saudiense и C. mitsuokai, существенно отличается от такового у пациентов контрольных групп, что говорит о прямой зависимости прогрессирования неврологического дефицита от состава микробиома человека.
Цель – проанализировать состав микробиоты толстого кишечника у пациентов с ожирением и установить зависимость прогрессирования клинического течения неврологических заболеваний от состава микробиоты кишечника и такого фактора риска, как ожирение.
Материал и методы. Проведен сравнительный анализ клинических данных, результатов общеклинических лабораторных исследований. Пациенты были разделены на четыре группы. Первую группу составили 13 пациентов с ОНМК средней степени тяжести (NIHSS – 5–15 баллов) и 1-й степенью ожирения (ИМТ – 30–34,9 кг/м2), вторую – 13 пациентов без ОНМК в анамнезе и с 1-й степенью ожирения (ИМТ – 30–34,9 кг/м2), третью – 13 пациентов с ОНМК средней степени тяжести (NIHSS – 5–15 баллов) и 2-й степенью ожирения (ИМТ – 35–39,9 кг/м2), четвертую – 13 пациентов без ОНМК в анамнезе и с 2-й степенью ожирения (ИМТ – 35–39,9 кг/м2). У каждого участника исследования проводили сбор анамнеза. Кроме того, выполняли анализ кала методом генетического секвенирования 16S-рибосомальной РНК для установления состава микробиоты кишечника.
Результаты. В результате анализа состояния и состава микробиоты у пациентов с ОНМК по сравнению с пациентами без ОНМК была выявлена разница в количественном составе микроорганизмов толстого кишечника, которая соотносится со степенью неврологических проявлений и степенью ожирения. Различия обнаружены в содержании Clostridium saudiense (8 КОЕ/г в первой группе и 4,9 КОЕ/г – во второй) и Catenibacterium mitsuokai (-5,6 КОЕ/г в первой группе и -5,8 КОЕ/г – во второй).
Выводы. Установлено, что у пациентов с ОНМК количественное представительство таких микроорганизмов, как C. saudiense и C. mitsuokai, существенно отличается от такового у пациентов контрольных групп, что говорит о прямой зависимости прогрессирования неврологического дефицита от состава микробиома человека.



Введение
В настоящий момент особое внимание уделяется изучению оси «кишечник – мозг». Все чаще объектом исследований становится микробиота кишечника в связи с ее важной ролью в поддержании здоровья и развитии различных заболеваний [1].
Понимание комплексных взаимосвязей между микробиотой кишечника, ожирением и неврологическими осложнениями при остром нарушении мозгового кровообращения (ОНМК) позволит разработать инновационные методы диагностики, профилактики и лечения указанных патологий, улучшить прогноз и качество жизни пациентов [2]. Важно учитывать индивидуальные особенности микробиоты и разрабатывать персонализированные подходы к лечению.
Микробиом человека представляет совокупность бактерий, вирусов, простейших, грибов, населяющих макроорганизм. Самой многочисленной является микробиота – ее населяют около 100 трлн микроорганизмов [2]. Бактерии кишечника участвуют в процессах ферментативного расщепления с выделением большого количества молекул и метаболитов, регулирующих синтез витаминов, короткоцепочечных жирных кислот и функцию центральной нервной системы (ЦНС). Заселение микрофлоры кишечника начинается после родов. При естественном родоразрешении кишечник заселяют преимущественно представители Lactobacillus и Prevotella, при кесаревом сечении – Streptococcus, Corynebacterium, Propionibacterium и Escherichia. Состав кишечной микробиоты меняется с началом кормления, зависит от типа вскармливания [3] и только к третьему году жизни приближается к составу микробиоты взрослого человека.
На протяжении жизни состав кишечной микробиоты под влиянием внешних и внутренних факторов может меняться. Значимые изменения микробиоты кишечника наблюдаются после приема антибактериальных препаратов, воспалительных заболеваний, таких как синдром раздраженного кишечника (СРК), диарейный синдром, болезнь Крона, а также на фоне изменения пищевого рациона и смены климата [4].
В настоящем исследовании изучили состав микробиоты кишечника у пациентов с ожирением. Установлена связь между составом микробиоты и течением и исходом ОНМК. Расширение знаний о микробиоме позволит кардинально изменить подход к диагностике, лечению и реабилитации пациентов с ОНМК.
Цель – проанализировать состояние и состав микробиоты толстого кишечника у пациентов с ожирением с различным течением ОНМК, выявить микроорганизмы, ассоциированные с развитием неврологических нарушений.
Материал и методы
С декабря 2023 г. по декабрь 2024 г. обследовано 100 пациентов с ОНМК, в экстренном порядке обратившихся за медицинской помощью и находившихся на стационарном лечении. Для исследования была сформирована группа пациентов с индексом массы тела (ИМТ) 30–40 кг/м². Всем пациентам с момента госпитализации помимо обязательных исследований назначали генетическое секвенирование кала фрагмента гена 16S рРНК. Данный метод позволяет выявить высокое разнообразие бактерий. Кроме того, исследуемые прошли опрос, который включал в себя такие параметры, как курение, прием алкоголя, наличие стресса, применение лекарственных препаратов на постоянной основе, антибактериальных или противовирусных препаратов, пребиотиков и пробиотиков.
В ходе выполнения исследовательской работы общее число обследованных пациентов составило 52 (26 пациентов с ОНМК, 26 пациентов без ОНМК). Пациентов разделили на четыре группы. Первую группу составили 13 пациентов с ОНМК средней степени тяжести (NIHSS – 5–15 баллов) и 1-й степенью ожирения (ИМТ – 30–34,9 кг/м2), вторую – 13 пациентов без ОНМК в анамнезе и с 1-й степенью ожирения (ИМТ – 30–34,9 кг/м2), третью – 13 пациентов с ОНМК средней степени тяжести (NIHSS – 5–15 баллов) и 2-й степенью ожирения (ИМТ – 35–39,9 кг/м2), четвертую – 13 пациентов без ОНМК в анамнезе и с 2-й степенью ожирения (ИМТ – 35–39,9 кг/м2).
Критериями включения в исследование служили подтвержденный диагноз заболевания со специфическими симптомами, возраст пациентов 51–70 лет, подписанное информированное согласие, одобренное этическим комитетом ФГБОУ ВО «ВГМУ им. Н.Н. Бурденко».
Критерии невключения в исследование: отсутствие подтвержденного диагноза заболевания со специфическими симптомами, возраст пациента младше 51 года и старше 70 лет, отсутствие подписанного информированного согласия, одобренного этическим комитетом ФГБОУ ВО «ВГМУ им. Н.Н. Бурденко».
Всего в исследовании приняли участие 52 пациента, соответствовавших критериям включения и не имевших критериев невключения в исследование.
Результаты
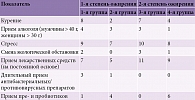
В таблице 1 указаны основные факторы риска, выявленные у участников исследования.
Как видно из таблицы, частота встречаемости курения (53,8%) была выше во второй группе, приема алкоголя (30,7%) – в первой. У пациентов первой и второй групп отмечались одинаковые уровни стресса (69 и 69,2% соответственно) и частоты смены экологической обстановки (23%). В первой группе частота применения лекарственных средств (84,6%) и длительного приема антибактериальных/противовирусных препаратов (30,7%) была выше, а частота приема пребиотиков и пробиотиков – ниже (23%). Результаты опроса отображены на рис. 1. При сравнении полученных данных наблюдались значительные отличия между пациентами с неврологическими нарушениями и симптоматикой ОНМК и пациентами без ОНМК.
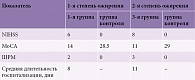
Выполнялось анкетирование с использованием NIHSS, MoCA, шкалы реабилитационной маршрутизации (ШРМ) и оценкой длительности госпитализации. У пациентов, перенесших ОНМК, с 1-й степенью ожирения показатели были лучше, чем у пациентов, перенесших ОНМК, с 2-й степенью ожирения. Когнитивные процессы у пациентов третьей группы были выражены слабее – среднее значение – 11/30 баллов, у пациентов первой группы – 14/30 баллов. Согласно ШРМ, пациенты третьей группы имели умеренное нарушение функционирования и ограничение жизнедеятельности (3 балла), а пациенты первой группы – легкое нарушение функционирования и ограничение жизнедеятельности (2 балла). Средняя длительность госпитализации в первой группе составила восемь дней, в третьей – 11 дней. Результаты опроса и осмотра представлены в табл. 2.
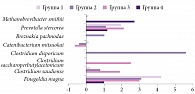
При микробиологическом исследовании методом генетического секвенирования фрагмента гена 16S рРНК были установлены основные представительства микроорганизмов. Установлен средний уровень, позволивший судить об их количестве в толстом кишечнике. Кроме того, показано, что видовой состав кишечной микробиоты зависит от преобладающего типа нарушения кишечной моторики [5]. При СРК с преобладанием диарейного синдрома выявляется снижение представительства Methanobacteriaceae (Methanobrevibacter smithii) [6, 7]. У пациентов с СРК и запором доминируют метаногенные бактерии Prevotella (P. stercorea), способные превращать водород в метан, избыточная продукция которого связана с замедлением транзита через кишечник [8]. На рисунке 2 приведены основные представители микробиоты кишечника, которые не относятся к нормальной микрофлоре, например Bifidobacterium.
На рисунке 3 изображен линейный дискриминантный анализ микробиоты пациентов.
Согласно результатам генетического секвенирования, выявлена значительная разница в содержании таких микроорганизмов, как Clostridium saudiense и Catenibacterium mitsuokai. C. saudiense является комменсальной бактерией, ее энтеротоксин может повреждать слизистую оболочку стенки кишечника и приводить к ее воспалению. Воспаление приводит к деэпителизации ворсинок, повышению проницаемости сосудов и нарушению синтезирующих свойств желудочно-кишечного тракта [9]. Впервые эта бактерия была выделена в Корее у пациента с ожирением. Сообщается также, что циркулирующая в крови C. saudiense ассоциируется также с развитием воспалительных заболеваний [10]. Механизм действия C. mitsuokai и ее влияние на организм человека недостаточно изучены. Тем не менее на основании статистического анализа можно утверждать, что данная бактерия влияет на течение и исход различных заболеваний [11].
С помощью алгоритма Shannon была построена модель выраженности микроорганизмов в кале исследуемых (рис. 4).
Известно, что связь между кишечником и мозгом двусторонняя. Воспалительные процессы в ЦНС, в частности в мозге, воздействуют на микробиоту кишечника, а воспалительные процессы в кишечнике – на ЦНС. Изменение видового состава микроорганизмов может иметь ряд осложнений. Например, дисбиоз кишечника, в том числе вызванный приемом антибактериальных препаратов, существенно повышает риск нарушения функциональной активности иммунных клеток организма, что приводит к тяжелому течению заболевания.
Заключение
Установлено, что дисбиоз кишечника влияет на воспалительные процессы ЦНС. У пациентов, перенесших ОНМК, отмечается прямая зависимость между полученными данными генетического секвенирования и течением заболевания. Коррекция микробиоты кишечника рассматривается как один из методов профилактики и лечения заболеваний нервной системы [12]. На данный момент не существует специфической коррекции микробиоты кишечника. Основными представителями состава пробиотиков являются лактобактерии, бифидобактерии, непатогенные разновидности Escherichia coli и разновидности Enterococcus, молочнокислый стрептококк. Связь оси «кишечник – мозг» показывает, что различные иммунные или воспалительные процессы могут зависеть от метаболитов микроорганизмов, например, толстого кишечника [13].
Такие факторы риска, как курение, прием алкоголя, постоянный стресс, прием лекарственных препаратов и ожирение, нарушают количественный состав микробиоты кишечника, что негативно сказывается как на течении заболевания, так и на жизнедеятельности человека [14]. С возрастом биоразнообразие микробиоты сокращается, начинают преобладать протеобактерии, снижается уровень бифидобактерий. Это может приводить к развитию деменции [15].
Финансирование. Исследование не финансировалось каким-либо источником.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
N.A. Khripushin, G.S. Golosnaya, PhD, Prof., N.A. Ermolenko, PhD, Prof., O.N. Krasnorutskaya, PhD, Assoc. Prof.
N.N. Burdenko Voronezh State Medical University
Contact person: Nikita A. Khripushin, hripushinn@mail.ru
Relevance. Acute cerebrovascular accident is one of the most common severe forms of cerebrovascular diseases, which leads to a significant decrease in the quality of life of patients. Obesity is a risk factor for developing diseases of the circulatory system. The role of the intestinal microbiota in the pathogenesis of systemic inflammatory reactions, metabolic processes, and the impact on the risk of neurological deficit in obese patients is relevant.
Material and methods. A comparative analysis of clinical data and the results of general clinical laboratory studies has been carried out. The patients were divided into four groups. The first group consisted of 13 patients with moderate stroke (NIHSS – 5–15 points) and 1st degree of obesity (BMI – 30–34.9 kg/m2), the second group – 13 patients without a history of stroke and with 1st degree of obesity (BMI – 30–34.9 kg/m2), the third group – 13 patients with moderate grade of stroke (NIHSS – 5–15 points) and grade 2 obesity (BMI – 35–39.9 kg/m2), the fourth group included 13 patients without a history of stroke and with grade 2 obesity (BMI – 35–39.9 kg/m2). Each participant underwent medical history collection and stool analysis using 16S-ribosomal RNA genetic sequencing to determine the composition of the intestinal microbiota.
Results. As a result of the analysis of the state and composition of the microbiota in patients with stroke, compared with groups without stroke, a difference in the quantitative composition of colon microorganisms was revealed, which correlates with the degree of neurological manifestations and the degree of obesity. Differences were found in the content of Clostridium saudiense (8 CFU/g in the first group and 4.9 CFU/g in the second group) and Catenibacterium mitsuokai (-5.6 CFU/g in the first group and -5.8 CFU/g in the second group).
Conclusions. It was found that in patients with stroke, the quantitative representation of microorganisms such as C. saudiense and C. mitsuokai is in an altered value when compared with control groups, which indicates a direct dependence of the progression of neurological deficiency on the composition of the human microbiome.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


