Влияние современной противоопухолевой лекарственной терапии на онкоэпидемиологические показатели при раке предстательной железы в Красноярском крае
- Аннотация
- Статья
- Ссылки
- English
По данным Global Cancer Observatory, в 2022 г. во всем мире зарегистрировано около 1,5 млн новых случаев злокачественных новообразований (ЗНО) предстательной железы, что составляет 7,3% в общей структуре онкологической заболеваемости (четвертое место) и 14,2% в структуре мужской онкологической заболеваемости (второе место после ЗНО трахеи, бронхов и легкого). К 2035 г. прогнозируется рост новых случаев рака предстательной железы (РПЖ) до 2,1 млн. Что касается смертности от РПЖ, то в 2022 г. во всем мире от ЗНО предстательной железы умерли 397,4 тыс. пациентов (восьмое место в общей структуре онкологической смертности и пятое место в структуре онкологической смертности мужского населения). Прогнозируется, что к 2035 г. эта цифра вырастет на 51,8% и достигнет 603,2 тыс. случаев [1].
Высокие значения грубого показателя заболеваемости ЗНО предстательной железы в 2022 г. отмечались в европейский странах: Франция (358,4 на 100 тыс. населения), Швеция (229,0 на 100 тыс. населения), Норвегия (225,0 на 100 тыс. населения), Финляндия (216,3 на 100 тыс. населения). Самые низкие значения показателя отмечаются в странах Азии: Йемен (1,0 на 100 тыс. населения), Бутан (1,2 на 100 тыс. населения), Монголия (1,9 на 100 тыс. населения). Российская Федерация (РФ), по данным GLOBOCAN, в 2022 г. занимала 53-е место по уровню заболеваемости ЗНО предстательной железы [1].
В 2023 г. в РФ впервые выявлено 58 847 случаев ЗНО предстательной железы, рост числа новых случаев за последние пять лет составил 28,6% (2019 г. – 45 763 случая). РПЖ занимает четвертое место (8,7%) в общей структуре онкологической заболеваемости, уступая злокачественным новообразованиям трахеи, бронхов и легкого (8,7%), молочной железы (12,3%) и ЗНО кожи, кроме меланомы (13,6%). В структуре мужской онкологической заболеваемости опухоли предстательной железы занимают лидирующую позицию (19,1%) [2, 3].
Грубый показатель заболеваемости РПЖ на 100 тыс. населения в России составил 86,5, в сравнении с показателем 2022 г. (70,4 на 100 тыс. населения) отмечается рост на 22,9%. Лидирующие позиции по грубому показателю заболеваемости ЗНО предстательной железы отмечаются в Сибирском и Уральском федеральных округах (101,3 и 100,0 на 100 тыс. населения соответственно). Максимальные значения показателя заболеваемости РПЖ среди субъектов РФ отмечаются в Челябинской области (152,9 на 100 тыс. населения), Кировской области (142,2 на 100 тыс. населения), Архангельской области (140,8 на 100 тыс. населения). Что касается заболеваемости ЗНО предстательной железы на территории Красноярского края, то в 2023 г. среди десяти субъектов Сибирского Федерального округа (СФО) регион вышел на четвертое место, уступая показателям заболеваемости Омской области (110,2 на 100 тыс. населения), Алтайского края (116,1 на 100 тыс. населения) и Томской области (139,1 на 100 тыс. населения) [3].
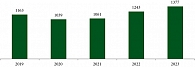
За период 2019–2023 гг. в Красноярском крае зарегистрировано 5883 впервые выявленных случая РПЖ. За анализируемый пятилетний период рост числа впервые выявленных случаев ЗНО предстательной железы составил 18,4%: с 1163 в 2019 г. до 1377 случаев в 2023 г. (рис. 1) [2, 3].
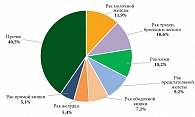
В общей структуре онкологической заболеваемости Красноярского края рак предстательной железы занимает четвертое место (9,2 % от всех случая рака), уступая ЗНО кожи (10,2%), трахеи, бронхов и легкого (10,5%) и молочной железы (11,9%) (рис. 2). В структуре онкологической заболеваемости мужского населения края ЗНО предстательной железы занимает первое место (19,8%).
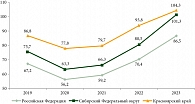
Заболеваемость РПЖ в Красноярском крае в 2023 г. по сравнению с 2019 г. увеличилась на 20,2% (с 86,8 в 2019 г. до 104,3 на 100 тыс. населения в 2023 г.), и на протяжении всего анализируемого периода грубый показатель заболеваемости ЗНО предстательной железы превышал окружные и федеральные значения (рис. 3) [2–6].
Снижение заболеваемости ЗНО предстательной железы в Красноярском крае зарегистрировано в 2020 г. (на 10,4%; с 86,8 в 2019 г. до 77,8 в 2020 г.), что было обусловлено сокращением проведения диспансеризации и плановых амбулаторных приемов вследствие распространения новой коронавирусной инфекции COVID-19 [2–6].
Средний возраст пациентов с ЗНО предстательной железы в РФ за период 2019–2023 гг. увеличился с 69,5 до 69,9 года [2, 3]. Средний возраст заболевших РПЖ в Красноярском крае ниже, чем в РФ, и с 2019 по 2023 г. он увеличился с 69,4 до 69,5 года.
Максимальное число впервые выявленных случаев ЗНО предстательной железы в 2023 г. в РФ регистрируется у мужчин в возрасте 65–69 лет (14 405 случаев – 22,3%) и 70–74 лет (15 126 случаев – 25,4%) [3]. Аналогичная ситуация регистрируется на территории Красноярского края: пик заболевших отмечается среди мужчин в возрасте 65–69 лет (334 случая – 24,3%) и 70–74 лет (338 случаев – 24,5%).
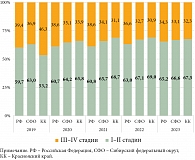
Успешное лечение онкологических заболеваний зависит от стадии выявленного ЗНО, и наиболее благоприятный прогноз имеют ранние стадии заболевания. Показатель выявления рака предстательной железы на I–II стадиях в Красноярском крае на протяжении 2020–2023 гг. превышал аналогичные показатели, зарегистрированные на территории РФ и СФО. За последние пять лет отмечается увеличение доли ЗНО предстательной железы, выявленной на I–II стадиях: в РФ – на 9,2% (с 59,7% до 65,2%), в СФО – на 5,7% (с 63,0% до 66,6%), в Красноярском крае – на 26,9% (с 53,2% до 67,5%). Кроме того, за анализируемый период сохраняется положительная динамика в снижении количества случаев ЗНО предстательной железы, выявленных на поздних стадиях (III–IV): в РФ – на 12,9% (с 39,4% до 34,3%), в СФО – на 10,3% (с 36,9% до 33,1%), в Красноярском крае – на 30,2% (с 46,3% до 32,3%). Кроме того, на протяжении 2020–2023 гг. показатель запущенности в Красноярском крае (КК) был ниже окружных и федеральных, самый низкий краевой показатель отмечался в 2022 г. (30,9%) (рис. 4) [7–11].
На конец 2023 г. в Красноярском крае число больных РПЖ, состоящих на диспансерном учете, составило 7 367 человек, показатель распространенности составил 258,4 на 100 тыс. населения и был выше окружного и федерального показателей (229,3 и 213,8 на 100 тыс. населения соответственно) [11]. Прирост краевого показателя в сравнении с 2019 г. составил 28,4% [7, 11].
Показатель пятилетней выживаемости пациентов с ЗНО предстательной железы в Красноярском крае за период 2019–2023 гг. увеличился на 21,2% (с 39,1% до 47,4%), но в целом остается ниже показателей, зарегистрированных в 2023 г. в РФ – 49,1% и СФО – 47,7% [7, 11].
Показатель одногодичной летальности больных с РПЖ в Красноярском крае в 2023 г. был ниже федерального и окружного (4,9% против 5,8% и 6,6% соответственно). За период 2019–2023 гг. летальность на первом году с момента установления диагноза ЗНО предстательной железы в Красноярском крае снизилась на 5,8% (с 5,2% до 4,9%), в СФО – на 17,5% (с 8,0% до 6,6%), в РФ – на 20,5% (с 7,3% до 5,8%) [7, 11].
В 2023 г. радикальное лечение при ЗНО предстательной железы в РФ получили 20 226 пациентов (35,3% среди всех выявленных РПЖ в 2023 г.), в СФО – 2 618 пациентов (34,6% среди всех выявленных РПЖ в 2023 г.), в Красноярском крае радикальное лечение получили 885 пациентов (64,7% от всех выявленных больных с ЗНО предстательной железы) [11].
Анализ данных о лечении больных с ЗНО предстательной железы свидетельствует о сохранении в РФ и СФО высоких показателей применения хирургического метода как самостоятельного вида лечения пациентов с ЗНО предстательной железы (2019 г. – 50,7% в РФ и 39,5% в СФО; 2023 г. – 49,7% и 45,8% соответственно). В Красноярском крае в 2023 г. наибольший удельный вес имеет комбинированный метод лечения – 58,0% (в 2019 г. – 31,9%). Показатель частоты применения лучевого метода лечения в качестве самостоятельного вида лечения в РФ – 16,0%, в СФО – 17,8%, в Красноярском крае – 4,6%. Химиолучевой метод как самостоятельный вид лечения опухолей предстательной железы применялся в РФ у 4,0% больных, в СФО – у 2,5%, в Красноярском крае – у 7,1% [7, 11].
На сегодняшний день основные достижения в лечении РПЖ связаны с противоопухолевой лекарственной терапией, представленной, в частности, терапией антиандрогенами второй генерации: энзалутамидом, апалутамидом, даролутамидом. Химиотерапия доцетакселом остается стандартом лечения и может быть рекомендована пациентам с допустимыми критериями (функции костного мозга).
Выбор метода лекарственной терапии осуществляется на основании стратификации пациентов по уровню опухолевой нагрузки, согласно критериям CHAARTED и LATITUDE. Критерии CHAARTED определяют большой объем метастатического поражения: 1) наличие висцеральных метастазов, 2) ≥ 4 костных метастазов (хотя бы один метастаз за пределами позвоночника и таза). Критерии LATITUDE определяют высокий риск метастатического гормон-чувствительного рака предстательной железы (мГЧРПЖ): 1) наличие висцеральных метастазов; 2) ≥ 3 костных метастазов любой локализации; 3) сумма баллов по шкале Глисона ≥ 8.
В двух крупных рандомизированных исследованиях (ENZAMET, ARCHES) изучали добавление к андроген-депривационной терапии (АДТ) энзалутамида (160 мг в сутки) у пациентов с мГЧРПЖ. В рандомизированном исследовании третьей фазы ENZAMET сравнивалась терапия энзалутамидом в комбинации с АДТ против монотерапии АДТ у 1125 пациентов с мГЧРПЖ. Пациенты были стратифицированы по объему метастатического поражения, раннему применению доцетаксела, использованию остеомодифицирующих агентов и по количеству баллов по шкале оценки сопутствующей патологии. При первом промежуточном анализе с медианой наблюдения 34 месяца была достигнута первичная цель исследования ENZAMET в виде увеличения общей выживаемости (ОВ) больных мГЧРПЖ в группе раннего назначения энзалутамида в комбинации с АДТ (отношение рисков (ОР) 0,67; 95%-ный доверительный интервал (ДИ): 0,52–0,86; р = 0,002). Все дополнительные цели, такие как выживаемость без прогрессирования (ВБП) с оценкой по уровню ПСА и клиническому прогрессированию, имели положительное значение с преимуществом в группе комбинированной терапии с энзалутамидом. В рандомизированное исследование третьей фазы ARCHES включили 1150 пациентов с мГЧРПЖ вне зависимости от факторов прогноза течения заболевания. Пациентов рандомизировали в соотношении 1 : 1 в группу комбинации АДТ и энзалутамида и в группу АДТ + плацебо. Пациентов стратифицировали по наличию или отсутствию в анамнезе химиотерапии доцетакселом (не было, 1–5 циклов и 6 циклов) и по объему метастатического поражения (большой и малый объемы). При медиане наблюдения 14,4 месяца была достигнута первичная цель исследования ARCHES в виде увеличения ВБП у пациентов с мГЧРПЖ в группе назначения энзалутамида в комбинации с АДТ со снижением риска прогрессирования или смерти на 61% (ОР = 0,39; 95% ДИ: 0,30–0,50; р < 0,001). Профиль безопасности энзалутамида соответствовал полученным ранее данным в исследованиях с участием пациентов с мКРРПЖ. Нежелательные явления, связанные с приемом энзалутамида в данных исследованиях, включали усталость, судороги и гипертензию.
На основании этих данных, энзалутамид в комбинации с АДТ следует рассматривать в качестве стандарта терапии первой линии у пациентов с метастатическим гормон-чувствительным РПЖ [12–13]. Лечение проводят до прогрессии или развития непереносимой токсичности.
STAMPEDE ‒ это многоступенчатое исследование с несколькими группами, в котором референтная группа (кастрационная гормональная монотерапия) включала 1186 пациентов. Одной из экспериментальных групп явилась подгруппа с применением доцетаксела в комбинации с АДТ (n = 593), другой ‒ подгруппа доцетаксела в комбинации с золендроновой кислотой (n = 593). В исследование были включены пациенты либо с M1, либо с N1, либо при наличии двух из следующих трех критериев: T3/4, простатспецифический антиген (ПСА) > 40 нг/мл, либо группа ISUP 4–5. Также были включены пациенты с рецидивами после местного лечения, если они соответствовали одному из следующих критериев: ПСА > 4 нг/мл с временем удвоения ПСА (ВУПСА) < 6 месяцев или ПСА > 2,0 нг/мл, N1 или M1. Относительно объема метастатического поражения (большой/малый объем) стратификация не применялась [14]. Гематологическая токсичность являлась одним из наиболее частых проявлений побочных явлений терапии доцетакселом во всех данных исследованиях. Нейтропения 3–4-й степени наблюдалась у 12–15% пациентов, фебрильная нейтропения 3-й степени – у 6–12%. Применение гранулоцитарного колониестимулирующего фактора (ГКСФ) статистически значимо снижало риск развития фебрильной нейтропении. Первичное и вторичное профилактическое лечение с применением ГКСФ должно осуществляться в соответствии с имеющимися руководствами [15, 16].
На основании этих данных доцетаксел в комбинации с кастрационной АДТ следует рассматривать в качестве стандарта терапии у пациентов с впервые выявленным метастатическим РПЖ, при условии, что они соответствуют критериям приема препарата [15]. Доцетаксел применяют в стандартной дозе 75 мг/м2 в комбинации со стероидами в качестве премедикации. Проведение постоянной терапии глюкокортикостероидами не является обязательным. Всего рекомендуется провести шесть курсов химиотерапии в комбинации с АДТ.
Ниже представлен клинический случай с применением антиандрогена второго поколения – АА2 (энзалутамида) у больного мГЧРПЖ с наличием большой опухолевой нагрузки и выраженным проявлением метастатической болезни.
Клинический случай
Пациент 1960 г.р. обратился в Красноярский краевой клинический онкологический диспансер в августе 2023 г. с жалобами на снижение массы тела до 10 кг, наличие болевого синдрома в поясничной области (по шкале выраженности боли – 7 баллов) и эпизодическую примесь крови в кале. Данные жалобы отмечает с июля 2023 г. При объективном осмотре отмечается выраженное ожирение (ИМТ 40,8 кг/м2), передвижение на сидячей коляске, на момент осмотра соматический статус ECOG 2. Пациент был дообследован. В общем анализе крови отмечается снижение тромбоцитов до 42 × 109/л, что соответствует степени G3 по шкале CTCAE v 5.0. В биохимическом анализе крови отмечается повышение АлАТ до 200,1 Е/л, что соответствует степени G3 по шкале CTCAE v 5.0, АсАТ – 126,9 Е/л, что соответствует степени G2 по шкале CTCAE v 5.0. Инициальный уровень ПСА – 256 нг/мл.
Однофотонная эмиссионная компьютерная томография, совмещенная с рентгеновской компьютерной томографией (ОФЭКТ/КТ) всего тела в августе 2023 г.: сцинтиграфическая картина множественного распространенного очагового поражения костной системы с патологической гиперметаболической активностью вторичного характера (метастазов) – картина близка к сцинтиграфическому феномену «суперскан».
Магнитно-резонансная томография (МРТ) органов брюшной полости и малого таза от августа 2023 г.: МР-признаки забрюшинной лимфоаденопатии секундарного генеза, диффузных изменений поджелудочной железы. МР-признаки застоя желчи в желчном пузыре. МР-картина объемного образования предстательной железы с экстракапсулярной экстензией, инвазией в семенные пузырьки, прорастанием в полость мочевого пузыря. Регионарная лимфоаденопатия секундарного генеза. Множественные метастазы в кости.
Учитывая наличие метастатической формы РПЖ и тромбоцитопении G3, пациенту в условиях круглосуточного стационара выполнена биопсия предстательной железы из двух точек. Гистологическое заключение: в препаратах материал представлен столбиками фиброзно-мышечной ткани с ростом опухоли из полиморфных, гиперхромных, эпителиальных атипических клеток с формированием ацинарных структур, тяжей опухолевых клеток, солидных структур, что соответствует картине ацинарной аденокарциномы по Глисону 9 (4 + 5), G5. После биопсии пациенту потребовалась симптоматическая терапия в условиях стационара в виде переливания компонентов крови и тромбоконцентрата, гемостатическая и симптоматическая терапия.
После получения морфологической верификации был установлен диагноз. Основной: рак простаты IV стадии (инвазия в мочевой пузырь, множественные метастазы в кости, метастазы в подвздошные и парааортальные лимфоузлы), состояние после биопсии простаты от августа 2023 г. Осложнение: болевой синдром 2–3-й стадии. Паранеопластический синдром (поражение костного мозга), тромбоцитопения G3, анемия G2. Сопутствующий диагноз: гипертоническая болезнь II стадии, риск 3-й степени; ожирение IV степени.
Согласно клиническим рекомендациям, распространенность метастатического процесса носит характер большой опухолевой нагрузки согласно критериям CHAARTED и LATITUDE.
Пациенту назначена терапия антиандрогеном второй генерации: энзалутамидом 160 мг один раз в сутки независимо от приема пищи на фоне терапии аналогами лютеинизирующего гормона рилизинг-гормона (ЛГРГ) (раствором трипторелина 11,25 мг внутримышечно один раз в 90 дней длительно), направленная на снижение уровня тестостерона до кастрационных значений. Выбор данной лечебной опции был обусловлен наличием осложнений метастатической болезни в виде поражения костного мозга и угнетения костного ростка, приведших к развитию тромбоцитопении степени G3.
При очередном диспансерном наблюдении через 12 месяцев от начала лечения пациент отмечает улучшение соматического статуса, регрессию болевого синдрома и улучшение акта мочеиспускания. При объективном обследовании в общем анализе крови число тромбоцитов увеличилось до 232 × 109/л, в биохимическом анализе крови – АлАТ 38,1 Е/л, АсАТ – 29,3 Е/л. Уровень ПСА снизился до 2,2 нг/мл. Таким образом, по лабораторным показателям отмечается выраженная положительная динамика.
По данным методов лучевой диагностики – ОФЭКТ/КТ всего тела в декабре 2024 г.: сцинтиграфическая картина многочисленного распространенного метаболически активного очагового поражения костной системы вторичного характера (метастазов). По сравнению с предыдущим исследованием в августе 2023 г. – без отрицательной динамики, убедительных сцинтиграфических признаков прогрессирования нет.
МРТ брюшной полости и малого таза в декабре 2024 г.: МР-картина выраженных стромальных и фиброзирующих изменений предстательной железы. Зона патологического МР-сигнала в правой половине железы с переходом на шейку мочевого пузыря (PI-RADS 5). Выраженные фиброзно-атрофические изменения семенных пузырьков. Лимфоаденопатия подвздошных групп вторичного характера.
В настоящее время пациент продолжает прием комбинированной терапии АА2 (энзалутамид) на фоне терапии аналогами ЛГРГ без нежелательных явлений.
Приведенный клинический случай демонстрирует результаты использования современной гормонотерапии у больных РПЖ. Так, комбинированная гормональная терапия энзалутамидом и аналогами ЛГРГ является предпочтительной опцией лечения у больных мГЧРПЖ с большой опухолевой нагрузкой и наличием осложнений метастатической болезни, а также имеет хороший профиль переносимости. При этом в случае прогрессирования заболевания у пациентов сохраняются возможности для последующих линий терапии, таких как химиотерапия, системная радионуклидная терапия и таргетная терапия, что позволяет увеличить продолжительность и качество жизни больных раком предстательной железы.
Таким образом, внедрение в повседневную практику современной противоопухолевой лекарственной терапии стало неотъемлемым стандартом лечения онкологических заболеваний, что существенным образом улучшило результаты лечения и повлияло на динамику онкоэпидемиологических показателей. На примере Красноярского края показано, что у больных раком предстательной железы за последние пять лет показатель одногодичной летальности снизился более чем на 5%, показатель пятилетней выживаемости вырос на 21%, что позволило увеличить контингент пациентов, находящихся на учете, с 5 789 человек в 2019 г. до 7 376 человек в 2023 г., а индекс накопления с 5,2 до 5,7.
R.A. Zukov, PhD, Yu.V. Anzhiganova, I.P. Safontsev, PhD, T.Ye. Zabrodskaya
A.I. Kryzhanovsky Krasnoyarsk Regional Clinical Oncology Dispensary
V.F. Voino-Yasenetsky Krasnoyarsk State Medical University
Contact person: Ruslan A. Zukov, zukov_rus@mail.ru
The incidence of prostate cancer (PC) is growing annually and occupies a leading place in the structure of oncological pathology in men. The article presents data characterizing the state of oncological care for prostate cancer in the Krasnoyarsk Territory, as well as the personal experience of the authors in conducting modern drug therapy for this disease, which is reflected in the dynamics of one-year mortality and five-year survival rates.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


