количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Влияние терапии гипогонадизма препаратом Андрогель на показатели сперматогенеза
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №1 (9)
- Аннотация
- Статья
- Ссылки
В статье изложены современные представления о причинах и патогенезе гипогонадизма у мужчин, о методах терапии андрогенного дефицита, а также впервые в отечественной и зарубежной литературе продемонстрировано отсутствие отрицательного влияния геля тестостерона на показатели сперматогенеза. С учетом того, что количество пациентов репродуктивного возраста, страдающих гипогонадизмом, прогрессивно увеличивается, представляется возможным использование препарата, нормализующего уровень тестостерона, но не обладающего супрессивным действием на гонадотропную функцию гипофиза и не снижающего концентрацию сперматозоидов. Авторами было проведено открытое пилотное исследование без контрольной группы, в которое были включены 15 мужчин в возрасте от 31 до 52 лет с диагнозом «гипогонадизм». Все мужчины получали терапию гипогонадизма препаратом Андрогель. При сопоставлении показателей спермограммы до и спустя 3 месяца после лечения не было отмечено отрицательного влияния терапии препаратом Андрогель на показатели сперматогенеза.
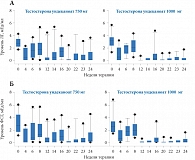
Рис. 1. Снижение уровня ЛГ (А) и ФСГ (Б) на фоне внутримышечного введения тестостерона ундеканоата
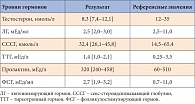
Таблица 1. Данные исходного гормонального анализа исследуемых пациентов
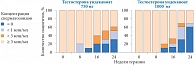
Рис. 2. Изменение концентрации сперматозоидов в течение 24 недель внутримышечного введения тестостерона ундеканоата

Таблица 2. Данные гормонального анализа пациентов через 1 месяц терапии Андрогелем
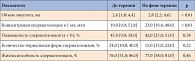
Таблица 3. Динамика показателей анализа эякулята на фоне терапии препаратом Андрогель в течение 3 месяцев
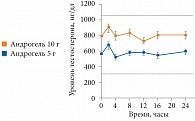
Рис. 3. Зависимость концентрации тестостерона от времени через 1 месяц терапии Андрогелем
Введение
Гипогонадизм, или андрогенный дефицит у мужчин, – состояние, при котором выявляются определенные характерные жалобы и лабораторно подтвержденное снижение уровня общего или расчетного свободного тестостерона ниже референсных значений. Пациенты с андрогенным дефицитом могут предъявлять жалобы на повышенную усталость, утомляемость, сонливость, раздражительность, нервозность, нарушение половой функции, снижение либидо, апатию, снижение когнитивных функций, трудности с нормализацией веса в случае его избытка и с нормализацией уровня сахара крови при наличии сахарного диабета, нарушение мочеиспускания и многие другие. Тяжесть проявлений гипогонадизма может колебаться от стертой симптоматики до выраженных жалоб на резкое ухудшение качества жизни. Выраженность симптомов гипогонадизма зависит от степени снижения уровня общего или расчетного свободного тестостерона, а также от строения андрогенного рецептора и, соответственно, чувствительности организма к андрогенам [1, 2].
Как известно, тестостерон является одним из важнейших гормонов, особенно в организме мужчин. Он не только отвечает за половую функцию, но и необходим для созревания сперматозоидов, поддержания нормального обмена углеводов, липидного и фосфорно-кальциевого обмена, сохранения адекватной когнитивной функции. Распространенность гипогонадизма у мужчин колеблется в зависимости от возраста, наличия хронических заболеваний, половой конституции. Так, в частности, распространенность возрастного гипогонадизма в 45–54 года составляет 34%, а в возрастной группе от 55 до 64 лет – 40,2% [3]. В случае же наличия у пациента хронических заболеваний вероятность выявления низкого уровня тестостерона значительно возрастает: в 2,7 раза – при индексе массы тела (ИМТ) от 25 кг/м2 и выше, в 2,1 раза – при наличии сахарного диабета 2 типа и в 1,7 раза – в случае наличия артериальной гипертонии [3].
Учитывая эпидемический характер, который приобретает проблема избыточного веса и ожирения [4, 5], а также пессимистический прогноз относительно распространенности сахарного диабета [6], можно говорить о том, что количество пациентов с андрогенным дефицитом также будет увеличиваться, а возраст самих пациентов – снижаться (то есть будет возрастать доля пациентов молодого, репродуктивного возраста). Таким образом, остро встает вопрос не только профилактики и лечения гипогонадизма, но и внесения поправок в терапию андрогенного дефицита, учитывая репродуктивный возраст пациентов.
Остановимся подробнее на основных моментах репродуктивной функции у мужчин. Как известно, лютеинизирующий гормон (ЛГ) стимулирует синтез тестостерона в клетках Лейдига, тогда как фолликулостимулирующий гормон (ФСГ) контролирует сперматогенез, воздействуя на клетки Сертоли. Для нормального процесса сперматогенеза абсолютно необходим и тестостерон: рецепторы к тестостерону присутствуют на клетках Лейдига, околоканальцевых клетках и клетках Сертоли; в сократительных околоканальцевых клетках тестостерон стимулирует продукцию актина гладкомышечного типа, а в семенных канальцах – гаметогенез. Важнейшим фактом является и то, что для нормального процесса сперматогенеза необходима высокая интратестикулярная концентрация тестостерона [7, 8]. Таким образом, с клинической точки зрения следует считать, что синергичное действие ФСГ, ЛГ и тестостерона необходимо не только для инициации, но и для поддержания нормального сперматогенеза у мужчин. Это является ключевым моментом в сохранении адекватной репродуктивной функции мужчины.
Как известно, на данный момент существует несколько вариантов терапии, которые можно предложить пациентам с гипогонадизмом, а именно: использование внутримышечных эфиров тестостерона, трансдермальной формы тестостерона и препаратов гонадотропных гормонов. Назначение внутримышечных препаратов ведет к повышению уровня тестостерона до супрафизиологических значений в первые дни после инъекции и, соответственно, к компенсаторному снижению уровня ЛГ; при этом блокируется выработка эндогенного тестостерона в клетках Лейдига и ФСГ, что ведет к нарушению сперматогенеза. Так, к примеру, в работе C. Wang и R.S. Swerdloff [9, 10] назначение 20 здоровым мужчинам внутримышечных инъекций тестостерона ундеканоата в дозировке 750 и 1000 мг каждые 8 недель приводило к резкому снижению показателей ЛГ и ФСГ (рис. 1), что сопровождалось снижением концентрации сперматозоидов. Более того, через 24 недели приема у 60% мужчин концентрация сперматозоидов была менее 3 млн в 1 мл (рис. 2).
Аналогичные данные были получены в работе Y.L. Gui и соавт. [11]: на фоне внутримышечных инъекций тестостерона наблюдалось резкое снижение уровня ЛГ, ФСГ, концентрации сперматозоидов. Таким образом, назначение внутримышечных препаратов тестостерона пациентам, планирующим достижение беременности у партнерши в ближайшие 1–1,5 года, нецелесообразно по причине негативного воздействия препаратов на сперматогенез. Терапия препаратами гонадотропинов может применяться у данной группы пациентов, особенно в случае нарушений в показателях спермограммы. Однако в случае нормальных показателей сперматогенеза или отсутствия четких планов на достижение беременности в ближайшее время назначение их не всегда целесообразно.
Нередко пациенты не могут четко озвучить планы на достижение беременности у партнерши, либо пара планирует беременность, но не в ближайшей перспективе, к примеру, через год. В такой ситуации представляется возможным использование препарата, нормализующего уровень тестостерона, но не обладающего супрессивным действием на гонадотропную функцию гипофиза и не снижающего концентрацию сперматозоидов.
Материалы и методы исследования
Для оценки влияния терапии трансдермальной формой тестостерона (препарат Андрогель) на показатели сперматогенеза у мужчин с гипогонадизмом было проведено открытое пилотное исследование без контрольной группы, в которое были включены 15 мужчин в возрасте от 31 до 52 лет. На основании предъявляемых жалоб на повышенную утомляемость, избыточный вес, снижение толерантности к физическим нагрузкам и стрессу, нарушение эрекции, снижение либидо был заподозрен диагноз «гипогонадизм». Все пациенты прошли осмотр андролога, у всех был взят анализ крови на тестостерон, секс-стероидсвязывающий глобулин (СССГ), пролактин, ЛГ, ФСГ, тиреотропный гормон (ТТГ). У всех пациентов были исключены заболевания предстательной железы, органов мошонки при осмотре. На основании данных осмотра, антропометрических показателей, предъявляемых жалоб и данных гормонального анализа у всех пациентов был выявлен эугонадотропный гипогонадизм (табл. 1).
Все мужчины дважды сдавали анализ эякулята на 3–5-й день полового воздержания, который был выполнен с соблюдением рекомендаций Всемирной организации здравоохранения (ВОЗ) от 1999 г. [12]. Критерием включения было наличие здорового потомства, нормальных показателей спермограммы, нормальный уровень простатспецифического антигена (ПСА) (для мужчин старше 49 лет).
Применялись следующие критерии исключения: гипергонадотропный гипогонадизм; эндокринные заболевания, ведущие к снижению секреции тестостерона: гипотиреоз, тиреотоксикоз, гиперпролактинемия (диагноз устанавливается на основании определения уровней ТТГ, свободного тироксина (Т4), пролактина), сахарный диабет; гиперкортицизм; прием препаратов, влияющих на андрогенный статус (андрогены, хорионический гонадотропин, ингибиторы 5-альфа-редуктазы, дигидроэпиандростерон); прием препаратов, влияющих на сперматогенез; заболевания семявыносящих путей (обструкция семявыносящих путей, муковисцидоз, синдром Юнга); приобретенные дефекты (травма, облучение, аутоиммунные заболевания) или тяжелые соматические заболевания (почечная или печеночная недостаточность, серповидно-клеточная анемия и др.); алкоголизм.
Всем пациентам была назначена терапия препаратом Андрогель по 50 мг ежедневно на кожу плеч и брюшной стенки. В связи с тем что цикл сперматогенеза составляет 72 дня, оценка данных исследования эякулята проводилась не раньше чем через 3 месяца от назначения терапии. Через 1 месяц приема препарата проводилась оценка уровня тестостерона, СССГ крови для оценки адекватности проводимой терапии. Статистическая обработка полученных данных была проведена с использованием пакета прикладных программ Statistica (StatSoft Inc. США, версия 6.0). Количественные данные представлены в виде медианы и интерквартильного диапазона. При сравнении количественных данных двух связанных групп использовался критерий Вилкоксона. Статистически значимыми считались значения p < 0,05.
Результаты и их обсуждение
Как видно из данных таблицы 2, уже через 1 месяц лечения Андрогелем у всех пациентов наблюдался статистически значимый рост уровня общего тестостерона (р < 0,001), уровень СССГ оставался без изменений. В корректировке дозы принимаемого препарата ни один из пациентов не нуждался. У всех пациентов уже через 1 месяц терапии наблюдалось значительное улучшение общего самочувствия, сокращение количества предъявляемых жалоб, улучшение половой функции. Через 3 месяца у всех пациентов наблюдалась нормализация половой функции, значительная положительная динамика в отношении уменьшения веса и окружности талии.
В таблице 3 представлена динамика показателей спермограммы на фоне терапии препаратом Андрогель в течение 3 месяцев. Как видно из приведенных данных, у пациентов через 3 месяца лечения отмечается сохранение нормального объема эякулята, нормальная концентрация сперматозоидов в 1 мл. Через 3 месяца терапии также наблюдалось статистически значимое увеличение концентрации сперматозоидов (p < 0,01), однако по причине слишком маленького объема выборки говорить о способности терапии препаратом Андрогель увеличивать концентрацию сперматозоидов у мужчин с гипогонадизмом нельзя. Статистически значимого изменения процента подвижных сперматозоидов (p = 0,38), количества нормальных форм (p = 0,22) и жизнеспособности сперматозоидов (p = 0,46) не наблюдалось.
Столь значимое отличие во влиянии препаратов тестостерона на показатели сперматогенеза обусловлено фармакокинетическими особенностями препаратов. Если на фоне внутримышечных инъекций наблюдаются супрафизиологические пики концентрации тестостерона, что негативно влияет на секрецию гонадотропных гормонов гипофизом, то на фоне применения трансдермальной формы тестостерона пики сглажены, столь резких перепадов концентрации уровня тестостерона не наблюдается [9]. На рисунке 3 представлена зависимость концентрации тестостерона от времени через 1 месяц лечения Андрогелем.
Заключение
Данные проведенного нами пилотного исследования впервые в отечественной и зарубежной литературе продемонстрировали отсутствие негативного влияния препарата тестостерона в форме геля (Андрогель) на показатели сперматогенеза. С учетом того, что количество пациентов репродуктивного возраста, страдающих гипогонадизмом, прогрессивно увеличивается, полученные данные открывают перед практикующими врачами новые перспективы в выборе препаратов и методов заместительной терапии у пациентов с гипогонадизмом репродуктивного возраста.
1. Schneider G., Nienhaus K., Gromoll J. et al. Aging males’ symptoms in relation to the genetically determined androgen receptor CAG polymorphism, sex hormone levels and sample membership // Psychoneuroendocrinology. 2010. Vol. 35. № 4. P. 578–587.
2. Zitzmann M., Faber S., Nieschlag E. Association of specific symptoms and metabolic risks with serum testosterone in older men // J. Clin. Endocrinol. Metab. 2006. Vol. 91. № 11. P. 4335–4343.
3. Mulligan T., Frick M.F., Zuraw Q.C. et al. Prevalence of hypogonadism in males aged at least 45 years: the HIM study // Int. J. Clin. Pract. 2006. Vol. 60. № 7. P. 762–769.
4. Hill J.O., Peters J.C. Environmental contributions to the obesity epidemic // Science. 1998. Vol. 280. № 5368. P. 1371–1374.
5. Nestle M., Jacobson M.F. Halting the obesity epidemic: a public health policy approach // Public Health Rep. 2000. Vol. 115. № 1. P. 12–24.
6. Wild S., Roglic G., Green A. et al. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030 // Diabetes Care. 2004. Vol. 27. № 5. P. 1047–1053.
7. Huang H.F., Nieschlag E. Suppression of the intratesticular testosterone is associated with quantitative changes in spermatogonial populations in intact adult rats // Endocrinology. 1986. Vol. 118. № 2. P. 619–627.
8. Sharpe R.M., Donachie K., Cooper I. Re-evaluation of the intratesticular level of testosterone required for quantitative maintenance of spermatogenesis in the rat // J. Endocrinol. 1988. Vol. 117. № 1. P. 19–26.
9. Wang C., Berman N., Longstreth J.A. et al. Pharmacokinetics of transdermal testosterone gel in hypogonadal men: application of gel at one site versus four sites: a General Clinical Research Center Study // J. Clin. Endocrinol. Metab. 2000. Vol. 85. № 3. P. 964–969.
10. Swerdloff R.S., Wang C., Cunningham G. et al. Long-term pharmacokinetics of transdermal testosterone gel in hypogonadal men // J. Clin. Endocrinol. Metab. 2000. Vol. 85. № 12. P. 4500–4510.
11. Gui Y.L., He C.H., Amory J.K. et al. Male hormonal contraception: suppression of spermatogenesis by injectable testosterone undecanoate alone or with levonorgestrel implants in chinese men // J. Androl. 2004. Vol. 25. № 5. P. 720–727.
12. World Health Organization. WHO Laboratory Manual for the Examination of Human Semen and Sperm-Cervical Mucus Interactions. 4th ed. Cambridge: Cambridge University Press, 1999.
Новости на тему
01.09.2022 01:00:00
31.03.2022 12:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.