Возможности использования пробиотиков для укрепления противоинфекционной защиты в свете иммуногомеостатической роли микробиоты
- Аннотация
- Статья
- Ссылки
- English


Введение
В последние 2–3 десятилетия происходит стремительная смена иммунологических парадигм и переосмысление роли системы иммунитета как одной из наиболее важных гомеостатических систем организма. Среди наиболее значимых событий конца XX века – начала нынешнего столетия в области иммунологии, определяющих вектор ее развития, следует выделить открытие паттерн-распознающих рецепторов врожденного иммунитета и структурно-функционального полиморфизма CD4+-Т-лимфоцитов. В контексте этих открытий модернизируются представления о роли кишечной микробиоты в поддержании иммунного гомеостаза. Бактерии-комменсалы, во многом благодаря воздействию на рецепторы врожденного иммунитета, в конечном итоге модулируют дифференцировку T-лимфоцитов в направлении как регуляторных, так и эффекторных клеток, обеспечивая наряду с толерогенными сигналами укрепление противоинфекционной защиты в желудочно-кишечном тракте (ЖКТ) и за его пределами.
Связь иммунной системы и кишечной микробиоты является объектом пристального внимания не только иммунологов, гастроэнтерологов и микробиологов, но представителей многих других медико-биологических специальностей. В начале мая 2013 г. крупнейшая международная сеть поисковых систем Google на запрос из комбинации слов microbiota + immunity выдавала около 1,26 млн результатов, microflora + immunity – 2,63 млн. Дополнение вышеуказанных комбинаций в запросе словом gut (кишечный) уменьшало число обнаруженных web-страниц примерно вдвое, однако, несмотря на это, количество ссылок впечатляет. Поиск в авторитетной базе медико-биологической литературы PubMed по ключевым словам microbiota + immunity выявлял почти 4 тыс. публикаций, а по комбинации microbiota + immune – более 5 тыс. научных работ. Уточнение этих поисковых запросов словом gut лишь незначительно снижало количество обнаруженных литературных источников.
Растет число публикаций, посвященных фармакологическим, в том числе иммуномодулирующим, эффектам пробиотиков. Принципиальная возможность коррекции и профилактики иммунных расстройств за счет потребления живых симбионтных микробов в целом уже не вызывает сомнения [1]. Однако сообщения о результатах использования пробиотиков при тех или иных иммунозависимых заболеваниях зачастую противоречивы.
Выживаемость пробиотических бактерий
Среди практикующих врачей дискутируются вопросы сохранения жизнеспособности симбионтных микробов на этапах производства/хранения пробиотиков и при прохождении агрессивной среды желудка и верхних отделов тонкой кишки. Обсуждается также способность перорально введенных бактерий колонизировать слизистые дистальных отделов пищеварительной системы. По нашему мнению, данные параметры индивидуальны, каждый конкретный продукт необходимо рассматривать отдельно. Многие разработчики и производители решили технические проблемы, связанные с выживаемостью бактерий как при изготовлении/хранении пробиотиков, так и при прохождении верхних отделов ЖКТ, и доказали возможность более или менее длительного выявления введенных штаммов в образцах фекалий [2]. Подобраны оптимальные условия для лиофильной сушки микроорганизмов, обеспечивающие их жизнеспособность и длительную стабильность при хранении [3]. Технология delayed release (замедленное высвобождение), используемая при создании современных защищенных пробиотиков, гарантирует безопасный желудочный и дуоденальный транзит живых бактерий и высвобождение активных компонентов в дистальных отделах ЖКТ. При этом в качестве систем доставки симбионтных микробов предложены кишечнорастворимые капсулы, кислотоустойчивые таблетки [4, 5] и микрокапсулы [6], которые, кроме того, обеспечивают возможность более длительного хранения готового продукта [7].
Вместе с тем доказано сохранение жизнеспособности некоторых пробиотических микроорганизмов при прохождении через ЖКТ и в незащищенной форме, что связано с устойчивостью самих бактерий к соляной кислоте, ферментам и желчным кислотам. Эта устойчивость существенно варьирует между видами и штаммами бактерий, но в среднем 10–25% поглощенных бактериальных клеток выживают и достигают дистальных отделов кишечника [8]. Продемонстрирован успешный транзит через верхние отделы ЖКТ ряда пробиотических микробов, содержащихся в йогурте [9, 10]. Однако гораздо большая стойкость пробиотических штаммов в йогуртах к действию соляной кислоты, ферментов и желчных кислот достигается путем микрокапсуляции [11], что поддерживает тезис о преимуществах защищенных пробиотиков.
Введение живых бактерий в сочетании с пребиотиками существенно увеличивает вероятность колонизации слизистых оболочек кишечника [12]. Это учтено некоторыми производителями при создании комбинированных препаратов (синбиотиков), включающих не только полезные микроорганизмы, но и ингредиенты, избирательно стимулирующие рост и/или активность представителей нормальной микробиоты.
В контексте выживаемости перорально введенных симбионтных микробов отметим, что даже мертвые представители ряда пробиотических штаммов оказывают значимые иммунотропные эффекты на макроорганизм. Иммуномодулирующие свойства пробиотических микроорганизмов выходят за рамки их жизнеспособности, в связи с чем был предложен термин «парапробиотики» для обозначения продуктов с инактивированными симбионтами, оказывающими положительное влияние на здоровье потребителей [13].
Безопасность пробиотиков и резистентность к антимикробным средствам
Актуальным и широко обсуждаемым вопросом является безопасность пробиотических бактерий, в том числе потенциальная возможность передачи резистентности к антимикробным средствам от этих бактерий патогенам или условно-патогенным микробам. Действительно, кишечный микробиом человека может служить резервуаром генов устойчивости к антибиотикам, и с учетом высокой плотности микроорганизмов в этой экосистеме существует риск горизонтальной диссеминации указанных генов внутри микробного сообщества [14]. В последние годы, благодаря совершенствованию молекулярных методов верификации генов резистентности, уточнена информация о распространенности этих генов среди микробов различных таксономических групп, в том числе среди индигенных бактерий. Расшифрованы молекулярные механизмы появления, селекции, хранения, внутри- и межвидовой передачи лекарственной устойчивости, в частности установлена роль плазмид, траспозонов и интегронов [15]. Некоторые микроорганизмы сами способны синтезировать антимикробные молекулы, и механизмы естественной селекции устойчивых к ним бактерий сформировались еще до появления человека в результате сложных экологических и эволюционных отношений между самими микробами [16]. Широкое и при этом далеко не всегда рациональное применение антибиотиков в последние десятилетия усилило селекцию и распространение резистентных штаммов, в том числе среди индигенных бактерий, которые благодаря эволюционно закрепленным коммуникативным механизмам могут передавать соответствующие гены не только другим комменсалам, но и патогенам.
Принимая во внимание то, что устойчивость к антимикробным средствам длительное время рассматривалась многими разработчиками как желаемое качество при выборе пробиотических штаммов, потенциальная угроза диссеминации резистентности со стороны пробиотиков существует. В этой связи Продовольственная и сельскохозяйственная организация ООН (Food and Agriculture Organization, FAO) и Всемирная организация здравоохранения (World Health Organization, WHO) сформулировали требования, которым должны соответствовать современные пробиотики и входящие в их состав микроорганизмы [17]. В частности, используемые в конечных продуктах и препаратах пробиотические штаммы обязательно должны проходить контроль на предмет носительства генов антибиотикорезистентности и возможности их горизонтальной передачи. В состав пробиотиков, выпускаемых в соответствии с требованиями FAO/WHO, входят только хорошо изученные, таксономически классифицированные культуры, депонированные в международно признанных коллекциях.
Исследования последних лет демонстрируют, что проблема приобретения/селекции/передачи генов устойчивости к антимикробным средствам связана не только с широким использованием антибиотиков. Во многих случаях резистентные штаммы становятся доминантными микробными популяциями даже в отсутствие селективного давления соответствующих антимикробных препаратов, а гены устойчивости к антибиотикам выявляются у лиц без истории прямого действия этих препаратов [18]. Часто колонизация слизистых оболочек различных биотопов резистентными к химиопрепаратам штаммами комменсалов происходит уже во время родов, вскармливания и контактов в раннем постнатальном периоде [19]. Многие широко потребляемые пищевые продукты, особенно ферментированные продукты молочного, мясного и растительного происхождения, содержат живые бактерии, несущие передаваемые гены устойчивости к антимикробным средствам [20]. Эти гены выявляются также в почве, воде и других образцах окружающей среды [21, 22]. Постоянно происходит обмен микробами между людьми, а также между человеком и животными, в результате чего так называемый resistome – совокупность генов лекарственной устойчивости нашего микробиома – пополняется [14].
Учитывая вышесказанное, риски привнесения новых генов резистентности к антибиотикам, связанные с использованием хорошо изученных пробиотиков, и передачи этих генов другим резидентным и транзиторным представителям микробиоты в оценках многих специалистов выглядят преувеличенными, за некоторыми исключениями. Особое внимание и тщательный контроль безопасности необходимы для видов и штаммов бактерий, которые не только известны как частые носители передаваемых генов резистентности, но и как потенциальные патогены. Такими свойствами обладают, например, многие представители рода Enterococcus, в том числе применяемые в качестве пробиотиков. Помимо доказанной способности передавать устойчивость к антибиотикам другим микробам, эти бактерии достаточно часто являются возбудителями нозокомиальных инфекций [23].
Часто используемые в составе пробиотических продуктов представители рода Bifidobacterium в результате многочисленных исследований, проведенных в разных странах, признаны безопасными. Гастроинтестинальные и внекишечные инфекции, связанные с бактериями этого рода, встречаются крайне редко [24]. Тем не менее отдельные штаммы бифидобактерий несут в себе ген устойчивости к тетрациклину – tet(W) [25]. L. Masco и соавт. выявили этот ген у 15 из 100 исследованных штаммов (50 изолятов из пробиотических продуктов и 50 депонированных штаммов) рода Bifidobacterium, при этом во всех случаях бактерии – носители tet(W) не содержали конъюгативный траспозон TnB1230, который считается ответственным за распространение этого гена в окружающей среде [26]. Это согласуется с данными K.P. Scott и соавт., которые не смогли выявить этот мобильный генетический элемент в человеческих изолятах B. longum [27].
В целом безопасными также признаются большинство пробиотических штаммов рода Lactobacillus [28]. Единичные случаи лактобациллярной инфекции не сопоставимы с огромными масштабами случайного и намеренного поглощения живых лактобацилл. Ретроспективный анализ показал, что в результате существенного увеличения потребления L. rhamnosus GG (одного из наиболее изученных пробиотических штаммов) в Финляндии частота случаев лактобациллярной бактериемии не увеличилась [29]. Риск развития лактобациллемии не превышает 1 случай на миллион потребителей [30]. Известная устойчивость лактобацилл к некоторым антимикробным средствам, например к ванкомицину и триметоприму, рассматривается как проявление естественной резистентности, которая a priori не передается другим микробам. Во многих пробиотических штаммах лактобацилл выявлялись и приобретенные гены резистентности, которые потенциально могут передаваться другим бактериям, чаще других гены устойчивости к тетрациклину tet(M), эритромицину erm(B) и хлорамфениколу cat. Однако для большинства представителей рода Lactobacillus возможность горизонтальной передачи этих генов не доказана. Лишь у нескольких штаммов лактобацилл обнаружена способность передавать лекарственную устойчивость другим видам, в частности представителям рода Enterococcus [31]. Таким образом, для непатогенных пробиотических штаммов опасность представляет не столько сама резистентность к антимикробным средствам, сколько возможность ее передачи другим представителям микробного сообщества.
В любом случае безопасность входящих в состав пробиотиков микроорганизмов должна быть всесторонне изучена согласно принципам, которые сформулированы как в вышеупомянутом документе FAO/WHO, так и в других международных инициативах: PROSAFE, QPS, ACE-ART [32]. Положительное влияние пробиотиков, которые соответствуют современным международным стандартам эффективности и безопасности, на здоровье человека, в том числе на иммунный гомеостаз организма, существенно превосходит значимость потенциальных рисков, связанных с использованием указанных продуктов.
Внимания заслуживают сообщения о попытках предотвратить колонизацию организма резистентными штаммами за счет перорального введения антибиотикочувствительных бактерий [33], некоторые из них были весьма успешными [34]. Таким образом, пробиотики могут быть не только фактором риска, но и инструментом борьбы с устойчивостью к антимикробным средствам.
Роль микробиоты в эволюции иммунной системы млекопитающих
Долгое время эволюция иммунной системы животных рассматривалась в контексте постоянного прессинга со стороны патогенов. Преобладало мнение, что именно под влиянием постоянных вызовов от инфекционных агентов сформировалась сложная система генетической вариабельности, позволяющая генерировать огромное число молекул, таких как антитела, с практически неограниченными способностями распознавать вновь появляющиеся патогены. В поддержку этого мнения приводился пример взаимосвязи появления челюстей у рыб и формирования адаптивного иммунитета [35]. Филогенетически появление челюстей дало рыбам преимущество в питании, позволило увеличить им свои размеры и продолжительность жизни, но одновременно вырос риск травматизации и инфицирования, в том числе повторного, слизистых оболочек кишечника. Считалось, что этот процесс послужил отправной точкой для развития иммунологической памяти [36].
Однако сейчас происходит трансформация представлений. Пожалуй, более логичными и обоснованными являются доводы о том, что комменсалы оказывают большее, чем патогены, эволюционное давление на иммунную систему и потому им принадлежит большая роль в филогенезе этой системы [37, 38]. По самым сдержанным оценкам, многоклеточные организмы имеют резидентную микрофлору более полумиллиарда лет [39, 40]. Все это время макроорганизмы и микробы ко-эволюционируют и адаптируются друг к другу. Животные явились для заселивших их бактерий стабильными экосистемами, изобилующими нутриентами. В этой связи здоровье хозяина приобрело первостепенное значение для его микробиоты [38].
Микроорганизмы колонизировали различные участки нашего тела, включая кожу, полость рта, слизистые мочеполовой и дыхательной систем, ухо, однако именно нижние отделы ЖКТ характеризуются наибольшей плотностью и разнообразием комменсалов. В дистальной части тонкой кишки и особенно в толстой кишке обитают бактерии, археи, грибы, простейшие и в некоторых случаях многоклеточные гельминты. Однако бактерии, безусловно, доминируют: их общее число в толстой кишке достигает 100 трлн. Недавние метагеномные исследования кишечной микробиоты человека выявили около 3,3 млн генов, что примерно в 150 раз превосходит число генов самого человека [41].
Млекопитающие филогенетически научились извлекать пользу от такой огромной массы разнообразных резидентных бактерий, которые, в частности, помогают переваривать комплексные углеводы и снабжают макроорганизм важнейшими нутриентами. Однако роль микробиоты далеко не ограничивается участием в пищеварении.
Все больше научных подтверждений находит приведенное нами ранее образное высказывание о том, что млекопитающие, включая человека, заключили со многими из резидентных микробов не только «пакт о ненападении», но и «договор о взаимопомощи» на случай внешних угроз, в том числе исходящих от патогенных вирусов и бактерий [1].
Интересный альтернативный взгляд на филогенез и функцию иммунной системы приводит E.T. Harvill [42]. Несмотря на «совершенную» защиту, связанную с выработкой огромного разнообразия патоген-специфических молекул, наш организм не свободен от болезнетворных микробов и вряд ли более успешен в борьбе с последними, чем растения и насекомые, которые не имеют адаптивного иммунитета. В начале 1970-х гг. была выдвинута гипотеза “Red Queen” (в русском переводе – «Черной Королевы»), в соответствии с которой между патогенами и макроорганизмом происходит «эволюционная гонка вооружений»: чем более сложной и совершенной становится иммунная защита хозяина, тем жестче эволюционный отбор паразитов, и наоборот [43]. Это дает селективные преимущества хозяину перед другими макроорганизмами, однако соревнование с болезнетворными микробами a priori обречено на неудачу в связи с большей скоростью эволюции патогенов. Как сказала Черная Королева из произведения Льюиса Кэрролла «Алиса в Зазеркалье», «приходится бежать со всех ног, чтобы только остаться на том же месте».
E.T. Harvill рассматривает иммунитет (включая противоинфекционную защиту и толерантность) как компонент комплексной системы, важнейшей задачей которой является поддержание микробиома (комменсалов и симбионтов), обеспечивающего или улучшающего многие жизненно важные функции нашего организма [42]. По его мнению, многие известные и неизвестные механизмы защиты от патогенов – это часть системы поддержания здорового микробиома. В этой связи не удивительно, что преобладающий изотип антител слизистых оболочек IgA нацелен на резидентную микробиоту, но при этом обеспечивает не защиту от симбионтов, а иммунную толерантность к ним. Вполне вероятно, что филогенез системы адаптивного иммунитета связан с необходимостью быстро приспосабливаться к новым комменсалам и симбионтам, которые попадают в наш организм с новой пищей и помогают хозяину детоксицировать и переваривать эту пищу и, кроме того, обеспечивают колонизационную резистентность и другие механизмы защиты от патогенов.
Микробиота не только управляет филогенезом иммунной системы, но и определяет характер онтогенетического развития мукозального и общего иммунитета, а также эффективность и адекватность противоинфекционного ответа. Нарушение эволюционно сложившихся этапов неонатального и постнатального заселения микробами нашего организма, особенно ЖКТ, ведет к иммунозависимым заболеваниям [44]. Это подтверждается исследованиями иммунной системы у гнотобионтов (безмикробных животных), характеризующихся слаборазвитой мукоза-ассоциированной лимфоидной тканью, гипопластическими пейеровыми бляшками, уменьшением числа CD4+-лимфоцитов и IgA-продуцирующих плазматических клеток в собственной пластинке слизистой оболочки, при этом в лимфоидных органах отмечается сдвиг дифференцировки Т-клеток в сторону T-хелперов 2 типа (Th₂) и сниженная продукция интерферона (ИФН) гамма [45, 46].
Микробиота и здоровье хозяина
В последние годы увеличилось число работ по изучению микробиома в контексте здоровья и заболеваний человека [47]. Этиология многих болезней включает не только генетические, но и экологические факторы. Частота таких заболеваний, как ожирение, диабет, атеросклероз, неуклонно растет в последние десятилетия, что в значительной степени связывают с факторами окружающей среды [48]. Изменение образа и характера питания, а также прямое и опосредованное воздействие антимикробных препаратов оказывают существенное влияние на состав и функцию кишечной микробиоты человека, что является важнейшим экологическим фактором развития указанных болезней [49]. Микробиом играет существенную роль в энергетическом балансе, эндокринных сигналах и метаболических расстройствах, ассоциированных с ожирением, таких как метаболическая эндотоксемия [50].
Постепенно проясняется функция кишечной микробиоты в контексте взаимосвязи ЖКТ и центральной нервной системы (ЦНС). C осью «микробиота – кишечник – мозг» ассоциированы возрастная эволюция и разнообразные функции ЦНС, включая поведение и настроение. Эта ось, вероятно, имеет большое значение в развитии таких заболеваний человека, как аутизм. Доказано, что пробиотики, включающие бифидобактерии и лактобациллы, снижают тревогу у животных, а у больных людей обусловливают многие положительные физиологические эффекты, включая снижение уровня кортизола в сыворотке крови [51].
Выявлены выраженные изменения микробиоценоза ЖКТ у больных ревматоидным артритом, системной красной волчанкой и некоторыми другими аутоиммунными заболеваниями [52]. Не вызывает сомнений связь расстройств микробиоты с развитием болезни Крона и язвенного колита [53]. Ассоциированные с дисбиозом нарушения иммунного гомеостаза, в частности механизмов толерантности, увеличивают риск аллергических заболеваний [54].
В недавней работе экспериментально подтверждена гипотеза о том, что микробиота играет роль в поддержании «сияния здоровья», то есть таких характеристик, как блестящие волосы и здоровая кожа, которые связывают с фертильностью и молодостью. При этом доказано, что пробиотики могут восстанавливать эти внешние проявления репродуктивных способностей при старении организма [55].
I. Cho и M.J. Blaser обобщили данные последних исследований взаимосвязи патологических состояний человека и расстройств кишечной микробиоты (табл. 1) [47]. Плейотропное влияние микробиома на состояние здоровья млекопитающих, включая человека, позволяет рассматривать их не просто как изолированные виды, а как сложные экосистемы, в которых огромное число микробов взаимодействует с клетками, органами и системами макроорганизма, а также друг с другом, используя эволюционно закрепленные сигнальные и другие коммуникативные механизмы.
Роль микробиоты в противоинфекционной защите
Важная роль кишечной микробиоты в защите от патогенов непосредственно в пищеварительном тракте, обусловленная различными механизмами колонизационной резистентности [56–58], давно уже не вызывает сомнений. Относительно недавно получены доказательства того, что индигенные бактерии регулируют защитные иммунные реакции и за пределами пищеварительной системы, в частности в респираторном тракте. Установлено влияние кишечных бактерий-комменсалов на реализацию иммунного ответа против вируса гриппа, в частности на созревание вирус-специфических CD4+- и СD8+-Т-клеток. В экспериментах in vivo истощение микробиоты пероральным приемом антибиотиков существенно снижало устойчивость к интраназальному заражению вирусом гриппа А и увеличивало летальность инфицированных животных. Указанные дефекты противовирусной защиты были связаны со снижением Т- и В-клеточных иммунных реакций, а также подавлением функции и миграции дендритных клеток в респираторном тракте [59]. Эти данные согласуются с клиническими наблюдениями, говорящими об утяжелении течения гриппа и других респираторных вирусных инфекций при приеме антибактериальных средств, ведущем к подавлению микробиоты.
В настоящее время раскрыты некоторые молекулярные механизмы, за счет которых кишечные бактерии усиливают противовирусный ответ.
Во-первых, это стимуляция образ-распознающих Toll-подобных рецепторов (TLR). TLR-2 распознают липотейхоевые кислоты и липопротеины бактериальных клеточных стенок. TLR-4/MD-2 являются сенсорами липополисахаридов грамотрицательных бактерий. TLR-9 распознают неметилированные СpG-последовательности бактериальной ДНК. Ректальное введение лигандов TLR мышам восстанавливало подавленный антибиотиками противовирусный иммунный ответ и устойчивость к интраназальному заражению вирусом гриппа А [59]. Это подтверждает тезис о том, что стимулирующие противоинфекционную защиту сигналы, полученные в нижних отделах ЖКТ, передаются в слизистые других биотопов, в частности в респираторный тракт.
Во-вторых, установлена роль NOD-подобных рецепторов (NLR) и включающих их инфламмасом как сенсоров бактериальных компонентов, активирующих противовирусный ответ [60]. Продукты деградации клеточных стенок бактерий-комменсалов, в частности мурамилпептиды, являясь лигандами этих рецепторов [61], существенно усиливают противовирусную защиту организма, в частности от возбудителей гриппа [62].
Пробиотики как иммуномодуляторы
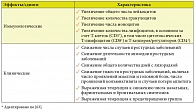
Убедительные доказательства, во-первых, эволюционно закрепленной роли кишечной микробиоты в регуляции иммунного гомеостаза, во-вторых, возможности количественно и качественно корригировать микробиологические и иммунологические показатели при пероральном введении симбионтных бактерий окончательно трансформировали вопрос о целесообразности использования пробиотиков в качестве иммуномодуляторов из дискуссионного в риторический [1]. Данные по клинически и экспериментально подтвержденным механизмам иммунотропного действия пробиотиков суммированы в таблице 2 [63].
В значительной степени с иммуномодулирующей активностью связаны следующие доказанные эффекты пробиотических бактерий на организм человека [64]:
1) предотвращение и/или снижение выраженности инфекций респираторного тракта и мочеполовой системы;
2) предотвращение и/или снижение выраженности аллергических заболеваний у детей;
3) снижение концентрации канцерогенных энзимов и/или гнилостных (бактериальных) метаболитов в кишечнике;
4) предотвращение или снижение тяжести и продолжительности ротавирусной инфекции и антибиотик-ассоциированной диареи;
5) коррекция расстройств микробиоты и снижение выраженности клинических проявлений при воспалительных желудочно-кишечных заболеваниях, избыточном бактериальном росте, а также при инфекции, вызванной Helicobacter pylori;
6) профилактика послеоперационных инфекционных осложнений у больных колоректальным [65–67] и билиарным раком [68–71].
Получены также положительные данные по применению пробиотиков при некоторых аутоиммунных заболеваниях [72].
Следует выделить ряд феноменов и свойств пробиотиков, которые отличают их от других иммуностимулирующих и иммуномодулирующих средств.
Во-первых, это стойкость иммунотропного действия. Коррекция и стабилизация количественных и качественных показателей кишечной микробиоты, достигнутые в результате курсового применения пробиотиков, являются фундаментом их длительного влияния на иммунный гомеостаз. Большинство других иммунотропных препаратов оставляют лишь кратковременный след после завершения их применения.
Во-вторых, пробиотические бактерии передают не только сигналы, активирующие противоинфекционную защиту, но и сигналы толерантности к собственным и чужеродным антигенам, тем самым снижая вероятность развития аллергических и аутоиммунных заболеваний. Благодаря этому свойству пробиотиков при их применении минимизирован риск избыточной стимуляции иммунитета, который существует при применении многих иных иммуностимулирующих препаратов. В подтверждение толерогенной активности кишечной микробиоты, а также пробиотических микроорганизмов можно привести несколько фактов. Применение антибактериальных средств и отсутствие/недостаточность грудного вскармливания в младенчестве, вызывая дисбиотические расстройства, увеличивают вероятность развития пищевой аллергии и атопического дерматита [73]. Наоборот, применение в раннем возрасте пробиотиков, в частности содержащих лактобациллы и бифидобактерии, снижает вероятность развития аллергических заболеваний [74]. Целый ряд аутоиммунных заболеваний связан с кишечным дисбиозом [75], тогда как пробиотики уменьшают выраженность клинических проявлений ревматоидного артрита [72]. Раскрытие молекулярных механизмов болезни Крона, при которой генетический дефект передачи противовоспалительных сигналов от компонентов бактериальных клеточных стенок – мурамилпептидов – через NOD2-рецепторы приводит к развитию тяжелого воспалительного заболевания кишечника, также в значительной степени поддерживает тезис о толерогенной активности симбионтных бактерий [61].
В-третьих, существуют эволюционно закрепленные механизмы передачи сигналов, обеспечивающих противоинфекционную защиту и иммунную толерантность, из ЖКТ в другие биотопы организма, в частности в слизистые респираторного тракта и мочеполовой системы. Основные молекулярные механизмы этого феномена, получившего название «иммунная солидарность слизистых» [76], раскрыты. Применяя пробиотики, мы имитируем естественный путь регуляции иммунных реакций вне пищеварительной системы, который обусловлен циркуляцией бактериальных компонентов и продуктов, а также иммунных медиаторов и клеток из ЖКТ в другие органы и ткани нашего организма.
Различия пробиотических бактерий в иммунотропной активности
Выявлены существенные межродовые, межвидовые и межштаммовые различия в иммуномодулирующем действии симбионтных бактерий. Причем эти различия касаются не только выраженности, но и характера иммунотропных эффектов.
В качестве примера приведем данные исследования иммуномодулирующей активности 21 штамма четырех видов бифидобактерий [77]. Первая группа этих штаммов в культуре мононуклеарных клеток человека in vitro индуцировала продукцию цитокинов Th₁-профиля: ИФН-гамма и фактора некроза опухоли (ФНО). Вторая группа главным образом вызывала выработку интерлейкина-17 при относительно низкой продукции ИФН-гамма и ФНО (Th₁₇-профиль). Третья группа преимущественно стимулировала выработку интерлейкина-10 при низком уровне продукции Th₁- и Th₁₇-цитокинов (Treg-профиль). Таким образом, разные штаммы бифидобактерий индуцировали либо противовоспалительные цитокины, либо провоспалительные медиаторы, при этом спектр последних тоже варьировал. Более того, инкубация с различными бактериальными штаммами по-разному изменяла способность дендритных клеток поляризовать дифференцировку незрелых T-клеток, определяя баланс субпопуляций CD4+-Т-клеток: Th₁/Th₁₇/Treg.
Напомним, что Th₁-клетки необходимы для иммунного ответа против вирусов и бактерий с внутриклеточным паразитированием (микоплазмы, хламидии, уреаплазмы и др.), Th₁₇ – против внеклеточных бактерий и грибов, тогда как Treg обеспечивают иммунную толерантность, то есть предотвращают избыточные иммунные реакции в отношении собственных и чужеродных субстанций.
В другой работе продемонстрированы различия иммуномодулирующих эффектов 4 штаммов лактобацилл и 2 штаммов бифидобактерий (Bifidobacterium longum SP 07/3 и Bifidobacterium bifidum MF 20/5) [78]. Все бактерии увеличивали экспрессию активационных маркеров на Т-клетках и естественных киллерах (NK), а также усиливали цитотоксическую активность последних. При этом лактобациллы стимулировали преимущественно продукцию цитокинов Th₁-профиля, а указанные штаммы бифидобактерий – противовоспалительных медиаторов. Примечательна способность Bifidobacterium longum SP 07/3 и Bifidobacterium bifidum MF 20/5 одновременно усиливать активность основных клеточных звеньев иммунной системы, участвующих в противовирусном ответе, и индуцировать толерогенные сигналы.
Вышесказанное свидетельствует о целесообразности использования в качестве иммуномодуляторов лишь тех пробиотиков, которые включают штаммы с экспериментально изученным и клинически доказанным иммунотропным действием. Подчеркнем, что иммуномодулирующая активность многих клинически используемых пробиотических штаммов исследована недостаточно либо не изучена вообще.
В случае использования симбиотиков, то есть комплексов пробиотических штаммов, необходимо учитывать возможность синергизма в реализации одних биологических эффектов и антагонизма – других, что требует дополнительных специальных исследований.
Эффективными признаны комбинации некоторых лактобацилл и бифидобактерий. Ярким примером является сочетание пробиотических штаммов Lactobacillus gasseri PA 16/8, Bifidobacterium bifidum MF 20/5 и Bifidobacterium longum SP 07/3. Такая комбинация при курсовом применении не только корригировала показатели клеточного иммунитета и увеличивала содержание бифидобактерий и лактобацилл в фекалиях испытуемых, но и предотвращала развитие и снижала выраженность респираторных инфекций в зимне-весенний период [79, 80]. Кроме того, штаммы Lactobacillus gasseri PA 16/8 и Bifidobacterium bifidum MF 20/5 проявляли существенный синергизм в подавлении 6 часто встречающихся в ЖКТ патогенов [81].
Выбор пробиотика для укрепления противоинфекционной защиты
Пробиотики существенно различаются не только по способности влиять на кишечную микробиоту, но и по иммунотропной активности. На эти различия влияют прежде всего свойства используемых пробиотических микробов, степень их защиты от агрессивных желудочных и дуоденальных факторов, а также наличие дополнительных ингредиентов, обеспечивающих эффективную реализацию биологических эффектов потребляемыми симбионтами.
Рациональные принципы выбора иммунотропного пробиотика освещены ранее [1]. К этим принципам можно добавить целесообразность использования только тех пробиотиков, которые соответствуют требованиям FAO/WHO [18], особенно по критериям безопасности.
Компания Merck KGaA (Германия) разработала и вывела на рынок безопасные и высокоэффективные пробиотики Бион®3 (для взрослых и подростков от 14 лет) и Бион®3 Кид (для детей от 4 до 14 лет), обладающие доказанной иммунотропной активностью и полностью отвечающие критериям FAO/WHO. Эти пробиотики включают в себя комбинацию Tribion Harmonis™ из трех тщательно подобранных штаммов симбионтных бактерий: Lactobacillus gasseri PA 16/8, Bifidobacterium bifidum MF 20/5 и Bifidobacterium longum SP 07/3. Об иммуномодулирующих свойствах этих штаммов и синергизме биологических эффектов при их сочетанном использовании уже говорилось выше.
В состав Бион®3, кроме того, входят пребиотик инулин, 12 витаминов и 12 макро- и микроэлементов, необходимых для полноценного функционирования иммунной системы. Бион®3 Кид по составу отличается тем, что из минеральных веществ включает только кальций, цинк и железо.
Помимо рационально подобранной комбинации 3 симбионтных штаммов и комплексного состава, важным слагаемым эффективности Бион®3 является запатентованная технология таблетирования: оригинальная трехслойная таблетка, покрытая защитной оболочкой, обеспечивает delayed release (замедленное высвобождение), а также гарантирует доставку пробиотических культур в нижние отделы ЖКТ живыми и высокую биодоступность других компонентов препарата.
Благодаря указанным свойствам Бион®3 хорошо зарекомендовал себя не только как средство для поддержания здорового баланса микробиоты ЖКТ, но и как иммуномодулятор с клинически и лабораторно доказанной эффективностью. Постепенно накапливается информация об иммуномодулирующей активности и клинических эффектах Бион®3 Кид.
Частые эпизоды острых респираторных вирусных инфекций (ОРВИ) являются важнейшим клиническим маркером недостаточности противоинфекционной защиты. Безопасность и стойкость иммунотропных эффектов, которыми характеризуются некоторые современные пробиотики, являются важнейшими качествами при выборе средства неспецифической сезонной профилактики ОРВИ.
В этой связи интерес представляют результаты двух проведенных в Германии крупных двойных слепых рандомизированных исследований эффективности Бион®3 как средства профилактики ОРВИ.
В одном из них (n = 477) у добровольцев, принимавших ежедневно по 1 таблетке Бион®3 в зимний или зимне-весенний период, в сравнении с таковыми, получавшими плацебо, существенно снижалось число случаев простудных заболеваний, общее количество дней с лихорадкой, число проявлений миалгии и головной боли при простудных заболеваниях, число проявлений конъюнктивита и случаев потери аппетита. Кроме того, обнаружена выраженная тенденция к снижению продолжительности простудных заболеваний, числа случаев гриппа, числа назальных, фарингеальных и бронхиальных симптомов [82].
Во втором исследовании, в котором участвовало 479 добровольцев, курсовой прием Бион®3 в зимне-весенний период сокращал на 2 дня среднюю длительность эпизодов простудных заболеваний и снижал выраженность их симптомов в сравнении с контрольной группой, в которой испытуемые принимали аналогичный мультивитаминно-мультиминеральный комплекс, но без пробиотических бактерий [79]. Это подтверждает ведущую роль в укреплении противоинфекционной защиты пробиотических штаммов в составе Бион®3, а значение витаминов и минералов в этом отношении заключается главным образом в создании благоприятных условий для реализации иммунотропных эффектов симбионтных бактерий.
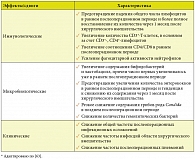
В обеих работах на фоне приема Бион®3 выявлены существенные иммунологические изменения, совокупность которых можно расценить как системную активацию врожденных и адаптивных, в первую очередь клеточных, звеньев иммунитета.
Основные иммуномодулирующие и клинические эффекты Бион®3, доказывающие его эффективность как надежного средства профилактики ОРВИ, по результатам двух исследований суммированы в таблице 3 [80, 81].
Известен факт развития у онкологических больных недостаточности противоинфекционной защиты в послеоперационном периоде, что связано как с основным заболеванием, так и с проводимым лечением. Периоперационная антибиотикопрофилактика и противомикробная терапия уже возникших инфекционных осложнений у этих больных подавляют резидентные кишечные бактерии, усугубляя иммунные нарушения.
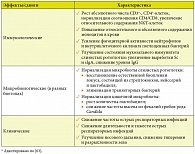
Учитывая вышесказанное, а также роль расстройств микробиоты в развитии и прогрессировании колоректального рака [82], изучено влияние Бион®3 на развитие послеоперационных инфекционных осложнений, иммунологические показатели крови и микробиоценоз кишечника у больных, оперированных по поводу рака толстой и прямой кишки [65]. В исследовании участвовало 50 больных, которые были рандомизированы на 2 группы по 25 человек. В контрольной группе пациенты получали стандартное лечение, включающее периоперационную антибиотикопрофилактику. В тест-группе больные, кроме того, получали Бион®3 по 1 таблетке в сутки в течение 5 дней до операции и 30 суток после нее, начиная с 5-го дня после операции. У пациентов, получавших Бион®3, снижалась частота развития инфекционных осложнений, что коррелировало с целым рядом положительных иммунологических и микробиологических сдвигов (табл. 4) [65].
Результаты этой работы доказывают способность Бион®3 усиливать противоинфекционную защиту у пациентов с исходным иммунодефицитным состоянием, а также нормализовать состояние кишечной микробиоты и увеличивать эффективность механизмов колонизационной резистентности у пациентов, оперированных по поводу колоректального рака. Принимая во внимание, что показатели клеточного иммунитета у больных со многими злокачественными опухолями являются критериями прогноза не только развития послеоперационных инфекционных осложнений, но и течения самого неопластического процесса [83–85], выявленные иммунотропные эффекты Бион®3 представляются многообещающими в плане прогноза основного заболевания.
Была проведена оценка эффективности и безопасности Бион®3 Кид в качестве средства профилактики респираторных инфекций у часто болеющих детей в возрасте 7–8 лет, которые находились на диспансерном наблюдении по месту жительства. Работа выполнена под руководством профессора Л.В. Феклисовой – руководителя отделения детских инфекционных болезней Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского. В исследование включен 61 ребенок, прибывший на оздоровительное лечение в Центральный детский клинический санаторий «Малаховка» в период максимального сезонного подъема заболеваемости острыми респираторными инфекциями. Включенные в исследование дети были рандомизированы на группу (n = 28), в которой проводился комплекс общепринятых оздоровительных мероприятий, и группу (n = 33), в которой этот комплекс дополняли приемом Бион®3 Кид по 1 жевательной таблетке ежедневно в течение 30 дней. Базисные оздоровительные мероприятия в санатории включали массаж, физиопроцедуры, лечебную физкультуру, посещение галокамеры, бассейна, потребление минеральной воды и кислородных коктейлей. Другие пробиотики и иммуномодуляторы в обеих группах не применялись. Подробное описание результатов этого исследования станет предметом отдельной научной публикации. Предварительные данные по клинико-лабораторной эффективности Бион®3 Кид у часто болеющих детей суммированы в таблице 5. Выявленный профилактический эффект Бион®3 Кид в отношении острых респираторных инфекций, сопровождающийся положительными иммунологическими и микробиологическими изменениями, подтверждает целесообразность использования этого препарата у часто болеющих детей с целью укрепления противоинфекционной защиты.
Заключение
Наблюдаемая в последние годы волна работ по изучению многогранных симбиотических взаимоотношений макроорганизма и колонизирующих его бактерий не оставляет повода для сомнений в важнейшей роли комменсалов в поддержании иммунного гомеостаза, а также в филогенетической и онтогенетической эволюции иммунной системы и поддержании иммунного гомеостаза хозяина. Это обусловило возможность поиска средств коррекции иммунных расстройств среди пробиотиков. Рост объемов потребления последних выдвинул на первый план вопрос об их безопасности. Соблюдение разработчиками и производителями требований контроля эффективности и безопасности, сформулированных авторитетными международными организациями, способствует появлению на рынке безопасных пробиотиков, которые могут служить действенным инструментом для укрепления противоинфекционной защиты. Однако пробиотики существенно различаются по иммунотропной активности, более того, влияние многих из них на противоинфекционную защиту не изучено. Бион®3 и Бион®3 Кид, являясь представителями последнего поколения комплексных пробиотиков, отвечающих требованиям FAO/WHO и обладающих доказанной иммунотропной активностью и клинической эффективностью, представляют собой средства выбора для профилактики респираторных инфекций и послеоперационных инфекционных осложнений у взрослых и детей.
Probiotics for anti-infectious protection in context of immunogomeostatic role of microbiota
O.V. Kalyuzhin
I.M. Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation, Chair of Clinical Immunology and Allergy
Contact person: Oleg Vitalyevich Kalyuzhin, kalyuzhin@list.ru
Several debating points concerning efficacy and safety of probiotics are discussed. Up-to-date information on the immunogomeostatic role of intestinal microbiota and use of viable bacterial cells for the restoration/correction of immune gomeostasis has been presented. Probiotics exhibiting properties of synbiotics and symbiotics and containing well-balanced vitamin and mineral complex have been described. Probiotics that meet international safety requirements and possess proven immunomodulatory activities and clinical efficacy are recommended for the correction of immune disorders in adult and infants and for the prevention of acute respiratory diseases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.