Комбинированная лекарственная терапия при синдроме слабости синусового узла
- Аннотация
- Статья
- Ссылки
- English



В последние годы одно из ведущих мест в структуре кардиологической патологии занимают нарушения ритма и проводимости сердца, которые часто наблюдаются у детей всех возрастов и даже здоровых детей, а не только у пациентов с заболеваниями сердечно-сосудистой системы [1, 2].
В норме у человека источником (водителем) ритма сердца является синусовый узел, расположенный субэпикардиально в верхней части правого предсердия в месте соединения верхней полой вены и наружного края правого предсердия. Пейсмекерные клетки синусового узла обладают функцией автоматизма: они спонтанно вырабатывают импульсы, которые затем последовательно распространяются по предсердиям, атриовентрикулярному узлу, системе Гиса – Пуркинье и рабочему миокарду желудочков. Нарушение автоматизма синусового узла, синоатриального и атриовентрикулярного проведения импульса приводит к снижению частоты сердечного ритма – брадикардии [3].
Такие нарушения сердечного ритма, как брадиаритмия, дисфункция синуcового узла, синдром слабости синусового узла, остаются наименее изученными в педиатрической практике, точные данные об их распространенности отсутствуют. Они протекают бессимптомно, поскольку клиническая симптоматика зависит не только от частоты сердечного ритма, но и от состояния церебральных сосудов, сократительной способности миокарда, способности сердечно-сосудистой системы поддерживать артериальное давление и коронарный кровоток. Кроме того, синусовый узел содержит множество кластеров пейсмекерных клеток, которые крайне редко повреждаются все одномоментно. Именно поэтому такая патология характеризуется медленно прогрессирующим течением с постепенным ухудшением показателей синусового ритма, что затрудняет раннюю диагностику, и в 40% случаев становится случайной находкой при проведении электрокардиографии [2–4].
Синдром слабости синусового узла – состояние, обусловленное снижением функциональной способности синусового узла выполнять функцию основного водителя ритма и/или обеспечивать регулярное проведение импульсов к предсердиям, что предопределяет появление выраженной брадикардии и сопутствующих эктопических аритмий [5].
Распространенность синдрома слабости синусового узла у детей варьируется от 2,9 до 30% общего числа всех нарушений ритма сердца [1, 2, 6, 7].
В оценке функции синусового узла основная роль до последнего времени принадлежала электрофизиологическим методам исследования. В качестве альтернативного неинвазивного метода диагностики синдрома слабости синусового узла широко используется суточное мониторирование электрокардиограммы [5, 8].
Лечение детей с синдромом слабости синусового узла остается серьезной проблемой [9, 10]. При высокой степени поражения синусового узла единственным методом профилактики фатальных осложнений остается имплантация электрокардиостимулятора, что в детском возрасте является проблематичным и дискуссионным. Поиск способов медикаментозной терапии у таких больных крайне актуален [10, 11].
При изучении проблемы формирования нарушения ритма и проводимости сердца с позиции клеточной патологии было установлено, что основная роль принадлежит мембранодестабилизирующим процессам в кардиомиоцитах, имеющих много общего с гипоксическими дистрофическими повреждениями. Это служит основанием для включения в схему лечения антигипоксантов и антиоксидантов [4, 12]. С помощью лекарственных препаратов, оптимизирующих использование энергетических субстратов миокардом, можно улучшить эффективность работы сердца – энергетическое обеспечение кардиомиоцита без изменений гемодинамических параметров сердечной деятельности (частота сердечных сокращений, коронарный кровоток, пред- и постнагрузка и т.д.) [13]. Одним из таких препаратов является оригинальный антигипоксант Цитохром С с тройным механизмом действия. Цитохром C выполняет функцию заместительной терапии, стимулирует пластические процессы в организме, служит катализатором клеточного дыхания, стимулирует окислительные реакции и тем самым активирует обменные процессы, уменьшает гипоксию тканей [14–16].
Цель – оценить клиническую эффективность применения препарата Цитохром С в составе комбинированной нейрометаболической и антигипоксантной терапии у детей с диагнозом синдрома слабости синусового узла.
Материал и методы
В отделении кардиологии и ревматологии на базе Государственного бюджетного учреждения здравоохранения Ставропольского края «Краевая детская клиническая больница» за период с 2021 по 2022 г. обследованы 26 детей (18 (69,2%) мальчиков, 8 (30,8%) девочек) с разными вариантами синдрома слабости синусового узла. Критерием включения было наличие одного из четырех клинико-электрокардиографических вариантов синдрома слабости синусового узла у детей, в соответствии с клиническими рекомендациями Минздрава России «Синдром слабости синусового узла у детей» [5]. Первый вариант отмечался у 15 (57,7%) детей, второй – у 9 (34,6%), третий – у 2 (7,7%) пациентов, четвертый вариант не наблюдался за время исследования. Распределение по возрасту было следующим: 4–6 лет – 1 (3,8%), 7–10 лет – 2 (7,7%), 11–14 лет – 10 (38,5%), 15–17 лет – 13 (50%) пациентов.
Обследование включало сбор жалоб, анамнестических данных, физикальный осмотр, стандартную электрокардиографию в положении лежа и после физической нагрузки (10–15 приседаний в зависимости от возраста), холтеровское мониторирование электрокардиограммы, эхокардиографическое исследование с анализом результатов на основании нормативных показателей, применяемых в педиатрии.
Дети были рандомизированы на две равные группы, сопоставимые по полу, возрасту и характеру клинико-электрокардиографического варианта синдрома слабости синусового узла. Пациенты первой группы получали комбинированную терапию с учетом симптоматики и жалоб во время стационарного обследования (10–12 дней). Пациентам второй группы к комбинированной терапии во время стационарного обследования (10–12 дней) добавляли Цитохром С (внутривенно капельно 4 мг на 100 мл 0,9%-ного раствора NaCl в течение десяти дней).
Результаты и обсуждение
Как показал анализ характера жалоб, 3 (11,5%) пациента не имели клинической симптоматики синдрома слабости синусового узла, предположение о нарушении функции синусового узла было сделано на основании результатов электрокардиографии в рамках планового обследования. Однократный эпизод синкопе наблюдался у 1 (3,8%) пациента, приступы учащенного сердцебиения – у 3 (11,5%). Другие жалобы носили неспецифический характер: утомляемость – 9 (34,6%) детей, головная боль – 8 (30,8%), кардиалгии – 7 (26,9%), слабость – 6 (23,1%), головокружение – 5 (19,2%) больных.
Отягощенный наследственный анамнез по нарушению ритма сердца наблюдался у 4 (15,4%) детей: брат/сестра и по линии матери – 2 (7,7%) пациента (внезапная сердечная смерть в детском возрасте, имплантация электрокардиостимулятора), по линии отца – 1 (3,8%) обследуемый (нарушение ритма сердца).
Согласно данным электрокардиограммы, в положении лежа синусовая брадикардия имела место у 10 (38,5%) пациентов, миграция водителя ритма – у 4 (15,4%), атриовентрикулярная блокада 1-й степени – у 1 (3,8%), синоатриальная блокада 1-й степени – у 1 (3,8%) пациента.
В отличие от стандартной электрокардиографии в положении лежа холтеровское мониторирование позволило выявить до и после курса лечения больший процент изменений.
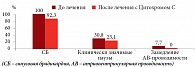
По данным холтеровского мониторирования электрокардиографии, в первой группе при первом клинико-электрокардиографическом варианте синдрома слабости синусового узла после курса лечения уменьшилось количество пациентов с миграцией водителя ритма (38,5%). Суправентрикулярные экстрасистолии сохранялись у 2 (15,4%) пациентов в том же количестве, их количество уменьшилось у 4 (30,8%) пациентов. Количество клинически значимых пауз, в соответствии с нормативными показателями для каждого возраста, не изменилось – 2 (15,4%) больных, но сократилась их продолжительность (рис. 1).
По данным холтеровского мониторирования электрокардиографии, во второй группе при первом клинико-электрокардиографическом варианте синдрома слабости синусового узла после курса терапии сократилось количество больных с синусовой брадикардией и клинически значимыми паузами, в соответствии с нормативными показателями для каждого возраста. У одного ребенка не выявлено замедления атриовентрикулярной проводимости. У других пациентов с клинически значимыми паузами (23,1%) их количество и продолжительность уменьшились. Суправентрикулярная и желудочковая экстрасистолии сохранялись, но в 100% случаев уменьшилось их количество (рис. 2).
По данным холтеровского мониторирования электрокардиографии, в первой группе при втором клинико-электрокардиографическом варианте синдрома слабости синусового узла после лечения не наблюдалось миграции водителя ритма или замедления атриовентрикулярной проводимости (по одному случаю). Количество клинически значимых пауз не изменилось, но уменьшилась их продолжительность, в соответствии с нормативными показателями для каждого возраста, – 53,8%. Суправентрикулярная экстрасистолия у пациентов сохранялась, но в 100% случаев уменьшилась ее частота за сутки. Обращал на себя внимание тот факт, что после курса терапии желудочковая экстрасистолия обнаружилась еще у одного ребенка (рис. 3).
Анализ холтеровского мониторирования электрокардиографии пациентов второй группы при втором клинико-электрокардиографическом варианте синдрома слабости синусового узла показал, что после курса терапии уменьшилось количество суправентрикулярных экстрасистол и клинически значимых пауз у 46,2% больных, в 100% случаев уменьшилась продолжительность пауз. У 15,4% не выявлена желудочковая экстрасистолия, у детей с сохранявшейся желудочковой экстрасистолией (23,1%) ее частота за сутки уменьшилась.
У одного мальчика атриовентрикулярная блокада 2-й степени Мобитц 1, выявленная по данным холтеровского мониторирования электрокардиографии, после терапии не проявилась, а обнаружилась атриовентрикулярная блокада 1-й степени (рис. 4).
У пациентов первой и второй групп при третьем клинико-электрокардиографическом варианте синдрома слабости синусового узла до и после лечения динамика состояния в целом не изменилась.
Документы двоих детей с третьим клинико-электрокардиографическим вариантом синдрома слабости синусового узла во время стационарного лечения в отделении кардиологии и ревматологии были направлены по системе телемедицинских консультаций в федеральный Детский научно-практический центр нарушений сердечного ритма для решения вопроса о необходимости и сроках имплантации электрокардиостимулятора.
Выводы
Свыше 11% детей с диагнозом синдрома слабости синусового узла с различными клинико-электрокардиографическими вариантами не имели клинической симптоматики заболевания, что требует обязательного проведения электрокардиографического скрининга.
Применение препарата Цитохром С в комбинированной нейрометаболической и антигипоксантной терапии у детей с диагнозом синдрома слабости синусового узла наиболее эффективно при первом и втором клинико-электрокардиографических вариантах.
T.G. Drepa, V.A. Karkhanina
Stavropol Regional Children's Clinical Hospital
Stavropol State Medical University
Contact person: Viktoriya A. Karakhina, viktoriyakarkh@mail.ru
Treatment of sinus node weakness syndrome in children is a subject of discussion, the search for ways of drug therapy is considered promising. The aim of this work was to evaluate the clinical efficacy of Cytochrome C as part of combined neurometabolic and antihypoxant therapy in the treatment of children diagnosed with sinus node weakness syndrome.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.