Корреляция тяжести течения врожденного буллезного эпидермолиза со степенью нутритивной недостаточности
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить тяжесть течения различных форм ВБЭ, наличие и степень нутритивной недостаточности, ее взаимосвязь с течением заболевания. Выявить основные метаболические показатели, которые могут служить для определения нутритивной недостаточности.
Материал и методы. В исследовании принимали участие 99 пациентов с простым (n = 22), пограничным (n = 10) и дистрофическим (n = 67) ВБЭ. Тяжесть течения ВБЭ оценивалась посредством Бирмингемского индекса тяжести ВБЭ (BEBS). Физическое развитие оценивалось с помощью программ ВОЗ Anthro и Anthro Plus. Дополнительно у пациентов определялись следующие метаболические показатели: альбумин, кальций, магний, железо, ферритин, С-реактивный белок (СРБ), витамины D и В12.
Результаты. Выявлены статистически значимые различия в показателях степени тяжести всех типов ВБЭ, в величинах Z-score WAZ, HAZ и BAZ, а также в основных метаболических показателях, таких как альбумин, кальций, магний, железо, СРБ и витамин D. Проведен анализ корреляции вышеперечисленных показателей, при котором выявлена обратная корреляция степени тяжести ВБЭ и антропометрических показателей, а также биохимических маркеров: альбумина, кальция, железа и витамина D.
Заключение. Установлено, что при более тяжелом течении ВБЭ выявляются более значимые отклонения в антропометрических и отдельных метаболических показателях. Для своевременной диагностики необходимо проводить оценку нутритивного статуса (в первую очередь уровень железа, кальция и витамина D) и метаболических показателей с учетом данных о тяжести течения заболевания, профилактики и лечения нарушений нутритивного статуса.
Цель – оценить тяжесть течения различных форм ВБЭ, наличие и степень нутритивной недостаточности, ее взаимосвязь с течением заболевания. Выявить основные метаболические показатели, которые могут служить для определения нутритивной недостаточности.
Материал и методы. В исследовании принимали участие 99 пациентов с простым (n = 22), пограничным (n = 10) и дистрофическим (n = 67) ВБЭ. Тяжесть течения ВБЭ оценивалась посредством Бирмингемского индекса тяжести ВБЭ (BEBS). Физическое развитие оценивалось с помощью программ ВОЗ Anthro и Anthro Plus. Дополнительно у пациентов определялись следующие метаболические показатели: альбумин, кальций, магний, железо, ферритин, С-реактивный белок (СРБ), витамины D и В12.
Результаты. Выявлены статистически значимые различия в показателях степени тяжести всех типов ВБЭ, в величинах Z-score WAZ, HAZ и BAZ, а также в основных метаболических показателях, таких как альбумин, кальций, магний, железо, СРБ и витамин D. Проведен анализ корреляции вышеперечисленных показателей, при котором выявлена обратная корреляция степени тяжести ВБЭ и антропометрических показателей, а также биохимических маркеров: альбумина, кальция, железа и витамина D.
Заключение. Установлено, что при более тяжелом течении ВБЭ выявляются более значимые отклонения в антропометрических и отдельных метаболических показателях. Для своевременной диагностики необходимо проводить оценку нутритивного статуса (в первую очередь уровень железа, кальция и витамина D) и метаболических показателей с учетом данных о тяжести течения заболевания, профилактики и лечения нарушений нутритивного статуса.





Введение
Врожденный буллезный эпидермолиз (ВБЭ) – это группа генетически и клинически гетерогенных заболеваний, характеризующихся склонностью к образованию пузырей и/или эрозий на коже и слизистых оболочках при минимальной травматизации [1]. ВБЭ возникает из-за нарушения синтеза белков кожи вследствие генетических мутаций в 16 генах. При ВБЭ аберрантные белки, которые расположены в зоне дермо-эпидермального соединения, не выполняют свои функции, что приводит к расслоению кожи между эпидермисом и дермой и сопровождается образованием пузырей. Заболевание может наследоваться как аутосомно-доминантно, так и аутосомно-рецессивно [2]. Выделяют четыре основных типа ВБЭ: простой, пограничный, дистрофический и синдром Киндлера [3]. Тяжесть течения ВБЭ может варьировать от легкой до крайне тяжелой. Лечение заболевания симптоматическое, включающее уход за кожей и раневыми поверхностями, адекватное обезболивание, нутритивную поддержку, а также профилактику и лечение осложнений [4]. В число последних, например, при дистрофическом ВБЭ часто входит поражение слизистых оболочек полости рта, что приводит к микростомии и анкилоглоссии; поражение слизистых оболочек пищевода с развитием стриктур [5]. Вследствие поражения слизистой оболочки глаз развиваются эрозии роговицы, что может приводить к необратимой потере зрения [6]. При пограничном и дистрофическом типах ВБЭ, а также при синдроме Киндлера высок риск поражения органов мочеполовой системы с развитием стриктур уретры [7, 8]. Частым осложнением тяжелых форм ВБЭ является деформация конечностей с развитием контрактур крупных суставов и сращением пальцев стоп и кистей [9–11]. Для оценки тяжести течения ВБЭ используется Бирмингемский индекс тяжести буллезного эпидермолиза (Birmingham EB Severity score, BEBS), позволяющий оценить состояние ногтевых пластин, распространенность кожного патологического процесса, наличие и степень поражения слизистых оболочек, деформации конечностей, риск плоскоклеточной карциномы кожи, наличие и распространенность рубцовой алопеции, а также состояние питания пациента [12]. Данная шкала дает соответствующие оценки по формам ВБЭ, отражает изменения тяжести заболевания с течением времени и является легко воспроизводимой [13]. В нашем исследовании тяжесть течения ВБЭ определяется исходя из суммарных баллов шкалы BEBS: 0–20 баллов – легкая степень тяжести, 21–45 баллов – средняя степень тяжести, более 46 баллов – тяжелая степень тяжести.
Множественные осложнения ВБЭ в совокупности с тяжестью кожного процесса приводят к развитию нутритивной недостаточности и, как следствие, к развитию анемии [14], вторичного остеопороза [15], задержке роста и полового созревания [16, 17].
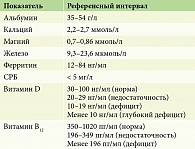
Нутритивная недостаточность при ВБЭ является многофакторной проблемой и возникает из-за дисбаланса между потребностями в питательных веществах и их поступлением в организм. Выраженность нарушений питания и недостатка основных питательных веществ и энергии прямо пропорциональна степени тяжести ВБЭ, что типично для дистрофического и пограничного типов болезни из-за потери белка, электролитов и других компонентов крови вследствие большой площади поражения кожи [18]. При простом ВБЭ и синдроме Киндлера белково-энергетическая недостаточность менее выражена [19–21]. Одним из основных методов оценки белково-энергетической недостаточности и нутритивного статуса является антропометрия, которая применяется для оценки физического развития и проводится с помощью специализированного пакета прикладных программ ВОЗ Anthro и Anthro Plus. Для определения соответствия массы тела, длины или роста и индекса массы тела по отношению к возрасту используется показатель Z-score (отклонение значений индивидуального показателя (массы тела или роста) от стандартного значения в данной популяции). При оценке нарушений нутритивного статуса учитывают следующие величины Z-score: масса тела для возраста (WAZ), длина тела (рост) для возраста (HAZ), индекс массы тела для возраста (BAZ). Дефицит массы тела (WAZ) или недостаточный рост (HAZ) ребенка соответствуют Z-score < -2 SD, что может свидетельствовать о хронической белково-энергетической недостаточности. Высокий показатель роста или длины тела обозначается величиной HAZ > +2 SD. Избыточная масса тела оценивается как WAZ > 2 SD, а также BAZ > 1 SD. Пациенты с Z-score массы тела в интервале от -1 до -2, согласно рекомендациям, рассматриваются как дети с легкой степенью недостаточности питания. BAZ в интервале от -2 до -3 соответствует недостаточности питания средней степени, ниже -3 – тяжелой недостаточности питания (табл. 1) [22, 23].
Наряду с определением антропометрических показателей для оценки нутритивной недостаточности используют лабораторное определение концентрации альбумина и других короткоживущих белков (преальбумин, трансферрин, ретинолсвязывающий белок и церулоплазмин) в крови [24]. Известно, что на данные показатели могут оказывать влияние такие факторы, как системное воспаление и инфекции, а также печеночная и почечная недостаточность, в связи с чем данные маркеры могут не полностью отражать наличие и степень недостаточности в организме макро- и микронутриентов [25].
На сегодняшний день ввиду редкости ВБЭ представлено мало исследований корреляции степени тяжести ВБЭ и степени нутритивной недостаточности, а данные о метаболических показателях для оценки нутритивных рисков при ВБЭ ограничены содержанием сывороточных белков. Вследствие многофакторного генеза заболевания изменения процессов метаболизма и тяжесть состояния кожного покрова играют крайне важную роль в оценке белково-энергетической недостаточности у пациентов с ВБЭ, поэтому данный вопрос является актуальным для изучения.
Цель и задачи – провести оценку тяжести течения различных форм ВБЭ, определить наличие и степень нутритивной недостаточности и ее взаимосвязь с тяжестью течения заболевания, выявить основные метаболические показатели, которые могут служить для определения нутритивной недостаточности.
Материал и методы
Проведено ретроспективное одномоментное исследование. В исследование включали данные пациентов, госпитализированных в отделение дерматологии с группой лазерной хирургии Национального медицинского исследовательского центра здоровья детей (г. Москва) в период с октября 2020 г. по июль 2021 г. Критерии включения: пациенты от трех до 18 лет обоего пола с простой, пограничной или дистрофической формой ВБЭ. Критерии невключения: пациенты с синдромом Киндлера. Диагноз устанавливали на основании записей в историях болезни пациентов.
Оценку тяжести течения заболевания проводили с помощью расчета Бирмингемского индекса тяжести буллезного эпидермолиза. Оценку показателей физического развития проводили с использованием компьютерной программы ВОЗ Antro Plus и индексов Z-score: массы тела (WAZ), роста (HAZ), индекса массы тела (BAZ). Дополнительно у пациентов оценивали следующие метаболические показатели: альбумин, кальций, магний, железо, ферритин, С-реактивный белок (СРБ), витамин D и витамин В12. Все лабораторные исследования проведены в централизованной клинико-диагностической лаборатории с группой экспресс-диагностики лабораторного отдела Национального медицинского исследовательского центра здоровья детей, референсные значения показателей крови приведены в табл. 2.
Данные о значении показателей были взяты из историй болезни пациентов в первый день стационарного лечения.
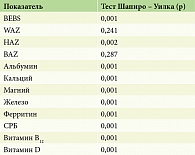
Статистический анализ проводили при помощи языка программирования Python и встроенных библиотек Pandas (для операций с числовыми таблицами), NumPy (для математических вычислений), scipy (для выполнения статистических расчетов), matplotlib, seaborn (обе библиотеки используются для визуализации данных). Данные использованы в виде среднего арифметического значения (mean) со среднеквадратичным отклонением и квартилей 25 и 75% [Q1; Q3] для переменных с нормальным распределением. Для переменных, распределение которых отличалось от нормального, данные описаны в виде медианы (Ме) и процентилей (25 и 75%). В ходе статистического анализа предварительно проверяли нормальность распределения показателей с помощью теста Шапиро – Уилка. Использовали традиционные гипотезы: нулевая гипотеза Н0 – распределение данных подчиняется закону нормального распределения, альтернативная гипотеза Н1 – распределение не подчиняется закону нормального распределения. Если р < 0,05, тогда H0 отвергалась и принималась альтернативная гипотеза об отсутствии нормальности распределения. Статистически значимую разницу показателей между группами определяли по критерию Краскела – Уоллиса, который используется для сравнения трех и более выборок. Применяли гипотезы: нулевая гипотеза Н0 – разница в исследуемых показателях между группами отсутствует, альтернативная гипотеза Н1 – исследуемые показатели в группах отличаются.
Проведение исследования одобрено локальным этическим комитетом Национального медицинского исследовательского центра здоровья детей (протокол № 12 от 23.12.2022).
Результаты
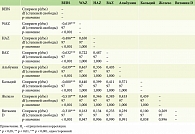
В исследовании принимали участие 22 пациента с простым ВБЭ, 10 пациентов с пограничным ВБЭ и 67 пациентов с дистрофическим ВБЭ. У всех пациентов проводили оценку степени тяжести ВБЭ с помощью Бирмингемского индекса тяжести ВБЭ, физического развития с помощью программ ВОЗ Anthro и Anthro Plus и оценку отдельных метаболических показателей: уровень альбумина, кальция, магния, железа, ферритина, СРБ, витамина D и витамина В12. Результаты проверки исследуемых метаболических показателей на нормальность распределения приведены в табл. 3. Значения Бирмингемского индекса тяжести ВБЭ, антропометрических и метаболических показателей пациентов с простой, пограничной и дистрофической формами ВБЭ представлены в табл. 4.
Течение простого ВБЭ обычно не характеризуется наличием проявлений со стороны внутренних органов и систем организма, зачастую ограничивается только поражением кожного покрова. Бирмингемский индекс тяжести ВБЭ у детей с простой формой ВБЭ находился в диапазоне от 0 до 20 баллов, медиана составила 2,5 балла [2; 7,3], что соответствует легкой степени тяжести ВБЭ. При анализе антропометрических показателей в группе пациентов с простым ВБЭ ожирение было выявлено у 9 пациентов (WAZ > 2, BAZ > 1), хроническая белково-энергетическая недостаточность (HAZ < -2) диагностирована у одного пациента, легкая степень недостаточности питания выявлена у двух пациентов. Исследуемые метаболические показатели находились в нормальных пределах, за исключением уровня железа, который был снижен у шести пациентов (Ме 14,21 [8,7; 22,63]).
У детей с пограничной формой ВБЭ медиана индекса BEBS соответствовала 12 [9,2; 13,5], что больше, чем при простом ВБЭ, однако также соответствует легкому течению. Увеличение медианы индекса BEBS связано с поражением слизистых оболочек и наличием недостаточности питания в данной группе пациентов: острая белково-энергетическая недостаточность (WAZ < -2) отмечалась у трех пациентов с пограничным ВБЭ, хроническая белково-энергетическая недостаточность (HAZ < -2) – также у трех пациентов. При оценке метаболических показателей у данной категории больных выявлено снижение уровня витамина D (Ме 33,04 [22,89; 38,15]), недостаточность и дефицит витамина D выявлены у трех и двух пациентов соответственно. Медиана уровня витамина В12 составила 521,5 [268,45; 614,55], недостаточность выявлена у одного пациента, дефицит цианокобаламина выявлен у двух пациентов, что может быть связано с ограничением в рационе пациентов белков животного происхождения из-за поражения слизистой оболочки полости рта и пищевода, а также поражения зубочелюстной системы в виде множественного кариеса и дистрофии эмали.
При обследовании пациентов с дистрофической формой ВБЭ медиана индекса BEBS составила 33 балла [24,8; 38,7], что соответствует среднетяжелому течению ВБЭ. При этом суммарные баллы BEBS 0–20 наблюдались у девяти пациентов, 21–45 баллов – у 50 пациентов и более 46 баллов – у восьми пациентов. Легкая степень тяжести, выявленная у девяти пациентов, вероятно, обусловлена отсутствием поражения слизистых оболочек и наличием ограниченного кожного патологического процесса на момент осмотра. При оценке антропометрических показателей в данной группе пациентов тяжелая степень недостаточности питания (BAZ < -3) выявлена у 18 человек, средняя степень (BAZ > -3, но < -2) – у 12 человек и недостаточность питания легкой степени (BAZ > -2, но < -1) отмечалась у 17 человек. Стоит отметить, что при этом острая белково-энергетическая недостаточность (WAZ < -2) была отмечена у 23 пациентов, а хроническая белково-энергетическая недостаточность (HAZ < -2) – у 20 пациентов. При исследовании метаболических показателей в группе пациентов с дистрофическим ВБЭ отмечались явные отклонения от нормы следующий маркеров: альбумина (Ме 37,8 [32,49; 40,77]), железа (Ме 6,43 [3,23; 13]), СРБ (Ме 8,19 [1,76; 31,15]), витамина В12 (Ме 489,4 [340,95; 615,05]) и витамина D (Ме 27,85 [15,6; 37,87]). Гипоальбуминемия встречалась у 22 пациентов с дистрофическим ВБЭ, дефицит железа – у 38 пациентов, повышение СРБ – у 39 пациентов, недостаточность витамина В12 выявлена у 11 пациентов, дефицит витамина В12 – у четырех пациентов, у девяти человек отмечалась недостаточность витамина D, дефицит витамина D – у 22 человек, глубокий дефицит витамина D – у шести пациентов. При исследовании уровня кальция в сыворотке крови медиана составила 2,3 [2,2; 2,4], гипокальциемия отмечена у 15 пациентов. Медиана уровня магния составила 0,84 [0,79; 0,9], снижение уровня магния выявлено у четырех пациентов с дистрофической формой ВБЭ.
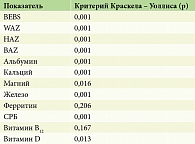
После обработки показателей BEBS, антропометрии и результатов лабораторных исследований с определением статистически значимой разницы между медианами трех групп пациентов с простым, дистрофическим и пограничным ВБЭ с использованием критерия Краскела – Уоллиса были выявлены статистически значимые различия в показателях BEBS, WAZ, HAZ и BAZ, а также во всех исследуемых показателях метаболического обмена, за исключением ферритина и витамина В12 (табл. 5).
Для определения корреляции между степенью тяжести течения ВБЭ (показатель BEBS), оценкой недостаточности питания (показатели WAZ, HAZ и BAZ), а также отклонениями метаболических маркеров использовали расчет коэффициента корреляции Спирмена. По результатам статистических расчетов выявлена обратная корреляция между показателем BEBS и антропометрическими показателями WAZ, HAZ и BAZ (р < 0,001), а также с такими метаболическими показателями, как альбумин, кальций, железо и витамин D. Значения р представлены в табл. 6.
Таким образом, выявлены статистически значимые различия в показателях степени тяжести простого, пограничного и дистрофического типов ВБЭ, в величинах Z-score WAZ, HAZ и BAZ, а также в основных метаболических показателях, таких как альбумин, кальций, магний, железо, СРБ и витамин D. Проведен анализ корреляции вышеперечисленных показателей, при котором выявлена обратная корреляция степени тяжести ВБЭ и антропометрических показателей, а также биохимических маркеров: альбумина, кальция, железа и витамина D. Результаты исследования позволяют говорить о том, что чем более тяжело протекает ВБЭ, тем более явные отклонения в антропометрических и отдельных метаболических показателях мы можем увидеть.
В нашей работе подтверждена необходимость исследования уровня альбумина для диагностики недостаточности питания, однако наряду с альбумином немаловажным является оценка уровня кальция, магния, железа, СРБ и витамина D. Результаты нашего исследования подтверждают, что метаболические показатели, которые используются для оценки белково-энергетической недостаточности, должны трактоваться с учетом дополнительных факторов, таких как тяжесть течения заболевания, распространенность кожного процесса и данные антропометрии.
Обсуждение
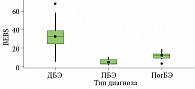
ВБЭ – тяжелый генодерматоз, сопровождающийся не только поражением кожи, но и осложнениями со стороны других органов и систем организма. Обширность кожного процесса в виде эрозий и язв, наличие вторичной инфекции и хронического воспаления вследствие нарушения процесса заживления ран могут приводить к развитию дефицита макро- и микронутриентов. Наряду с характеристиками кожного процесса необходимо учитывать наличие и степень поражения слизистых оболочек полости рта и пищевода, состояние кистей на предмет деформации и, если она имеется, ее степень, риск плоскоклеточной карциномы кожи и состояние питания пациента. Все эти параметры учитывает Бирмингемская шкала тяжести ВБЭ. По результатам проведенного исследования в группе пациентов с простым и пограничным ВБЭ оценка BEBS соответствовала легкому течению заболевания, при этом медианы показателя в данных группах отличались почти в пять раз. В группе пациентов с дистрофическим ВБЭ медиана оценки BEBS соответствовала средней степени тяжести ВБЭ, однако при этом легкое течение заболевания наблюдалось у девяти пациентов, тяжелое течение заболевания – у восьми пациентов. При обработке показателей BEBS в группах с простым, пограничным и дистрофическим ВБЭ выявлены статистически значимые различия в тяжести течения заболевания с уровнем р = 0,001. Распределение показателя индекса BEBS по формам ВБЭ представлено на рис. 1.
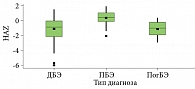
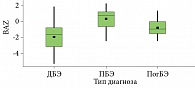
Оценка состояния питания пациентов с ВБЭ показала статистически значимые различия в группах пациентов с простым, пограничным и дистрофическим ВБЭ с уровнем р < 0,001 показателей WAZ, HAZ и BAZ. Распределение показателей WAZ, HAZ и BAZ по формам ВБЭ представлено на рис. 2–4.
Наше исследование подтверждает очевидные нарушения питания у пациентов с дистрофической формой ВБЭ, у 47 человек из данной группы пациентов выявлена та или иная степень нутритивной недостаточности. Обращает на себя внимание то, что в группе пациентов с простой формой ВБЭ у девяти человек было выявлено ожирение, что, вероятно, связано с ограничением подвижности из-за поражения кожи стоп в виде пузырей и участков гиперкератоза [9].
Дополнительная оценка метаболических показателей показала достоверные различия в уровнях альбумина, кальция, магния, железа, СРБ и витамина D у пациентов с простым, пограничным и дистрофическим ВБЭ (р < 0,005).
Статистически значимые различия в уровне альбумина у пациентов с простой и дистрофической формой ВБЭ были ранее показаны в нескольких отечественных исследованиях, проведенных в Национальном медицинском исследовательском центре здоровья детей [26, 27]. Снижение уровня альбумина отмечалось в группе пациентов с дистрофическим ВБЭ (n = 22), также мы включили пациентов с пограничной формой ВБЭ, у которых не наблюдалось статистически значимого снижения уровня альбумина.
Гипокальциемия выявлена также у пациентов с дистрофическим ВБЭ (n = 15). Снижение уровня магния отмечено как при пограничной (n = 1), так и при дистрофической форме ВБЭ (n = 4). СРБ был значимо повышен у пациентов с дистрофическим ВБЭ (n = 39), что свидетельствует о наличии очагов хронического воспаления и инфицированных эрозий. Отдельно стоит отметить уровень содержания в крови железа, снижение которого встречалось как при дистрофическом, так и при простом ВБЭ. Так, при простом ВБЭ снижение железа отмечалось у шести человек, а при дистрофическом – у 38 человек. Данные результаты подтверждают вероятность развития анемии у пациентов с простой формой ВБЭ [24].
Пациенты с дистрофической формой ВБЭ подвержены риску развития остеопороза из-за снижения подвижности, задержки полового созревания, наличия очагов воспаления, низкого индекса массы тела и недостаточного потребления кальция и витамина D.
По результатам исследования уровня витамина D выявлено наличие недостаточности и дефицита витамина D при пограничном и дистрофическом ВБЭ: недостаточность диагностирована у трех пациентов с пограничным и у девяти человек с дистрофическим ВБЭ, дефицит – у двух пациентов с пограничным и у 22 пациентов с дистрофическим ВБЭ, глубокий дефицит – у шести пациентов с дистрофической формой ВБЭ. При этом гипокальциемия выявлена также у пациентов с дистрофическим ВБЭ (n = 15). Определение уровня витамина D и кальция у пациентов с пограничной формой ВБЭ впервые проведено в нашем исследовании, согласно результатам которого пациенты данной категории также имеют риск развития остеопороза. Наша работа подтверждает необходимость исследования остеотропных нутриентов для своевременного выявления, профилактики и лечения остеопении и остеопороза при дистрофическом ВБЭ [28].
В ходе исследования корреляции состояния питания, степени тяжести ВБЭ и отдельных метаболических показателей выявлена обратная корреляция между показателем BEBS и антропометрическими показателями WAZ, HAZ и BAZ (р < 0,001), а также с такими метаболическими показателями, как альбумин, кальций, железо и витамин D (см. табл. 6). Эти данные свидетельствуют о том, что при увеличении показателя BEBS снижаются Z-score антропометрических показателей и концентрация альбумина, кальция, железа и витамина D. Зависимость антропометрических показателей от индекса BEBS отражена на рис. 5.
Корреляция содержания альбумина, кальция, железа и витамина D со степенью тяжести ВБЭ согласно показателю BEBS отражена на рис. 6.
Результаты нашего исследования подтверждают, что метаболические показатели, используемые для оценки белково-энергетической недостаточности, должны трактоваться с учетом дополнительных факторов, таких как тяжесть течения заболевания, распространенность кожного процесса и данные антропометрии.
Заключение
Пациентам с ВБЭ, помимо состояния кожного покрова, необходимо проводить оценку состояния слизистых оболочек, функциональных особенностей состояния кистей и состояния питания с помощью такого доступного инструмента, как Бирмингемский индекс тяжести буллезного эпидермолиза. Оценка нутритивного статуса и метаболических показателей должна проводиться с учетом данных о тяжести течения заболевания для своевременной диагностики, профилактики и лечения белково-энергетической недостаточности и нарушений нутритивного статуса. Для оценки нутритивного статуса, помимо исследования уровня альбумина и преальбумина, немаловажными показателями являются железо, кальций и витамин D. Диагностика белково-энергетической недостаточности крайне важна для пациентов с ВБЭ. Несмотря на то что нутритивные нарушения характерны для дистрофической и пограничной форм ВБЭ, они также могут наблюдаться и у детей с простой формой ВБЭ. К сожалению, недостаточность питания при дистрофическом и пограничном ВБЭ редко поддается корректировке только при помощи сбалансированного питания и назначения дополнительных пищевых добавок из-за многофакторного генеза этого состояния. Вместе с тем своевременная компенсация белково-энергетической недостаточности и дефицита микроэлементов крайне важна для симптоматического лечения ВБЭ, повышения качества жизни и снижения рисков ранней инвалидизации у данной категории пациентов.
O.S. Orlova, N.N. Murashkin, PhD, Prof., S.G. Makarova, PhD, Prof.
National Medical Research Centre for Children’s Health, Moscow
State Research Clinical Institute of Childhood, Moscow
Charitable Foundation “BELA. Butterfly Children”, Moscow
I.M. Sechenov First Moscow State Medical University
Central State Medical Academy of Department of Presidential Affairs, Moscow
Lomonosov Moscow State University
Contact person: Olga S. Orlova, orlova@deti-bela.ru
Congenital epidermolysis bullosa (СЕВ) is a group of genetically and clinically heterogeneous diseases characterized by a tendency to form blisters and/or erosions on the skin and mucous membranes with minimal trauma. Multiple complications of СЕВ in combination with the severity of the skin process lead to the development of nutritional insufficiency and, as a consequence, to the development of anemia, secondary osteoporosis, growth retardation and puberty.
Purpose of the study: to assess the severity of the course of various forms of СЕВ, the presence and degree of nutritional insufficiency, its relationship with the course of the disease. To identify the main metabolic indicators that can serve to determine nutritional insufficiency.
Material and methods. The study involved 99 patients with simple (n = 22), junctional (n = 10) and dystrophic (n = 67) СЕВ. The severity of СЕВ was assessed using the Birmingham Epidermolysis Bullosa Severity Score (BEBS). Physical development was assessed using the WHO Anthro and AnthroPlus programs. Additionally, the following metabolic parameters were determined in patients: albumin, calcium, magnesium, iron, ferritin, C-reactive protein, vitamin D and vitamin B12.
Results. Statistically significant differences were revealed in the severity of all types of СЕВ, in the values of Z-score WAZ, HAZ and BAZ, as well as in the main metabolic parameters such as albumin, calcium, magnesium, iron, C-reactive protein and vitamin D. The correlation analysis of the above indicators was carried out, which revealed an inverse correlation of the severity of СЕВ and anthropometric indicators, as well as biochemical markers: albumin, calcium, iron and vitamin D.
Conclusions. The results of the study show that the more severe CEB is, the more obvious deviations in anthropometric and individual metabolic indicators can be seen. Assessment of nutritional status and metabolic parameters should be carried out taking into account data on the severity of the disease for timely diagnosis, prevention and treatment of nutritional status disorders. Important indicators for assessing nutritional status are iron, calcium and vitamin D.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.