количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Клинические случаи
Возможности применения препарата Мильгамма композитум в лечении нейропатии в общей врачебной практике
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №6
- Аннотация
- Статья
- Ссылки
Диабетическая полинейропатия (ДПН) – тяжелое осложнение сахарного диабета.
Лечение ДПН – один из наиболее важных вопросов современной диабетологии.
В статье рассматриваются современные возможности лечения ДПН с использованием патогенетической и симптоматической терапии.
Диабетическая полинейропатия (ДПН) – тяжелое осложнение сахарного диабета.
Лечение ДПН – один из наиболее важных вопросов современной диабетологии.
В статье рассматриваются современные возможности лечения ДПН с использованием патогенетической и симптоматической терапии.
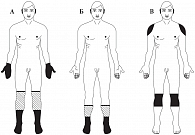
Рис. Распределение симптомов при различных вариантах диабетической нейропатии: А – дистальная полинейропатия с вовлечением толстых волокон, Б – дистальная полинейропатия с вовлечением тонких волокон, В – проксимальная полинейропатия
В настоящее время, по данным различных эпидемиологических исследований, отмечается быстрое увеличение количества больных сахарным диабетом (СД). По расчетам специалистов, к 2025 г. их число может превысить 380 млн (около 6% населения земного шара). Предполагается, что заболеваемость СД будет возрастать как в развитых, так и в развивающихся странах. Благодаря современным методам лечения многие пациенты с СД живут полноценной жизнью, сохраняя высокую профессиональную активность.
Однако нередко СД приводит к ранней инвалидизации и смерти по причине развития поздних сосудистых осложнений заболевания, в числе которых микроангиопатии (ретинопатия и нефропатия), макроангиопатии (инфаркт миокарда, инсульт, гангрена нижних конечностей) и нейропатии, чем обусловлена большая социальная значимость СД. В настоящее время принята следующая классификация нейропатии:
I. Поражение центральной нервной системы.
- Энцефалопатия.
- Миелопатия.
II. Поражение периферической нервной системы.
1. Диабетическая полинейропатия:
- cенсорная форма (симметричная, несимметричная);
- моторная форма (симметричная, несимметричная);
- сенсомоторная форма (симметричная, несимметричная).
2. Диабетическая мононейропатия (изолированное поражение проводящих путей черепных или спинномозговых нервов).
3. Автономная (вегетативная) нейропатия:
- сердечно-сосудистая форма;
- гастроинтестинальная форма;
- урогенитальная форма;
- бессимптомная гипогликемия;
- другие.
Диабетическая полинейропатия (ДПН) – одно из наиболее часто встречающихся поздних осложнений СД 1 и 2 типов [1], в его основе лежит сегментарная демиелинизация и аксональная дегенерация. По данным различных авторов, частота ДПН колеблется от 15 до 100% и прогрессивно нарастает по мере увеличения длительности и степени тяжести СД [2]. Риск развития ДПН повышается на 10–15% на каждый ммоль/л подъема уровня гликемии натощак или 1% уровня HbA1c [3]. Существуют две взаимодополняющие теории развития ДПН: метаболическая и сосудистая. Некоторые ученые предполагают, что на ранних стадиях развития нейропатии преобладают метаболические факторы, а на поздних стадиях – сосудистые изменения [4].
В основе метаболической теории лежит активизация полиолового пути обмена глюкозы, ведущего к повышению синтеза сорбитола из глюкозы под действием фермента альдозоредуктазы. Далее под действием сорбитолдегидрогеназы из сорбитола образуется фруктоза. В норме только 1–2% глюкозы превращается в сорбитол, а в условиях гипергликемии активность этого перехода увеличивается в 7–10 раз. В некоторых исследованиях показано, что стимуляция этого пути приводит к снижению интраневрального кровотока и развитию хронической гипоксии. Активизация полиолового пути влияет на внутриклеточное образование оксида азота, вызывая снижение концентрации данного высокоактивного радикала, вследствие чего уменьшается интраневральный кровоток и происходит замедление скорости проведения возбуждения по нервному волокну.
При микроциркуляторных нарушениях увеличивается образование конечных продуктов гликирования, приводящих к нарушению структуры базальной мембраны капилляров [4]. В то же время в больших количествах образуются липопротеиды низкой плотности, которые накапливаются в сосудистой стенке; происходит пролиферация гладкомышечных клеток. Под влиянием перекисного окисления липидов образуются свободные радикалы, которые обладают деструктивным действием в отношении эндотелия, а также уменьшают синтез простациклина, обладающего сосудорасширяющими свойствами и являющегося физиологическим ингибитором агрегации тромбоцитов [5].
При СД снижается уровень основных жирных кислот, что способствует недостаточной и неадекватной регенерации нерва и его различным структурным изменениям, в частности аксональной атрофии. Некоторые авторы [6] описывают клинические случаи, при которых у пациентов на фоне длительно существующей гипергликемии не отмечалось каких-либо признаков ДПН. В связи с этим возникло предположение о возможности существования генетической предрасположенности к данному осложнению СД. Отмечено, что частые эпизоды тяжелой гипогликемии также могут быть ассоциированы с демиелинизацией нервного волокна и изменениями передних рогов серого вещества спинного мозга [6].
Клинически ДПН проявляется характерной неврологической симптоматикой, отражающей чувствительные, двигательные и вегетативно-трофические нарушения. ДПН характеризуется наличием жгучих, симметричных, стойких болей, чаще в дистальных отделах нижних конечностей. Со временем в процесс вовлекаются и верхние конечности (рис.) [7].
Одновременно с болевым синдромом или предшествуя ему возникает нарушение чувствительности: симметричное, дистальное в виде «носков» и «перчаток». Нарушения чувствительности разнообразны: гипестезия (снижение поверхностной чувствительности), дизестезия (извращение чувствительности, при котором, например, холод воспринимается как тепло и т.п.), гиперестезия с оттенком гиперпатии (повышением порогов восприятия). Нередко обнаруживаются нарушения температурной и вибрационной чувствительности, а также мышечно-суставного чувства. Самым частым и ранним объективным симптомом ДПН является снижение или исчезновение сухожильных и периостальных рефлексов, чаще коленных и ахилловых. Помимо общеизвестных клинико-неврологических проявлений ДПН клиницисты довольно часто сталкиваются с проблемой полимононейропатии, когда пациент поступает с периферическим поражением одного или двух черепных нервов или одного из нервов конечностей на фоне ДПН. Следует обратить внимание на то, что в 10–18% случаев пациенты впервые узнают, что больны СД, когда оказываются в отделениях гнойной хирургии с осложненными формами дибетической стопы [8].
Лечебно-профилактические мероприятия при ДПН должны начинаться как можно раньше. При этом основным методом профилактики и лечения ДПН является компенсация углеводного обмена. Показанием к назначению медикаментозной терапии является наличие у пациента болевой формы ДПН (острой или хронической). Однако в исследовании EURODIAB IDDM Complications (Европейское исследование осложнений инсулинзависимого сахарного диабета) показано, что должная нормализация гликемии при СД после длительного периода гипергликемии не предупреждает развитие ДПН, это явление называют «гипергликемической памятью» [9].
Доказано, что высокие уровни глюкозы могут определять риск будущих осложнений диабета. Даже последующее продолжительное снижение уровня глюкозы в крови не влияет на скорость развития осложнений. Этот феномен также наблюдается у больных СД 2 типа, и для них концепция гипергликемической памяти может быть даже более важной с учетом отсроченного установления диагноза. В большинстве случаев СД 2 типа диагностируют лишь через 8–10 лет после появления первых признаков заболевания, сопровождающихся гипергликемией различной степени тяжести.
Механизмы гипергликемической памяти реализуются в митохондриях, сопровождая процессы окислительного стресса. Активная форма глюкозы метилглиоксаль является важным гликирующим веществом в физиологических системах и обладает высокой тропностью к белкам митохондрий. В результате гликирования белков образуются конечные продукты гликирования (AGE-(advanced glycation endproduct)-продукты), которые нарушают функционирование дыхательной цепи в митохондриях шванновских клеток нервных волокон. Избыточное образование AGE-продуктов – необратимый процесс [9].
Конечные продукты гликирования связываются со специфическим рецептором RAGE, определяющим гипергликемическую память и приводящим к окислительному стрессу. Образование связей AGE-продуктов с RAGE-рецепторами приводит к нарушению окислительно-восстановительного баланса клеток и избыточному образованию активных форм кислорода (свободных радикалов), которые вызывают повреждение митохондриальной ДНК и являются пусковым механизмом гибели нервных клеток. Таким образом, существование феномена гипергликемической памяти предполагает патогенетический подход к терапии ДПН, при котором лечение должно быть направлено на блокирование образования AGE-продуктов в нервной ткани.
G. Jermendy (1995) отмечает снижение концентрации тиамина (витамина B1) у больных с ДПН [10]. Физиологически активная форма пиридоксина (витамина B6) – пиридоксальфосфат – обладает коферментным и метаболическим эффектами, влияя на структуру и функцию нервной ткани, обеспечивает нормализацию белкового обмена и препятствует накоплению избыточных количеств нейротоксичного аммиака, что приводит к оптимизации деятельности нервной системы. Пиридоксин также увеличивает запасы магния внутри клетки, что является важным фактором, участвующим в энергетических процессах и нервной деятельности. Анальгетическое действие B6 обусловлено его влиянием на обмен нейромедиаторов (участвует в синтезе катехоламинов). Наиболее целесообразным представляется комбинированное применение витаминов группы B, так как при совместном их введении возникает эффект синергизма, обеспечивающий усиление терапевтического действия тиамина, пиридоксина и цианокобаламина. В серии экспериментов показано, что применение комбинации тиамина, пиридоксина и цианокобаламина позволяет в значительной степени купировать болевой синдром.
Сенсационное открытие было сделано в 1952 г. японскими учеными, которые, изучая механизмы проникновения тиамина в клетку и его биотрансформацию в организме, синтезировали липофильное соединение бенфотиамин, не разрушающийся тиаминазами кишечника, полностью всасывающийся в кровь и длительно циркулирующий в организме, что очень важно для пролонгации терапевтического эффекта [11]. Исследования у здоровых добровольцев показали, что бенфотиамин обладает большей внутриклеточной биодоступностью по сравнению с тиамином. Поступление бенфотиамина в ткани способствует активизации ферментных систем, участвующих в утилизации глюкозы и нейтрализации конечных продуктов гликирования. Бенфотиамин повышает также эффективность синтеза аденозинтрифосфорной кислоты (АТФ), что ослабляет дегенеративные процессы в нервной ткани и улучшает кровоток в нервных волокнах.
Исследованиями R. Bitsch и соавт. (1991) [12], K.H. Schreeb и соавт. (1997) [13] доказано, что 40 мг бенфотиамина по своему эффекту превосходят 100 мг традиционного тиамина мононитрата. При назначении двух этих препаратов в эквимолярных дозах биологическая эффективность бенфотиамина в 10 раз превышала биологическую активность водорастворимой формы тиамина. A.I. Vinik и соавт. (2000) в экспериментах на крысах со стрептозотоциновым диабетом показали влияние бенфотиамина на проявление автономной нейропатии [1]. Также изучалось влияние бенфотиамина на развитие ретинопатии, нефропатии и на эндотелиальную функцию – доказано, что применение бенфотиамина предотвращало пролиферацию сосудов глазного дна, значительно снижало микроальбуминурию [14] и проявления неврологических нарушений и вибрационной чувствительности.
Данные клинических двойных слепых плацебоконтролируемых исследований также подтверждают эффективность бенфотиамина и пиридоксина в лечении нейропатий. Двадцати пациентам с диабетической нейропатией назначали бенфотиамин в дозе 320 мг, пиридоксин и цианокобаламин. Результаты терапии оценивались по шкале неврологических нарушений и вибрационной чувствительности. У пациентов уже через три недели лечения отмечалось достоверное улучшение по этим показателям по сравнению с группой контроля [15]. Таким образом, витамины группы B, проявляя выраженное нейротропное действие, оправданно могут использоваться как патогенетическая терапия ДНП.
Одним из наиболее известных нейротропных блокаторов AGE-продуктов является комбинированный препарат Мильгамма композитум («Вёрваг Фарма»), который содержит 100 мг бенфотиамина и 100 мг пиридоксина. Препарат удобен в применении, его форма выпуска – драже – способствует повышению приверженности пациентов лечению, особенно в амбулаторных условиях. В большинстве работ отечественных и зарубежных авторов, посвященных применению Мильгаммы композитум в лечении ДПН, этот препарат применялся в стандартной дозе – по 3 драже в сутки (300 мг бенфотиамина + 300 мг пиридоксина) [7, 14, 16]. Уже после 3-недельного применения Мильгаммы композитум у больных на 30–50% снижалась интенсивность болей в нижних конечностях (по шкале McGill), при этом в большинстве случаев удавалось снизить дозу ранее принимаемых анальгетических средств или вообще отказаться от их приема. Отмечено ослабление субъективных ощущений, характерных для полинейропатии: частота онемения и покалываний в нижних конечностях уменьшилась с 50 до 7% в отношении каждого симптома [7, 16].
На сегодняшний день в клинической практике используют двухэтапный курс лечения ДПН. На начальном этапе лечения ДПН для достижения быстрого терапевтического эффекта проводят курс из 10 инъекций Мильгаммы (100 мг тиамина, 100 мг пиридоксина, 1000 мкг цианокобаламина, 20 мг лидокаина). Тиамин в этой комбинации в дополнение к неспецифическим положительным эффектам пиридоксина и цианокобаламина в отношении функционального состояния периферической нервной системы оказывает достаточно быстрый анальгетический эффект. Далее переходят на пероральный прием Мильгаммы композитум (100 мг бенфотиамина, 100 мг пиридоксина), что позволяет усилить и пролонгировать терапевтический эффект. Мильгамму композитум следует назначать на 4–6 недель по 3 драже в сутки, что обеспечивает эффективное патогенетически обоснованное воздействие при ДПН. В дальнейшем целесообразно рекомендовать повторные профилактические курсы приема Мильгаммы композитум 2 раза в год в качестве профилактического средства для предотвращения развития поздних осложнений СД.
Нейропатия – тяжелое и прогрессирующее осложнение СД, значительно снижающее качество жизни пациентов. Потеря чувствительности в дистальных отделах конечностей способствует образованию язв на стопах и инфекциям, что может привести к ампутации конечности. Таким образом, патогенетическое и симптоматическое лечение диабетической нейропатии совершенно необходимо для предупреждения таких последствий. Основа лечения всех осложнений СД, в том числе и ДПН, – компенсация углеводного обмена. Однако, учитывая возможность демиелинизации нервного волокна на фоне длительной гипогликемии или, напротив, возможность отсутствия клиники ДПН на фоне длительно существующей гипергликемии, требуется назначение препаратов, эффект которых проявляется независимо от гликемического контроля. Экспериментальными и клиническими работами доказано, что применение нейротропных блокаторов образования AGE-продуктов (Мильгамма композитум) эффективно облегчает боль и ослабляет другие симптомы нейропатии. Таким образом, их применение может быть рекомендовано в дополнение к основному лечению СД и контролю гликемии.
1. Vinik A.I., Park T.S., Stansberry K.B. et al. Diabetic neuropathies // Diabetologia. 2000. Vol. 43. № 8. P. 957–973.
2. Ziegler D. Treatment of neuropathic pain // Textbook of diabetic neuropathy. New York: Thieme, 2002. P. 211–224.
3. Haupt E. 4th International Symposium on Diabetic Neuropathy. Noordwijkerhout, 1997.
4. Аметов А.С., Карпова Е.В. Роль Мильгаммы композитум в лечении диабетической полинейропатии // РМЖ. 2010. № 23. С. 1437–1440.
5. Young M.J., Boulton A.J., MacLeod A.F. et al. A multicentre study of the prevalence of diabetic peripheral neuropathy in the United Kingdom hospital clinic population // Diabetologia. 1993. Vol. 36. № 2. P. 150–154.
6. Dyck P.J., Kratz K.M., Karnes J.L. et al. The prevalence by staged severity of various types of diabetic neuropathy, retinopathy, and nephropathy in a population-based cohort: the Rochester Diabetic Neuropathy Study // Neurology. 1993. Vol. 43. № 4. P. 817–824.
7. Левин О.С. Полиневропатии. Клиническое руководство. М.: МИА, 2005. 496 с.
8. Комелягина Е.Ю., Анциферов М.Б. Новые возможности лечения диабетической периферической невропатии // Фарматека. 2010. № 3. С. 58–63.
9. Бегма А.Н., Бегма И.В. Значение нейротропной терапии в предотвращении развития трофических язв при диабетической полинейропатии // Трудный пациент. 2011. № 12. С. 28.
10. Jermendy G. The effectiveness of Milgamma in treatment of diabetic polyneuropathy // Medicuc Universalis. 1995. Vol. 15. P. 217–220.
11. Аметов А.С., Солуянова Т.Н. Применение Мильгаммы композитум в лечении поздних осложнений сахарного диабета // РМЖ. 2009. Т. 17. № 10. С. 687–691.
12. Bitsch R., Wolf M., Möller J. et al. Bioavailability assessment of the lipophilic benfotiamine as compared to a water-soluble thiamin derivative // Ann. Nutr. Metab. 1991. Vol. 35. № 5. P. 292–296.
13. Schreeb K.H., Freudenthaler S., Vormfelde S.V. et al. Comparative bioavailability of two vitamin B1 preparations: benfotiamine and thiamine mononitrate // Eur. J. Clin. Pharmacol. 1997. Vol. 52. № 4. P. 319–320.
14. Мктрумян A.M., Подачина С.В. Мильгамма композитум – препарат выбора в лечении диабетической нейропатии // РМЖ. 2008. Т. 16. № 28. С. 1887–1891.
15. Estrada D.E., Ewart H.S., Tsakiridis T. et al. Stimulation of glucose uptake by the natural coenzyme alpha-lipoic acid/thioctic acid: participation of elements of the insulin signaling pathway // Diabetes. 1996. Vol. 45. № 12. P. 1798–1804.
16. Шилов А.Ш., Авшалумов А.М. Мильгамма и Мильгамма композитум в лечении диабетической полинейропатии // Фарматека. 2009. № 2. С. 128–133.
Новости на тему
02.02.2024
21.09.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Диабетическая полинейропатия (ДПН) – тяжелое осложнение сахарного диабета.
Лечение ДПН – один из наиболее важных вопросов современной диабетологии.
В статье рассматриваются современные возможности лечения ДПН с использованием патогенетической и симптоматической терапии.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
