Возможности стимулирующей терапии мочевыми гонадотропинами в лечении тяжелых форм мужского бесплодия
- Аннотация
- Статья
- Ссылки
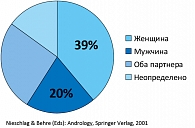
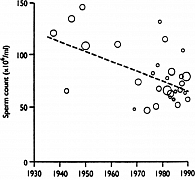


Предполагается, что данный процент будет увеличиваться, поскольку в последние десятилетия у мужчин наблюдается необъяснимое прогрессирующее снижение числа сперматозоидов в эякуляте (рисунок 2).
Очень настораживающим является снижение не только количества сперматозоидов в популяции здоровых мужчин, но и качества эякулята – уменьшение числа активно подвижных сперматозоидов, увеличение количества морфогически измененных сперматозоидов. Резкое снижение количества и качества эякулята привело к очередному пересмотру ВОЗ в 2010 г. референтных значений показателей спермограммы (таблица 1).
Отдельные 5 пересмотров референтных значений спермограммы наглядно отражают драматический характер ухудшения сперматогенеза в популяции.
Анализ эякулята – важнейший метод оценки состояния сперматогенеза у мужчины. Он позволяет оценить фертильность (плодовитость). Если показатели спермограммы находятся в пределах нормативных, достаточно ограничиться одним подобным исследованием. При патоспермии анализ эякулята должен быть выполнен 2-3 раза с интервалом 4-12 недель (72 дня) при условии полового воздержания не менее 3 и не более 7 дней.
Способ получения спермы – мастурбация. Все манипуляции с образцом эякулята выполняются при температуре не ниже 200 С и не выше 360 С. Из полученных спермограмм оценивают лучший результат. При этом учитывают, что самым высоким дискриминационным показателем фертильности спермы является подвижность сперматозоидов.
Несмотря на длительную историю микроскопического изучения сперматозоидов, впервые методы количественного анализа были использованы в 1929 г., когда было выявлено, что пограничное количество сперматозоидов у здорового мужчины составляет 100 млн в 1 мл, в дальнейшем нижняя граница была снижена до 40 млн в 1 мл, а в последние 10-15 лет – до 20 млн в 1 мл эякулята и в 2010 году – до 15 млн.
Трудно себе представить, что мужчину с современными «условно нормальными» показателями сперматогенеза необходимо рассматривать как фертильного. Скорее всего, в скором времени мы таким «лабораторно здоровым» мужчинам будем предлагать различные варианты терапии, направленной на улучшение сперматогенеза без установления диагноза «бесплодие», поскольку диагноз мужского бесплодия выставляется на основании данных анамнеза и данных спермограммы.
Причины мужского бесплодия
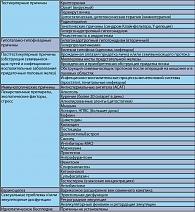
Во всех случаях мужского бесплодия необходимо постараться выявить ее причину (таблица 2). Достаточно часто найти причину не удается, тогда говорят об идиопатическом бесплодии.
Гиперпролактинемия является одной из частых причин мужского бесплодия (до 15% случаев), в связи с чем у каждого мужчины абсолютно необходимо определение пролактина. В то же время гиперпролактинемия является наиболее «перспективной» патологией для медикаментозного лечения. Даже в случае наличия у мужчины азооспермии на фоне гиперпролактинемии прогноз в отношении восстановления сперматогенеза весьма хороший во всех случаях за исключением первичного бесплодия тестикулярного характера. Его лабораторным проявлением является повышение уровней гонадотропинов – ЛГ и ФСГ, – причем может отмечаться как повышение одного, так и обоих гормонов сразу.
Таким образом, при ведении пациента с мужским бесплодием во всех случаях абсолютно необходимо определение уровней ЛГ, ФСГ, пролактина. Поскольку гипотиреоз может сопровождаться и ухудшением сперматогенеза и повышением пролактина, определение ТТГ также необходимо.
Стимулирующая терапия в лечении мужского бесплодия
У всех мужчин, независимо от причины бесплодия, у которых не отмечается повышение уровня гонадотропинов возможно применение стимулирующей терапии препаратами гонадотропинов, поскольку обе функции яичек – продукция андрогенов и сперматогенез – регулируются по механизму обратной связи, и повышение гонадотропинов свидетельствует о необратимой гибели тестикул (первичный гипогонадизм) и неэффективности медикаментозной терапии. ЛГ стимулирует синтез тестостерона в клетках Лейдига, ФСГ контролирует сперматогенез, действуя на клетки Сертоли. Согласно имеющимся последним данным, ФСГ необходим в период полового созревания для инициации количественного и качественного нормального сперматогенеза. В дальнейшем для поддержания нормального сперматогенеза наиболее значимым является внутритестикулярное содержание тестостерона. Более того, описаны случаи тестостеронпродуцирующих опухолей из клеток Лейдига у мальчиков допубертатного возраста, на фоне которых отмечался полный, нормальный сперматогенез. Таким образом, тестостерон является, с одной стороны, классическим гормоном, а с другой, – локальным фактором сперматогенеза в семенных канальцах. Клетки Лейдига лишены способности запасать тестостерон, поэтому любые факторы, в том числе стрессы, сопровождающиеся гиперпролактинемией и снижением секреции ЛГ, крайне негативно влияют на сперматогенез.
Препараты, содержащие гонадотропины (фолликулостимулирующий и лютеинизирующий гормоны) можно разделить на 4 большие группы:
- сывороточный гонадотропин (получают этот препарат из сыворотки крови жеребых кобыл);
- хорионический человеческий гонадотропин (из мочи беременных женщин);
- менопаузный гонадотропин (из мочи женщин, находящихся в менопаузе); генно-инженерные препараты гонадотропинов (не зарегистрированы для использования у мужчин).
Сывороточный гонадотропин в настоящее время не применяется, поскольку полипептид животного происхождения является чужеродным для человека и может вызывать как аллергические реакции, так и образование антител. Наиболее часто применяется препарат хорионического человеческого гонадотропина (ХГ), получаемый из мочи беременных женщин (мочевой гонадотропин).
Хорионический гонадотропин – плацентарный гормон, – обладающий в значительной степени свойствами лютеинизирующего гормона передней доли гипофиза человека, но с более сильным действием вследствие продолжительности периода действия. Хорионический гонадотропин обладает биологическими свойствами как ЛГ, так и ФСГ, и связывается с обоими типами рецепторов к гонадотропинам, но лютеинизирующая активность у ХГ значительно преобладает над фолликулостимулирующей. Хорионический гонадотропин стимулирует стероидогенез в половых железах за счет биологического воздействия, сходного с действием ЛГ. У мужчин он инициирует и поддерживает сперматогенез, вызывает повышение продукции тестостерона, дигидротестостерона. У женщин ХГ вызывает овуляцию и стимулирует синтез эстрогенов, эстрадиола и в особенности прогестерона после овуляции.
Хорионический гонадотропин назначают в виде внутримышечных (реже – подкожных) инъекций. Раствор для них следует готовить непосредственно перед применением с использованием приложенного растворителя.
При бесплодии, на фоне гипо- или нормогонадотропного гипогонадизма назначают, как правило, по 1500 ME хорионического гонадотропина 2 раза в неделю или по 5000 – 6500 МЕ ХГ 1 раз в неделю, при необходимости, одновременно с введением Менотропина (Менопур 75 ME три раза в неделю), в течение не менее 4 месяцев.
Противопоказанием к его назначению является, помимо первичного гипогонадизма, лабораторно проявляющегося повышением ЛГ, наличие или подозрение на наличие гормонозависимых опухолей, таких, как карцинома предстательной железы или молочной железы у мужчин.
В настоящее время на российском рынке фармацевтических препаратов имеется несколько препаратов мочевых гонадотропинов от разных производителей. Эффективность всех препаратов сопоставима (таблица 3), однако, мы, в последнее время, отдаем предпочтение препарату Хорагон компании Ferring Pharmaceuticals вследствие наиболее правильного описания действия препарата и его побочных эффектов в его аннотации. Комплаентность пациента напрямую зависит, в том числе, и от наличия или отсутствия страха развития тех или иных побочных эффектов. В аннотации к российскому препарату ХГ отмечена вероятность атрофии семенных канальцев и ухудшения сперматогенеза, что, естественно, крайне затрудняет его назначение пациентам с бесплодием.
Заключение
Бесплодие в паре и мужское бесплодие, в том числе, становится актуальнейшей проблемой современного общества. Развитие современных репродуктивных технологий, доступность, в том числе и экономическая, искусственного оплодотворения привели к тому, что медикаментозное лечение мужского бесплодия практически не проводится. Крайне печально наблюдать, когда мужчине с азооспермией, обусловленной той или иной курабельной патологией (гиперпролактинемия, гипотиреоз, гипогонадотропный гипогонадизм, опухоли гипоталамо-гипофизарной области и т.д.), не проводится гормонального обследования и паре предлагается инсеминация спермой донора.
Современные возможности ЭКО позволяют большинству мужчин стать генетическими отцами. И задача всех специалистов, к которым обращается пара с бесплодием – гинекологов, урологов, андрологов, репродуктолов, – помимо оценки сперматогенеза, проведение гормонального обследования. Это позволит выявлять пациентов, способных ответить на стимулирующую терапию, необходимую для появления, в ряде случаев, единичных сперматозоидов, но дающую путь через искусственное оплодотворение шанс на генетическое отцовство.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.