Кокарнит – высокоэффективный и безопасный подход к терапии диабетической нейропатии
- Аннотация
- Статья
- Ссылки
- English
Медико-социальную значимость сахарному диабету придают осложнения, среди которых существенную роль в нарушении со стороны различных органов и систем, а также качества жизни играет нейропатия.
Современные методы лечения диабетической нейропатии позволяют добиться благоприятных результатов со значительным улучшением качества жизни пациентов.
Кокарнит относится к группе препаратов, улучшающих метаболизм и регенерацию нервных волокон периферической нервной системы. Четыре компонента в одной ампуле действуют одномоментно, однонаправленно, обладают синергизмом и потенцируют действие друг друга, что обеспечивает высокую эффективность лечения.
Медико-социальную значимость сахарному диабету придают осложнения, среди которых существенную роль в нарушении со стороны различных органов и систем, а также качества жизни играет нейропатия.
Современные методы лечения диабетической нейропатии позволяют добиться благоприятных результатов со значительным улучшением качества жизни пациентов.
Кокарнит относится к группе препаратов, улучшающих метаболизм и регенерацию нервных волокон периферической нервной системы. Четыре компонента в одной ампуле действуют одномоментно, однонаправленно, обладают синергизмом и потенцируют действие друг друга, что обеспечивает высокую эффективность лечения.
Нейропатия – поражение периферических нер#вов, вызванное любыми причинами, кроме воспаления.
Нервные волокна подразделяют на три группы: моторные – отвечают за двигательные функции, сенсорные – обеспечивают чувствительность тканей, автономные (вегетативные) – необходимы для неосознанной регуляции деятельности тех или иных структур, например сосудов или внутренних органов.
В клинической практике выделяют мононейропатию – поражение одного нерва, множественную нейропатию – поражение нескольких нервов, локализованных в одной зоне, и полинейропатию – поражение нервов в различных зонах.
К самым частым видам нейропатии относятся диабетическая, токсическая, посттравматическая, вызванная остеохондрозом позвоночника или артритом.
Клинически нейропатия не характеризуется болью. Пациенты преимущественно жалуются на ощущение покалывания в зоне пораженного нерва, онемение, нарушение чувствительности той или иной зоны, уменьшение подвижности в конечности (слабость при сжатии кулака). Автономная полинейропатия может проявляться нарушением потоотделения, пищеварения, функций мочеполовой системы и др. Это связано с нарушением передачи нервного импульса к мышцам, которые теряют способность нормально сокращаться, что и приводит к возникновению перечисленных выше симптомов.
Нейропатии развиваются в течение длительного периода времени, иногда годами оставаясь бессимптомными и недиагностированными. К провоцирующим факторам утяжеления их проявлений относят стресс, употребление алкоголя, обострение хронического заболевания.
Сахарный диабет (СД) является наиболее распространенной причиной развития нейропатий, среди которых самой распространенной считается диабетическая нейропатия – 50% случаев [1]. Согласно данным D. Ziegler и соавт., у 81,1% пациентов безболевая дистальная сенсорная диабетическая нейропатия не диагностируется своевременно [2], несмотря на то что в дебюте СД 2 типа проявления диабетической полинейропатии (ДПН) отмечаются у 20% [3]. Через шесть лет после выявления СД 2 типа у 21% больных регистрируются поражения центральной и периферической нервной системы [4].
Согласно данным экспертов Международной федерации диабета, в 2021 г. количество больных диабетом в мире достигло 537 млн. При этом отмечалось существенное увеличение частоты встречаемости СД с возрастом [5].
Однако статистика нарушений углеводного обмена не должна ограничиваться сбором данных в отношении распространенности СД, необходимо учитывать и случаи развития предиабета, количество которых, исходя из результатов исследования NATION, в пять раз превышает количество случаев СД [6]. У пациентов с предиабетом встречается билатеральное и симметричное поражение нервов нижних конечностей с градиентом выраженности нарушений от дистальных отделов до проксимальных, что характерно для пациентов с СД [7].
Диабетическая полинейропатия ассоциируется с возрастанием риска развития сердечно-сосудистых заболеваний и состояний, в том числе инсульта [8], а диабетическая автономная нейропатия является независимым фактором риска острого нарушения мозгового крово#обращения, в том числе вследствие нарушения регуляции церебрального кровотока в сочетании с ангиопатией [9].
Сахарный диабет признан ведущей причиной развития периферических нейропатий [10].
Характерными клиническими симптомами ДПН являются дискомфорт, жжение, парестезии, онемение, аллодинии (боли при соприкосновении ног с бельем, одеждой и т.д.), гипералгезии (усиление чувствительности к болевым раздражителям). Это обусловлено тем, что в первую очередь поражаются сенсорные нервы. В случае прогрессирования заболевания повреждаются нервы верхних конечностей. Если в патологический процесс вовлекаются периферические нервы туловища, снижается чувствительность кожи в области груди и живота [11]. Изменения поверхностной чувствительности превосходят таковые глубокой чувствительности. Далее в патологический процесс вовлекаются двигательные нервы [12]. Прогрессирование повреждения периферических нервов приводит к потере всех видов чувствительности на фоне поражения чувствительных и проприоцептивных волокон. Утрата чувствительности обусловливает неспособность распознавания микротравм стоп и повышение риска изъязвлений и инфицирования с возможным формированием в дальнейшем глубоких язв и вовлечением в процесс костной ткани, что может привести к гангрене. У больных СД нетравматическая ампутация конечности проводится в 10–20 раз чаще, чем у не страдающих СД [13].
Болевая форма ДПН встречается в 40–50% случаев и ассоциируется со значительным снижением качества жизни [14].
В клинической практике СД давно признан меж#дисциплинарным заболеванием из-за полиорганных метаболических процессов, развивающихся на фоне гипергликемии и суточной патологической вариабельности гликемии, приводящих к формированию различных осложнений. Поражение периферической нервной системы отмечается от спинномозговых корешков до тонких нервных волокон, оно может проявляться изолированно и в сочетании с другими осложнениями заболевания [15].
Согласно определению, приведенному в десятом выпуске Алгоритмов специализированной медицинской помощи больным сахарным диабетом, диабетическая нейропатия – комплекс клинических и субклинических синдромов, каждый из которых характеризуется диффузным или очаговым поражением периферических и/или автономных нервных волокон в результате СД [16]. В документе также предложена классификация ДПН, согласно которой выделяют доклиническую стадию, стадию клинических проявлений и стадию осложнений. Четко определены группы риска: больные СД 1 типа, не достигающие целевой гликемии спустя пять лет от дебюта заболевания, и лица с СД 2 типа с момента диагностики заболевания.
Скрининг ДПН проводится у всех пациентов с СД 1 типа через пять лет от дебюта заболевания, у больных СД 2 типа – с момента установления диагноза. Скрининговое обследование должно проводиться ежегодно.
Наиболее распространенным вариантом полинейро#патии считается хроническая диабетическая дистальная симметричная сенсорная и/или сенсомоторная полинейропатия. Патогенез диабетической дистальной симметричной полинейропатии сложен и до конца неясен. Нервная система при СД поражается вследствие сложных многоуровневых метаболически-сосудистых нарушений.
В настоящее время существует несколько теорий патогенеза ДПН: метаболическая, сосудистая, генетическая, иммунная, и приоритет отдается микроангио#патиям [17, 18]. При ДПН за счет микрососудистых нарушений регистрируются диффузные поражения эндоневральных нервных волокон и периневрального пространства [19].
Нервная ткань – инсулиннезависимая ткань. При СД развивается хроническая гипергликемия и в нейронах существенно возрастает содержание глюкозы [12] с образованием конечных продуктов гликирования [20]. Необходимо подчеркнуть, что феномен метаболической памяти зависит от степени и продолжительности гипергликемии [21]. Среди механизмов повреждения периферических нервов в условиях хронической гипергликемии указывают активацию полиолового пути, накопление конечных продуктов гликирования, активацию протеинкиназы С, окислительного стресса, продукцию провоспалительных цитокинов и дефицит миоинозитола [22]. Увеличение активности полиолового пути приводит к усилению метаболизма сорбитола и фруктозы, при этом снижается концентрация миоинозитола (источника энергии нерва), что приводит к инактивации Na+/К+-ATФaзы и нарушению проведения нервного импульса. Активация протеинкиназы С ассоциируется с уменьшением активности Nа+/К+-АТФазы и стимуляцией простагландинов, которые отвечают за вазоконстрикцию. Накопление конечных продуктов гликирования в нервных клетках приводит к цитотоксичности. Конечные продукты гликирования могут индуцировать апоптоз шванновских клеток и высвобождение фактора некроза опухоли α [23, 24], модифицировать структурные протеины нервных волокон с образованием более ригидных форм, что приводит к нарушению аксонального транспорта и в конечном итоге к нейродегенерации. Нейродегенерация также может быть обусловлена повреждением пери- и эндоневральных сосудов в результате взаимодействия конечных продуктов гликирования с эндотелиальными клетками [25].
При СД развивается интраневральная гипоксия на фоне изменения реологических свойств крови, утолщения сосудистой стенки эндоневральных сосудов и изменения содержания в цитоплазме клеток фосфатных энергетических субстратов [17].
Ключевой медиатор адаптации к низкому напряжению кислорода – HIF-1 обеспечивает баланс окислительно-восстановительного гомеостаза, подавляя избыточное митохондриальное производство активных форм кислорода при хронической гипоксии. Гипергликемия подавляет HIF-1 посредством HIF-пролилгидроксилазного зависимого механизма, что приводит к избыточной продукции митохондриальных активных форм кислорода за счет усиления митохондриального дыхания, опосредованного пируватдегидрогеназной киназой 1. При диабете стабильность и функция HIF-1 сложно подавляются, регрессия HIF-1 играет центральную роль в перепроизводстве митохондриальных активных форм кислорода. Восстановление функции HIF-1 ослабляет гиперпродукцию активных форм кислорода, несмотря на стойкую гипергликемию, и обеспечивает защиту от апоптоза и повреждения почек. Выявлено, что вторичная по отношению к гипергликемии подавленная функция HIF-1 способствует перепроизводству митохондриальных активных форм кислорода с прямыми патогенными эффектами [27].
Развитие окислительного стресса и избыточное образование активных форм кислорода в условиях глюкозотоксичности являются общими механизмами повреждения не только нервной ткани, но и сосудов [28].
Помимо вышеперечисленных процессов необходимо учитывать, что при нарушении углеводного обмена возрастает потребность в витамине В1 (тиамине) и создаются условия для развития его дефицита.
Тиамин подавляет пути биосинтеза гексозамина, предупреждая развитие диабетической кардиомиопатии, что было доказано у животных с экспериментальным диабетом [29]. У больных СД 2 типа бенфотиамин (липофильный тиаминдифосфат) в дозе 1050 мг/сут предупреждает развитие эндотелиальной микро- и макрососудистой дисфункции и окислительного стресса [30].
При СД происходит повышенное выведение с мочой витамина В2 (рибофлавина), уменьшение его усвоения [31]. Кроме того, усиливаются нарушения в обмене витамина В при этом в зависимости от стадии и степени тяжести СД [32, 33].
Витамин В6 (пиридоксин) обеспечивает нормальный обмен белков, синтез тормозного медиатора центральной нервной системы γ-аминомасляной кислоты (ГАМК), адреналина и других медиаторов, необходим для использования железа при синтезе гемоглобина. Возрастание потребления белка, на практике наблюдаемое у больных СД, приводит к увеличению потребности в этом витамине [34]. Дефицит пиридоксальфосфата в плазме крови отмечается приблизительно у 25% пациентов независимо от продолжительности заболевания, пола и возраста [35].
Витамин B12 (цианокобаламин) необходим для синтеза нуклеиновых кислот, белков, для деления клеток, в том числе кроветворных, предупреждения гемолиза, продукции миелиновой оболочки нервов, обеспечения синтеза различных соединений, в том числе ацетилхолина, предотвращения жирового перерождения клеток и тканей паренхиматозных органов (печени) [34, 36]. Большинство пациентов с СД 2 типа – лица средней и старшей возрастных групп, среди которых распространенность дефицита цианокобаламина составляет от 5 до 40% [37]. Необходимо также отметить, что одним из самых распространенных препаратов для лечения СД 2 типа является метформин. Согласно результатам многоцентрового рандомизированного плацебо-контролируемого исследования, опубликованным в 2012 г., длительное применение метформина приводит к формированию дефицита витамина В12. Дефицит витамина В12 вызывает гипергомоцистеинемию, которая способствует развитию атеросклероза.
При микроальбуминурии дефицит витаминов группы В носит более выраженный характер.
Витамины B1, В6 и В12 составляют группу так называемых нейротропных витаминов, обеспечивающих нормальную структуру и функцию нервных клеток и препятствующих их повреждению при сахарном диабете [34, 36]. Основой успешного лечения СД является достижение и поддержание индивидуальных целевых показателей гликемии. Кроме того, это позволяет предотвратить или отсрочить развитие осложнений у пациентов с СД 1 типа и/или замедлить их прогрессирование у больных СД 2 типа.
Терапия ДПН должна быть комплексной и включать прием патогенетических препаратов, действие которых направлено на восстановление пораженных нервов и улучшение проведения возбуждения в нервных клетках, и симптоматических, способствующих уменьшению выраженности болевого синдрома и стресса, а также стабилизации психоэмоционального состояния.
Пострегистрационные исследования достоверно подтверждают положительное влияние витаминов группы В у пациентов с нарушением нервной проводимости, в том числе при СД [38, 39]. Витамины группы B участвуют в энергетическом метаболизме, обладают антиноцицептивными и антигиперальгическими эффектами. Была показана связь анальгетического и нейротропного эффектов витаминов группы В при лечении болевой нейропатии [40]. Применение этих препаратов позволяет снизить дозы прегабалина и габапентина у пациентов с ДПН, при этом отмечается лучший лечебный эффект по сравнению с монотерапией антиконвульсантами [41]. Витамины группы B повышают анальгетический эффект нестероидных противовоспалительных препаратов при сочетанном применении [39].
Квадросинергизм агонистов пуриновых рецепторов, витаминов группы B и никотинамида обеспечивает значимое снижение нейропатических симптомов, ремиелинизацию и восстановление проведения нервных импульсов, повышая эффективность терапии и улучшая качество жизни пациентов с ДПН [42, 43].
Квадроэффект композиции компонентов Кокарнит достигается синергизмом их действия. В состав препарата входят 20 мг никотинамида, 50 мг кокарбоксилазы, 0,5 мг цианокобаламина и 10 мг трифосаденина динатрия тригидрата.
Комфортное внутримышечное введение лиофилизата Кокарнит обеспечивается комплементарным количеством ампул с растворителем, содержащим 0,5% лидокаина гидрохлорида объемом 2 мл для местной анестезии. Этот же набор ампул позволяет менять растворитель с лидокаином на воду для инъекций в случае клинической необходимости. Упаковка Кокарнит № 3 кратна 9–15 инъекциям требуемого курса терапии, что удобно для достижения квадроэффекта компонентов при одномоментном введении.
Согласно классификатору клинико-фармакологических групп, Кокарнит относят к препаратам, улучшающим метаболизм и регенерацию нервных волокон периферической нервной системы. Четыре компонента в одной ампуле действуют одномоментно, однонаправленно, обладают синергизмом и потенцируют действия друг друга, тем самым обеспечивая высокую эффективность лечения.
Немаловажно и условие хранения препарата – до 25° С, что дает возможность хранить его вне холодильника.
Рассмотрим более подробно активные вещества препарата и их действие.
Никотинамид – одна из форм витамина РР, участвует в окислительно-восстановительных процессах в клетке, улучшает углеводный и азотистый обмен, регулирует тканевое дыхание, участвует в процессах выработки энергии и поддержания гомеостаза, метаболизма воды и электролитов, улучшает энергетический обмен. Никотинамид – компонент фермента кодегидразы I (НАДН) и кодегидразы II (НАД-НФ), которые в свою очередь являются переносчиками водорода и участвуют в окислительно-восстановительных процессах. Кодегидраза II принимает участие в переносе фосфата, регулирует процессы фосфорилирования, способствует доставке аденозинтрифосфата в клетки. Никотинамид восстанавливает трофику нервной и других ишемизированных тканей, обладая сосудорасширяющим действием на уровне мелких сосудов и капилляров, но в отличие от никотиновой кислоты не оказывает выраженного сосудорасширяющего действия, поэтому при его применении не возникает покраснения кожных покровов и чувства прилива к голове. Никотинамид оказывает мягкое седативное действие, применяется при лечении эмоциональных и нервно-психических расстройств, таких как тревожность, депрессия, снижение внимания. Никотинамид способствует уменьшению боли и улучшению подвижности суставов при остеоартрите. Данное вещество быстро распределяется во все ткани. Проникает через плацентарный барьер и в грудное молоко. Метаболизируется в печени с образованием никотинамида-N-метилникотинамида. Выводится почками. Период полувыведения из плазмы составляет около 1,3 часа, стационарный объем распределения – около 60 л, общий клиренс – около 0,6 л/мин.
Кокарбоксилаза является коферментом, образующимся в организме из поступающего извне витамина B1. Взаимодействуя с протеином и ионами магния, входит в состав фермента карбоксилазы, катализирующего карбоксилирование и декарбоксилирование α-кетокислот, ликвидирует метаболический ацидоз. Опосредованно способствует образованию ацетил-кофермента А, синтезу нуклеиновых кислот, белков и липидов. Снижает в организме концентрацию молочной и пировиноградной кислот, способствует усвоению глюкозы. Улучшает трофику нервной ткани вследствие улучшения ее энергетического баланса. Участвует в переносе кислорода и стимулирует энергетические процессы за счет увеличения его накопления. Модулирует передачу нервного импульса, регулирует перенос натрия через нейрональную мембрану. Увеличивает метаболическую активность кардиомиоцитов, просвет коронарных сосудов. Усиливает кардиотоническое действие сердечных гликозидов, улучшает их переносимость и усвоение.
Кокарбоксилаза быстро абсорбируется после внутримышечного введения, проникает в большинство тканей организма. Подвергается метаболическому разложению, выводится преимущественно почками.
Цианокобаламин (витамин В12) в организме превращается в метилкобаламин и 5-дезоксиаденозилкобаламин. Метилкобаламин участвует в превращении гомоцистеина в метионин и S-аденозилметионин – ключевые реакции метаболизма пиримидиновых и пуриновых оснований, а также в переносе одноуглеродистых ферментов, является необходимым компонентом дезоксирибозы и ДНК, холина, креатина, метионина, регулирует образование карнитина – переносчика свободных жирных кислот из цитоплазмы через мембрану митохондрий. Цианокобаламин является регулятором окисления жирных кислот, предотвращает накопление недоокисленных жирных кислот в матриксе митохондрий. Участвует в аминокислотном обмене, биосинтезе ацетилхолина, а также в миелинизации нервных волокон. Оказывает гемопоэтическое действие, повышает регенерацию тканей, регулирует свертывающую систему крови. Цианокобаламин также способен уменьшить повреждение органов и симптомы, связанные с COVID-19 [44], так как SARS-CoV-2 влияет на метаболизм витамина В12, добавляя к собственным эффектам повышенный окислительный стресс, гипергомоцистеинемию, активацию каскада коагуляции, сужение сосудов, а также почечную и легочную васкулопатию [45]. Кроме того, дефицит витамина B12 может приводить к нарушению функции дыхательной, желудочно-кишечной и центральной нервной систем [46]. При недостаточности витамина В12 его может замещать метилтетрагидрофолиевая кислота, однако при этом нарушаются фолиевопотребные реакции метаболизма. В крови цианокобаламин связывается с транскобаламинами I и II, которые транспортируют его в ткани. Вещество депонируется преимущественно в печени. Связывание с белками плазмы составляет 0,9%. Быстро всасывается после внутримышечного введения. Максимальная концентрация после внутримышечного введения достигается через один час. Из печени выводится с желчью в кишечник и снова всасывается в кровь. Период полувыведения – 500 дней. При нормальной функции почек 7–10% выводится почками, около 50% – через кишечник. При сниженной функции почек 0–7% – почками, 70–100% – через кишечник. Проникает через плацентарный барьер, в грудное молоко.
Трифосаденина динатрия тригидрат является производным аденозина, стимулирует метаболические процессы, динатрия аденозинтрифосфата тригидрат по принципу обратной связи препятствует прежде#временному окислению ферментов препарата. Аденозинтрифосфат синтезируется в цикле трикарбоновых кислот (цикле Кребса) и является основным энергетическим субстратом клетки. Оказывает вазодилатирующее действие, в том числе на коронарные и мозговые артерии. Улучшает метаболизм и энергообеспечение тканей. Обладает гипотензивным и антиаритмическим действием, улучшает доставку крови к сердечной мышце, участвует в обмене веществ. Под влиянием аденозинтрифосфата происходит снижение артериального давления, расслабление гладкой мускулатуры, усиление коронарного и мозгового кровообращения. Аденозинтрифосфат участвует в передаче нервного возбуждения в адренергических и холинергических синапсах, в передаче возбуждения с блуждающего нерва на сердце, улучшает проведение нервных импульсов, облегчает проведение возбуждения в вегетативных узлах. После парентерального введения трифосаденина динатрия тригидрат проникает в клетки органов, где расщепляется на аденозин и неорганический фосфат с высвобождением энергии. В дальнейшем продукты распада включаются в ресинтез аденозинтрифосфата.
Глицин обладает глицин- и ГАМК-ергическим, α-1-адреноблокирующим, антиоксидантным и антитоксическим действием, регулирует деятельность глутаматных рецепторов. За счет нормализации и активации процессов защитного торможения в центральной нервной системе способен оказывать седативный и слабый антидепрессантный эффект, облегчает засыпание и нормализует сон, усиливает действие противосудорожных препаратов, антидепрессантов, антипсихотиков, а также обладает некоторыми ноотропными свойствами, улучшает память и ассоциативные процессы.
Включение в состав препарата Кокарнит дополнительных компонентов усиливает его эффективность и пролонгирует действие. Лидокаин добавлен в растворитель для уменьшения дискомфорта от введения препарата и продается отдельно.
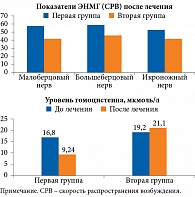
Преимущество применения комплексной терапии диабетической полинейропатии у пациентов с СД 2 типа продемонстрировано в исследовании А.С. Аметова и соавт. [47]. Для оценки влияния комплексной терапии α-липоевой кислотой с кокарбоксилазой, цианокобаламином, трифосфаденина динатрия тригидратом и никотинамидом на степень выраженности диабетической нейропатии у пациентов с СД 2 типа были сформированы две группы, которые были сопоставимы по уровню гликированного гемоглобина и длительности сахарного диабета. Первая группа (n = 33) в течение десяти дней с шестимесячным интервалом получала комплексную терапию, вторая группа (n = 21) – только α-липоевую кислоту.
Преимущество комплексной терапии перед монотерапией отмечалось как в отношении показателей электронейромиографии (ЭНМГ), так и уровня гомоцистеина.
Несмотря на доказанное положительное действие препарата Кокарнит, при его назначении необходимо учитывать противопоказания к применению. К ним относятся острые кардиологические состояния, такие как острая сердечная недостаточность, острый инфаркт миокарда, неконтролируемая артериальная гипертензия, артериальная гипотензия, тяжелые формы брадиаритмий, AV-блокада второй-третьей степени, хроническая сердечная недостаточность (третий-четвертый функциональный класс по классификации Нью-Йоркской кардиологической ассоциации), кардиогенный шок, синдром пролонгации QT, острые сосудистые состояния, тромбоэмболии, геморрагический инсульт, гиперкоагуляция, в том числе при острых тромбозах, эритремия, эритроцитоз, язвенная болезнь желудка или двенадцатиперстной кишки в фазе обострения, воспалительные заболевания легких, хроническая обструктивная болезнь легких, бронхиальная астма, подагра, гепатит, цирроз печени. Учитывая возможность проникновения через плаценту и в грудное молоко, препарат противопоказан во время беременности и грудного вскармливания. К противопоказаниям также относятся возраст до 18 лет (нет данных по применению у детей и подростков), повышенная чувствительность к любому компоненту препарата или растворителю.
Препарат Кокарнит обеспечивает нейрометабо#лический и анальгетический эффекты, положительно воздействует на эмоционально-вегетативные функции, уменьшает чувство усталости и психологическую нагрузку. Квадроэффект Кокарнита имеет потенциал у пациентов с обострением неврологических и нейроэндокринных нарушений на фоне инфекции, вызванной SARS-CoV-2, у коморбидных пациентов (сосудистые, когнитивные, метаболические нарушения, а также нарушение функций почек и печени).
Кокарнит способен воздействовать на разные точки формирования осложнений СД и значимо улучшить качество жизни таких больных. Восстанавливая метаболические процессы, уменьшая боль, препарат повышает приверженность пациентов терапии.
A.M. Mkrtumyan, MD, PhD, A.N. Oranskaya, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific and Practical Center
Contact person: Ashot M. Mkrtumyan, vagrashot@mail.ru
According to experts of the International Diabetes Federation, published in 2022, the number of diabetic patients exceeded 500 million. A similar situation is noted with regard to the prevalence of prediabetes. Thus, today there are more than 1 billion people with carbohydrate metabolism disorders in the world.
Medical and social significance to diabetes mellitus are attached with complications, among which neuropathy plays a significant role in the violation of various organs and systems, as well as the quality of life.
Modern methods of treatment of diabetic neuropathy allow achieving favorable results with a significant improvement in the quality of life of patients.
Cocarnit belongs to the group of drugs that improve the metabolism and regeneration of nerve fibers of the peripheral nervous system. The four components in one ampoule act simultaneously, unidirectional, have synergism and potentiate each other's actions, which ensures high efficiency of treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.