Ингаляционные глюкокортикостероиды (ИГКС) относятся к приоритетным средствам базисной противовоспалительной терапии бронхиальной астмы (БА) у детей. ИГКС обладают высокой топической противовоспалительной активностью в легких, минимальным системным действием и способностью достоверно уменьшать риск смертельного исхода от астмы.
Несмотря на 40-летнюю историю применения ИГКС, в том числе и в педиатрической практике, продолжаются поиски идеального препарата. По словам профессора кафедры клинической аллергологии ГБОУ ДПО «РМАПО», д.м.н. Н.М. НЕНАШЕВОЙ, идеальный ИГКС должен обладать высокой степенью связывания с глюкокортикоидными (ГК) рецепторами и депонирования в легких, пролонгированным действием при однократном приеме, достигать крупных и мелких бронхов и оказывать в них лечебное воздействие, улучшать легочную функцию и контроль астмы, а также характеризоваться минимальными локальными и системными побочными действиями. С этих позиций Наталья Михайловна проанализировала фармакологические особенности молекулы ИГКС циклесонида (Альвеско®). «Циклесонид, выпускаемый под торговым названием Альвеско®, – новый препарат на российском фармацевтическом рынке, но в мировой практике он довольно давно применяется для лечения БА, будучи зарегистрированным FDA еще в 2008 г.», – уточнила профессор Н.М. Ненашева.
Как известно, липофильные препараты характеризуются большим объемом распределения и длительным действием. Циклесонид и дезциклесонид являются липофильными веществами, что позволяет им легко проникать через клеточную мембрану и связываться с внутриклеточными ГК-рецепторами. Кроме того, высокая липофильность молекулы циклесонида увеличивает его депозицию в легких и длительность действия7.
Дезциклесонид способен образовывать внутри клеток эфиры с длинноцепочечными жирными кислотами, которые отличаются высокой липофильностью. При снижении концентрации свободного дезциклесонида в клетке активируются внутриклеточные липазы, и дезциклесонид, высвобождающийся из эфиров жирных кислот, вновь связывается с ГК-рецепторами, то есть наблюдается обратимая этерификация. Конъюгация с длинноцепочечными жирными кислотами является уникальной особенностью циклесонида, благодаря которой создается внутриклеточное депо и обеспечивается продолжительное противовоспалительное действие препарата, что способствует возможности его применения 1 раз в сутки.
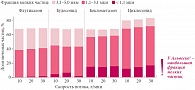
Общее и региональное распределение лекарственного средства в дыхательных путях, а следовательно, его эффективность зависят от размера частиц препарата. Для детей оптимальными считаются размеры частиц ИГКС в диапазоне 1,1–3 мкм8, 9. Циклесонид (дозированный аэрозольный ингалятор на основе гидрофторуглерода – ДАИ-HFA) является бесфреоновым дозированным аэрозолем для ингаляций с размером частиц от 1,1 до 3,1 мкм (рис. 1). Мелкие разветвления дыхательных путей занимают более 99% поверхности легких. Срединный массовый аэродинамический диаметр частиц циклесонида составляет менее 1,1 мкм, что способствует его высокой депозиции в легких и попаданию в мелкие дыхательные пути10.
С помощью лазерного дифракционного анализа респираторных потоков было проведено сравнение доставленной дозы и размера частиц нескольких ИГКС: флутиказона 125 мкг, будесонида 200 мкг, беклометазона 100 мкг и циклесонида 160 мкг. Сравнительный анализ показал, что срединный аэродинамический размер частиц был минимальным у беклометазона и циклесонида (1,9 мкм), а наибольшая доля фракции мелких частиц отмечалась у циклесонида11. Циклесонид (Альвеско®) отличается высокими уровнями депонирования в легких и распределения в дыхательных путях: общее распределение циклесонида в легких составляет 52%, при этом 55% общей дозы препарата распределяются в мелких бронхах и бронхиолах12 (рис. 2).
Циклесонид характеризуется выраженным противовоспалительным действием, в том числе и в дистальных отделах бронхов. Это подтверждают данные плацебоконтролируемого исследования, в ходе которого изучалось изменение альвеолярной фракции оксида азота (NO) у больных легкой и среднетяжелой БА в результате лечения циклесонидом в дозе 320 мкг 1 раз в день. При этом отмечалось значимое снижение концентрации альвеолярной фракции NO13. В ходе другого сравнительного исследования изучалась эффективность применения циклесонида и флутиказона пропионата у больных БА легкой степени тяжести. Результаты изучения маркеров воспаления в дистальных отделах бронхов – количества эозинофилов в позднюю фазу ответа на аллерген в индуцированной мокроте у больных БА – показали, что в мокроте у пациентов, получавших терапию циклесонидом (200 мкг 1 раз в день), отмечалось достоверное снижение эозинофилов по сравнению с получавшими флутиказона пропионат (100 мкг 2 раза в день). Таким образом, циклесонид оказывает противовоспалительное действие в дистальных отделах дыхательных путей14.
Циклесонид (Альвеско®) обладает уникальным фармакокинетическим профилем. Разработчики препарата ставили перед собой задачу минимизировать местные и системные побочные реакции и успешно ее решили. Результаты ряда международных многоцентровых рандомизированных исследований показали, что орофарингеальное отложение циклесонида после ингаляции из ДАИ-HFA было в 12 раз ниже, чем у будесонида, ингалируемого из ДАИ на основе хлорофторокарбона (ДАИ-CFC), и в 7 раз ниже, чем у флутиказона пропионата, вдыхаемого через ДАИ-HFA; количество циклесонида в ротоглотке снижается в течение 15 минут; его активация в дезциклесонид в области ротоглотки выражена слабо15, 16.
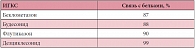
Циклесонид и дезциклесонид практически полностью связываются с белками плазмы (99%), свободная фармакологическая фракция препарата (его пероральная биодоступность) составляет < 1%, что достигается за счет выраженного эффекта первичного прохождения через печень (табл. 2)17. В заключение профессор Н.А. Ненашева кратко обозначила основные фармакодинамические и фармакокинетические свойства новой молекулы циклесонида (Альвеско®):
- циклесонид (Альвеско®) по сравнению с другими ИГКС обладает наибольшей фракцией мелких частиц, что обеспечивает высокую легочную депозицию (52%) и равномерное распределение препарата в дыхательных путях;
- циклесонид является пролекарством и активируется непосредственно в эпителиальных клетках легких;
-
циклесонид оказывает длительное действие благодаря высокой липофильности и конъюгациис жирными кислотами, что позволяет назначать препарат 1 раз в день;
- циклесонид способен в полной мере связываться с белками плазмы и характеризуется высоким печеночным клиренсом, что обеспечивает минимальный риск развития нежелательных системных реакций.
Клинические преимущества новой молекулы в лечении бронхиальной астмы
Ингаляционные глюкокортикостероиды в лечении бронхиальной астмы у детей: фокус на безопасность
Заведующая кафедрой детских болезней Первого МГМУ им. И.М. Сеченова, д.м.н., профессор Н.А. ГЕППЕ акцентировала внимание участников симпозиума на анализе данных доказательной медицины, посвященных изучению профиля безопасности нового препарата Альвеско® (циклесонида) при лечении персистирующей астмы у детей старше 6 лет.
«Как известно, ИГКС являются наиболее эффективными противовоспалительными препаратами для лечения БА у детей и подростков по сравнению с другими средствами, – комментирует Наталья Анатольевна. – Они предотвращают прогрессирующее снижение функциональных легочных показателей, которое происходит у больных БА с течением времени. Действуя в основном локально, ИГКС обладают выраженной противовоспалительной активностью. ИГКС купируют воспаление, но не излечивают болезнь – при прекращении лечения симптомы БА могут возобновляться. ИГКС принято назначать в низких дозах или подбирать индивидуальную дозировку в зависимости от фенотипа заболевания в случае упорного течения астмы, причинами которого могут быть частые и тяжелые обострения, невозможность элиминировать триггер и др.».
Основными требованиями к безопасности ИГКС, применяемых в педиатрии для лечения БА, являются низкая вероятность развития орофарингеальных (охриплость голоса, кашель, парадоксальный бронхоспазм, кандидоз полости рта) и системных нежелательных реакций (снижение скорости линейного роста ребенка, подавление функции коры надпочечников, иммуносупрессия, повышение риска развития глаукомы и катаракты). Наибольшие опасения у врачей вызывает вероятность снижения скорости линейного роста у детей, подавления гипоталамо-гипофизарно-надпочечниковой системы, развития кандидоза полости рта. Известно, что неконтролируемая или тяжелая БА оказывает негативное влияние на динамику роста ребенка и окончательный рост взрослого. Дети в возрасте 4–10 лет более восприимчивы к воздействию ИГКС на рост, чем подростки, однако изменения скорости линейного роста в течение первого года лечения являются временными. В длительных исследованиях, продолжительностью от 2 до 5 лет, не наблюдалось отрицательного действия ИГКС на минеральную плотность кости (МПК).
Не получено статистически или клинически достоверных данных, свидетельствующих об отрицательном влиянии на рост детей ИГКС в дозах 100–200 мкг. При этом установлено, что применение 400 мкг в день ингаляционного будесонида или эквивалентного ИГКС для контроля БА оказывает меньшее воздействие на рост, чем на качество жизни ребенка. Лечение минимальными дозами ИГКС (менее 200 мкг будесонида) также обычно не сочетается с супрессией гипоталамо-гипофизарно-адреналовой (ГГА) системы, а при назначении более высоких доз препаратов минимальные изменения в функции надпочечников могут быть обнаружены только чувствительными методами. При использовании ИГКС возможно снижение МПК у мальчиков в пубертатный период, что связано с задержкой скелетного созревания.
По словам профессора Н.А. Геппе, клинический кандидоз при использовании ИГКС встречается редко. Мерами снижения риска возникновения местных реакций являются, согласно Глобальной стратегии лечения и профилактики бронхиальной астмы GINA (2011), применение ИГКС с низкой депозицией в ротоглотке (пролекарства, новые лекарственные формы ИГКС, современные средства доставки препаратов), к которым относится циклесонид (Альвеско®), а также использование дополнительных устройств и полоскание рта водой после ингаляции для уменьшения абсорбции препарата (уровень доказательности А). Согласно данным зарубежного исследования, частота развития локальных нежелательных реакций при лечении циклесонидом детей в возрасте от 4 до 11 лет была сопоставима с таковой плацебо21. Причем использование спейсера при ингаляции циклесонида не влияло на частоту развития местных нежелательных реакций.
К факторам снижения вероятности развития системных нежелательных реакций, согласно GINA (2011), относятся учет фармакокинетических характеристик ИГКС (эффект первого прохождения через печень, оральная биодоступность, степень связи с белками плазмы) и выбор типа ингалятора (дозированные аэрозольные ингаляторы). Профессор Н.А. Геппе ознакомила участников симпозиума с данными многоцентрового, рандомизированного, двойного слепого плацебоконтролируемого исследования влияния циклесонида на рост детей пубертатного возраста22. В клиническое исследование, которое проводилось в 85 медицинских центрах США, Венесуэлы, Аргентины и Чили, включили 661 ребенка с легкой персистирующей БА. Критериями включения являлись длительность БА > 3 месяцев; ОФВ1 ≥ 80% от должного после более 4 часов отмены сальбутамола; 1-я стадия полового развития по Таннеру; нормальный рост (5–95 перцентиль) и нормальная скорость роста в течение предшествующих 6 месяцев.
Применялись следующие критерии оценки: линейная скорость роста в течение периода лечения циклесонидом на основании 4 измерений; исходно и через 1 год определялся уровень свободного кортизола в моче, собранной за 24 ч и 10 ч (ночью); спирометрия; рентгенография костей запястья; нежелательные явления. Дети Ц40-группы (n = 221) получали циклесонид 1 раз утром в дозе 40 мкг в течение года; дети Ц160-группы (n = 219) – 160 мкг препарата по той же схеме; пациенты П-группы (n = 221) получали плацебо. Результаты исследования показали, что линейная скорость роста детей оказалась одинаковой. Анализ не показал различий скорости роста детей в разных странах. Исследование функционирования гипоталамо-гипофизарно-надпочечниковой системы не выявило изменений – уровень свободного кортизола в 24- и 10-часовой моче через 1 год не отличался от исходного во всех группах. Циклесонид хорошо переносился в обеих группах терапии.
В другом 12-недельном многоцентровом, двойном слепом рандомизированном плацебоконтролируемом исследовании RAINBOW, в котором приняли участие 1080 детей в возрасте от 6 до 11 лет, изучалась эффективность трех различных доз циклесонида по сравнению с плацебо у детей с БА23. Больные Ц40-группы (n = 305) получали 40 мкг циклесонида; пациенты Ц80-группы (n = 312) – 80 мкг препарата; больные Ц160-группы (n = 313) –160 мкг; дети П-группы (n = 150) получали плацебо. Оценивались нежелательные явления, суточная секреция кортизола, рост детей (стадиометрия). Полученные данные позволили сделать следующие выводы: у детей 6–11 лет с персистирующей БА терапия циклесонидом в дозе от 40 до 160 мкг/сутки является безопасной; частота нежелательных явлений не зависит от того, использует пациент спейсер или нет; циклесонид не влияет на рост детей и уровень кортизола.
Подводя итоги выступления, профессор Н.А. Геппе отметила, что эффективность ИГКС не одинакова у разных пациентов, что может быть связано с фенотипами астмы, а также с воздействием внешних факторов и генетическими различиями. Именно поэтому индивидуализированный подход в выборе средств и методов лечения способствует достижению лучших результатов. В этой связи появление Альвеско® не только расширяет возможности выбора ИГКС, но и пополняет арсенал педиатра эффективным препаратом с минимальными побочными действиями.
Алгоритм выбора терапии при бронхиальной астме
В начале выступления доцент кафедры пульмонологии ФУВ РГМУ, к.м.н. Н.П. КНЯЖЕСКАЯ отметила, что терапия БА означает в первую очередь контроль воспаления в бронхах. Полного контроля заболевания можно добиться с помощью лечения, направленного на его достижение и поддержание. «Согласно GINA (2010), при фармакотерапии БА у детей старше 5 лет и у взрослых рекомендуется применять ступенчатый подход, который предполагает увеличение или уменьшение объема терапии в зависимости от выраженности клинических симптомов», – уточняет Надежда Павловна. Терапия 1-й ступени означает применение бета-2-агониста быстрого действия по потребности и выбор базисной терапии, ключевое место в которой занимают ИГКС, отличающиеся выраженным противовоспалительным действием.
Они способствуют уменьшению количества Т-клеток, подавлению реакции гиперчувствительности замедленного типа, транскрипции цитокинов, молекул адгезии и белков воспаления, активируют синтез противовоспалительных факторов, снижают проницаемость сосудов. На 2-й ступени в качестве начальной поддерживающей терапии БА у больных любого возраста рекомендуется применение ИГКС в низкой дозе (уровень доказательности А). Исследования последних лет показали, что мелкие бронхи играют важную роль в патогенезе БА. Воспаление в мелких бронхах при БА приводит к повышению периферического сопротивления, появлению ночных симптомов БА, повторяющимся обострениям. У пациентов с легкой степенью тяжести заболевания и нормальной легочной функцией отмечается повышение периферического сопротивления в 7 раз. Альвеско® позволяет улучшить контроль БА у пациентов с легким течением заболевания26, 27.
- дети старше 6 лет:
- рекомендованная ежедневная доза – 80–160 мкг в сутки однократно или 80 мкг дважды в день;
- Альвеско® может использоваться со спейсером или без него;
- взрослые, пожилые пациенты и подростки старше 12 лет:
-
при астме легкой и умеренной степени тяжести рекомендованная ежедневная доза – 160–640 мкг в сутки, дозу640 мкг следует делить на 2 приема в день;
- при астме тяжелой степени доза может быть увеличена максимально до 2 раз по 640 мкг ежедневно.
Заключение