Синдром избыточного бактериального роста при патологии органов пищеварения. Причины и последствия
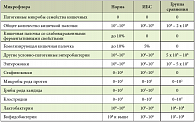
Открыл работу сателлитного симпозиума доклад, посвященный одной из часто встречающихся в практике врача-гастроэнтеролога клинических ситуаций – дисбиозу кишечника. Данное патологическое состояние обусловлено изменением количественного и качественного состава популяции бактерий, обитающих в кишечнике человека. Однако прежде чем говорить о нарушениях состава бактериальной микрофлоры, необходимо определить, что считать нормой. С ответа на этот вопрос и начала свой доклад к.м.н. Н.А. АГАФОНОВА, доцент кафедры гастроэнтерологии ФУВ РНИМУ им. Н.И. Пирогова. Микрофлора желудочно-кишечного тракта (ЖКТ) распределена по разным биотопам достаточно неравномерно: в желудке, как правило, микрофлора транзиторная, концентрация микроорганизмов составляет < 103 КОЕ/мл; в тонкой кишке возможность роста бактерий колеблется, концентрация достигает 102–109 КОЕ/мл; в толстой кишке, самом «населенном» отделе ЖКТ, количество микроорганизмов составляет 104–1012 КОЕ/мл.
Неравномерность распределения микрофлоры обусловлена особенностями анатомии и физиологии ЖКТ, например изменением pH содержимого по мере продвижения от желудка к прямой кишке. Факторами, регулирующими состав кишечной микрофлоры, являются непрерывная пропульсивная перистальтика кишечника; кислотность желудочного сока; секреция иммуноглобулина А; целостность нормальной слизистой кишечника. Во всем многообразии проблем, связанных с микрофлорой ЖКТ, можно выделить два основных состояния: кишечные инфекции и дисбиоз кишечника. Первая группа нарушений микрофлоры обусловлена колонизацией ЖКТ патогенными микроорганизмами, в то время как вторая группа связана с изменением количества и состава микрофлоры отдельных биотопов (тонкой и/или толстой кишки) и появлением факультативных штаммов, не входящих в состав резидентной микрофлоры. При описании нарушений микрофлоры второго типа, как правило, используются термины «синдром избыточного бактериального роста (СИБР) тонкой кишки» и «дисбиоз/дисбактериоз толстой кишки».
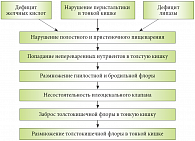
Диагноз «СИБР тонкой кишки» может быть поставлен при обнаружении более 105 микроорганизмов в 1 мл аспирата из тощей кишки или при обнаружении в нем бактерий, характерных для микрофлоры толстой кишки. Развитию СИБР способствуют различные патологические состояния органов пищеварительной системы: нарушения желудочной секреции, стаз кишечника, наличие свищей между различными отделами ЖКТ, повреждения слизистой кишечника, заболевания печени, желчных путей и поджелудочной железы, а также иммунодефицит. Частота выявления СИБР у пациентов, страдающих теми или иными хроническими заболеваниями ЖКТ, составляет 70–97%1. Предрасполагающим фактором для формирования СИБР у больных с заболеваниями холепанкреатодуоденальной зоны является билиарная и панкреатическая недостаточность (рис. 1).
Важно понимать, что СИБР является не только следствием заболеваний ЖКТ, но в ряде случаев и их причиной; может участвовать в патогенезе развития ряда хронических заболеваний органов пищеварения (панкреатит, желчекаменная болезнь, цирроз печени), а также ухудшать течение и способствовать прогрессированию уже имеющихся. Доказана взаимосвязь между билиарной недостаточностью и СИБР: снижение количества выделяемой желчи приводит к нарушению расщепления жиров и развитию мальабсорбции, что создает условия для СИБР в двенадцатиперстной и тонкой кишке. Бактериальная флора деконъюгирует желчные кислоты, увеличивая их дефицит для процессов пищеварения. При этом формируются нарушения моторики двенадцатиперстной и тонкой кишки с повышением давления в просвете, что приводит к более выраженному нарушению выделения и секреции желчи по билиарному тракту и усугублению билиарной недостаточности.
Следующая часть выступления Н.А. Агафоновой была посвящена клиническим проявлениям кишечного дисбиоза, местным симптомам (боль, диспепсия), которые усугубляют течение основного заболевания, и системным нарушениям, вызываемым транслокацией микроорганизмов (развитие интоксикации, индукция синтеза провоспалительных цитокинов и др.). Таким образом, СИБР может являться не только следствием, но и причиной серьезных патологий, поэтому пациенты, страдающие нарушениями микрофлоры, должны находиться в зоне особого внимания гастроэнтеролога. Какие шаги следует предпринять врачу при подозрении на СИБР? Диагностика этого состояния основывается на результатах лабораторно-инструментальных исследований (посев аспирата из тонкой кишки и водородный дыхательный тест, которые трудновыполнимы в общей клинической практике) и клинических данных (быстрое достижение терапевтического эффекта при включении в лечение пациента курса деконтаминации кишечника). Необходимо установить основное заболевание, которое создало условия для развития СИБР.
Н.А. Агафонова, говоря о лечении СИБР, отметила, что для достижения устойчивого терапевтического эффекта необходимо, чтобы больному проводилось лечение основного заболевания (этиологически обоснованное) одновременно с лечебными мероприятиями, направленными на нормализацию процессов пищеварения, устранение моторных нарушений и восстановление нормальной микрофлоры тонкой и толстой кишки. Для нормализации микрофлоры кишечника традиционно используются пребиотики, пробиотики и кишечные антисептики. Для лечения СИБР предпочтение отдается невсасывающимся кишечным антибиотикам. Среди препаратов первого выбора, рекомендуемых для деконтаминационной терапии, Н.А. Агафонова назвала, в частности, Альфа Нормикс (рифаксимин). По окончании антибактериальной терапии этим лекарственным препаратом пациенту следует назначать комбинированные (многовидовые и многоштаммные) пробиотики сроком на 2–4 недели.
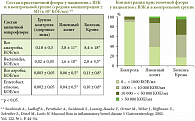
Альфа Нормикс обладает рядом преимуществ по сравнению с системными антибактериальными средствами: препарат практически не всасывается в кровь, что обеспечивает высокий профиль безопасности и позволяет достичь высокой концентрации в фекалиях (4000–8000 мкг/г), что превышает минимальные ингибирующие концентрации для бактерий. Рифаксимин характеризуется широким спектром действия в отношении большинства грамположительных и грамотрицательных бактерий, как аэробных, так и анаэробных. В подтверждение эффективности Альфа Нормикса в лечении пациентов с СИБР Н.А. Агафонова привела результаты двойного слепого рандомизированного исследования, проведенного М. Di Stefano и соавт. (2000), в ходе которого рифаксимин сравнивался с хлортетрациклином (результаты оценивались по водородному дыхательному тесту)2. У больных, получавших рифаксимин, количество водорода в выдыхаемом воздухе через 3 дня после лечения оказалось достоверно меньше, чем у больных, принимавших хлортетрациклин (рис. 2), что свидетельствует об эффективности рифаксимина в отношении СИБР.
В завершение своего выступления Н.А. Агафонова рассказала о месте применения кишечных антисептиков в лечении синдрома раздраженного кишечника (СРК), в частности об исследовании эффективности терапии СРК препаратом Альфа Нормикс в высоких дозах (от 1200 мг/сут). Исследование J. Jolley (2011), посвященное данному вопросу, продемонстрировало высокую эффективность рифаксимина для лечения пациентов, страдающих различными типами СРК (неопределенного типа, с запорами и с диареей)3.
Симбионтное пищеварение: нарушения, клиника, коррекция
Организм человека на протяжении всей жизни находится в сложных симбиотических взаимоотношениях с огромным количеством микроорганизмов, населяющих кожные покровы и открытые полости тела. При этом важно понимать, что интенсивность и характер влияния бактерий-симбионтов на макроорганизм могут меняться в зависимости от большого количества факторов. Подчеркивая важность и многообразие симбиотических взаимоотношений, д.м.н., профессор А.И. ПАРФЕНОВ, заведующий отделом патологии кишечника ЦНИИ гастроэнтерологии (Москва), в начале своего выступления процитировал великого русского ученого И.И. Мечникова: «Флора должна оказывать влияние на самые разнообразные процессы, совершающиеся в организме, то благоприятствуя, то препятствуя наступлению болезни».
Бактерии-симбионты играют особую роль в пищеварении. Микроорганизмы, населяющие ЖКТ, продуцируют ферменты, способные гидролизировать потребляемые макроорганизмом питательные вещества. Еще одним аспектом симбиоза человеческого организма с бактериями, составляющими микробиоту, является так называемое симбионтное питание, процесс утилизации продуктов питания бактериями с последующим поглощением макроорганизмом пищи, состоящей из структур симбионтов. Бактерии-симбионты участвуют в кишечном пищеварении, осуществляя синтез витаминов, незаменимых аминокислот и других веществ, необходимых макроорганизму для нормальной жизнедеятельности. Кроме того, микроорганизмы снабжают эпителиоциты короткоцепочечными жирными кислотами, которые являются энергией для их функционирования (процессов клеточной регенерации, всасывания).
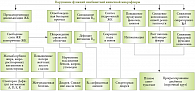
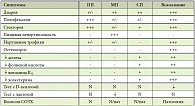
Каковы же причины нарушения симбионтного пищеварения? Это болезни органов ЖКТ, прием антибиотиков, заболевания иммунной системы и кишечные инфекции. При этом наблюдаемая у пациента симптоматика напрямую связана с тем, какая именно функция симбионтного пищеварения нарушена (рис. 3). Симптоматика нарушений пищеварения позволяет определить, идет ли речь о проблемах с симбионтным пищеварением или в патологический процесс вовлечено полостное или мембранное пищеварение (табл. 1). Для коррекции нарушений симбионтного пищеварения сегодня применяются невсасывающиеся антибиотики, пре- и пробиотики, а также функциональное питание. В ряде зарубежных стран начинают применяться так называемые постбиотики, продукты метаболизма пробиотических микроорганизмов.
В целом, как отметил профессор А.И. Парфенов, принципы терапии нарушений симбионтного пищеварения и лечения нарушений состава микробиоты кишечника идентичны. Сначала пациенту необходимо провести деконтаминацию кишечника, лучше антибиотиком с минимальным всасыванием, таким как Альфа Нормикс (рифаксимин). Возможно проведение комбинированной терапии в сочетании с пробиотиками. Очень важно, что принятая доза данного препарата практически полностью выводится с калом, в кровь всасывается менее 0,4% препарата. В результате использования рифаксимина уменьшается выраженность СИБР, после чего можно переходить к терапии, направленной на восстановление нормального состава микробиоты.
Подчеркнув важность использования пребиотиков – веществ, необходимых бактериям-симбионтам для нормальной жизнедеятельности, – профессор А.И. Парфенов рассказал о рисках, связанных с использованием препаратов на основе живых бактерий у детей. По словам профессора, такие средства могут вызывать сепсис, поэтому в детской практике лучше использовать препараты, в состав которых входят компоненты метаболизма бактерий и нежизнеспособные бактериальные клетки. Завершая свое выступление, А.И. Парфенов еще раз подчеркнул, что для коррекции нарушений симбионтного пищеварения, которые клинически проявляются диареей, дискомфортом в животе, снижением уровня железа, витамина В12, нужно применять антибактериальные препараты, например рифаксимин, пробиотики, пребиотики, симбиотики, постбиотики и продукты функционального питания.
Роль дисбиотических нарушений в патогенезе неалкогольной жировой болезни печени
О роли дисбиотических нарушений в развитии неалкогольной жировой болезни печени (НАЖБП) и ассоциированных с ней заболеваний рассказала д.м.н., профессор Л.А. ЗВЕНИГОРОДСКАЯ, заведующая отделом изучения метаболического синдрома ЦНИИ гастроэнтерологии (Москва). К таким заболеваниям, в частности, относится атеросклероз. Атеросклероз напрямую связан с НАЖБП, так как именно нарушение работы печени считается одним из основных факторов развития и прогрессирования метаболического синдрома и сердечно-сосудистых осложнений. «Атеросклероз – это хроническая системная воспалительная реакция организма, возникающая на фоне дислипидемии и дисфункции липидрегулирующих систем печени, а значит, оценка функционального состояния данного органа и роли дисбиотических нарушений в реализации системного субклинически протекающего воспаления является одним из приоритетных направлений гепатологии и кардиологии», – подчеркнула профессор Л.А. Звенигородская.
Роль печени в реализации системных воспалительных реакций достаточно многообразна: в печени синтезируются первичные медиаторы воспаления, происходит синтез белков острой фазы воспаления, элиминируются циркулирующие иммунные комплексы. Эти процессы тормозят выполнение печенью других функций, в частности, затрудняют регуляцию липидного обмена, детоксикацию лекарств, нарушают функционирование системы цитохрома P450. Сегодня считается доказанным, что перекисно-модифицированные апобелки (В, Е), содержащие липопротеины низкой плотности (ЛПНП) и липопротеины очень низкой плотности (ЛПОНП), приобретают свойства аутоантигенов. Уже идентифицировано более 100 специфических антител к пептидным фрагментам МДА-апобелков, которые могут быть удалены из сосудистого русла только при участии системы мононуклеарных фагоцитов, клеток лимфоидного ряда, фибробластов, которые реализуют и завершают воспалительную реакцию в сосудистой стенке. Наличие системного воспаления подтверждается результатами лабораторного исследования на высокочувствительный С-реактивный белок: повышение его уровня достоверно связано с увеличением риска развития сердечно-сосудистых заболеваний и сахарного диабета.
На протяжении многих лет, отметила профессор Л.А. Звенигородская, стеатоз печени рассматривался как безобидное заболевание, не влияющее на жизненный прогноз пациента. К сожалению, стеатогепатоз и стеатогепатит являются звеньями одной цепи, результатом которой оказывается цирроз печени. На сегодняшний день среди всех больных, которым необходима трансплантация печени, пациенты с циррозом печени в исходе НАЖБП составляют 40%. Нарушение процессов липидного метаболизма в печени развивается при наличии ряда факторов: активация процессов перекисного окисления липидов, экспрессия системы цитохрома Р450 и нарушение состава микробиоты кишечника, которое, в свою очередь, приводит к эндотоксин-опосредованному увеличению интенсивности процессов перекисного окисления липидов. Нормально функционирующая микрофлора кишечника выполняет целый ряд важнейших функций: участвует в детоксикации и выведении токсических соединений, разрушении мутагенов, активации лекарственных соединений и др.
На поверхности грамотрицательных бактерий, входящих в состав микрофлоры кишечника, непрерывно вырабатывается особый гликопротеид – эндотоксин. Избыточное поступление этого вещества в кровь приводит к интенсификации синтеза эндогенного холестерина в печени, а также к выбросу провоспалительных цитокинов. В результате развивается так называемая эндотоксин-опосредованная гиперхолестеринемия. Под влиянием эндотоксина уменьшается содержание естественных ингибиторов абсорбции холестерина. Клиницистам важно помнить, что на фоне нарушений микрофлоры кишечника дислипидемия принимает устойчивую к лекарственной терапии форму: снижается эффективность статинов и некоторых гипотензивных препаратов.
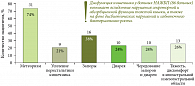
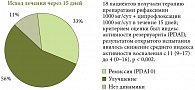
НАЖБП тесно связана с другими заболеваниями органов пищеварения. Патология толстой кишки у больных НАЖБП встречается в 88,5% случаев, а патология пищевода – в 72%. Что касается выраженных дисбиотических изменений, они наблюдаются почти у половины пациентов с НАЖБП: в одном из исследований, о результатах которых рассказала профессор Л.А. Звенигородская, дисбиоз кишечника был обнаружен у 38 из 86 больных. Дисфункция кишечника у обследованных пациентов была обусловлена, помимо СИБР, нарушением секреторной и абсорбционной функций толстой кишки, что сопровождалось разнообразной симптоматикой (рис. 4.). Наличие дисбактериоза подтверждалось результатами бактериального исследования кала (табл. 2). У больных с повышенным содержанием эндотоксина был также повышен индекс фиброза и стеатоза печени.
Результаты эндоскопического и рентгенологического исследований показали наличие у 35 пациентов нарушений моторики, у 30 – дивертикулов толстой кишки, полипы были выявлены у 13 больных, участки гиперемии слизистой оболочки толстой кишки (СОТК) – у 18, микроэрозии – у 12. По данным гистологического исследования, из 23 пациентов, которым проводилась биопсия, патологические изменения СОТК разной степени выраженности были обнаружены у 21 больного. У пациентов, которым в ходе исследования назначался Альфа Нормикс, наблюдалось быстрое снижение числа бактерий в кале, что привело к уменьшению выраженности признаков синдрома раздраженного кишечника, симптомов печеночной энцефалопатии, а также дивертикулярной болезни и других расстройств, связанных с нарушениями бактериальной микрофлоры.
Гиполипидемическая терапия (для коррекции нарушений липидного обмена использовались различные схемы, включавшие применение статинов и пробиотиков), проводившаяся после окончания санации кишечника рифаксимином, была эффективной и приводила к нормализации уровня холестерина. Согласно энтерогепатоцеллюлярной концепции развития НАЖБП и атерогенной дислипидемии, дисбиоз кишечника приводит к повышению уровня эндотоксина, который повреждает гепатоциты и клетки сосудистого эндотелия. Это обусловливает выбор терапии НАЖБП и атеросклероза: лечение должно осуществляться дифференцированно, с обязательным использованием гепатопротекторов, внутрикишечных бактериальных препаратов и биокорректоров.
Подчеркивая значимость такого важного параметра лекарственной терапии, как безопасность, профессор Л.А. Звенигородская отметила, что Альфа Нормикс полностью отвечает современным требованиям к безопасности лекарственных средств. По данным Л.А. Звенигородской, при проведении исследования, в котором этот препарат принимали 186 пациентов, не было зарегистрировано ни одного случая развития побочных эффектов или отмены рифаксимина в связи с непереносимостью препарата.
Лечение синдрома избыточного бактериального роста у больных с воспалительными заболеваниями кишечника
Выступление д.м.н. О.В. ГОЛОВЕНКО, ведущего научного сотрудника гастроэнтерологического отделения ГНЦ колопроктологии (Москва), было посвящено роли микрофлоры в этиологии воспалительных заболеваний кишечника (ВЗК), которые считаются тяжелейшими расстройствами в гастроэнтерологической практике. Поиск новых методов лечения этих заболеваний и усовершенствование уже существующих являются весьма актуальной задачей. К сожалению, больным ВЗК с перианальными поражениями, изъязвленной слизистой толстой кишки врачи не могут предложить ничего, кроме инвалидизирующей операции по отключению пассажа по кишке. Для молодых людей – а пациенты с болезнью Крона (БК), как правило, являются людьми трудоспособного возраста – такое лечение, конечно, является неприемлемым.
По словам О.В. Головенко, в гастроэнтерологическом сообществе достаточно популярна теория, согласно которой в патогенезе ВЗК ведущую роль играет микрофлора кишечника. Для подтверждения данной гипотезы было проведено исследование на мышах с отключенным геном интерлейкина-10. Одной группе мышей давали обычный корм, и они быстро умирали от тяжелого аутоиммунного колита, в то время как мыши из другой группы, питавшиеся стерильным кормом, жили без всяких признаков заболевания. Части мышей из первой группы проводили хирургическую операцию отключения пассажа по толстой кишке или давали антибиотики широкого спектра действия (рифаксимин), у этих животных наблюдалось снижение активности колита.
В 2002 г. были проведены работы по изучению пристеночной микрофлоры у больных язвенным колитом (ЯК), у пациентов с БК и у здоровых людей. Исследование показало, что у больных ЯК по сравнению со здоровыми людьми было повышено содержание как аэробов, так и анаэробов в кишечнике. У больных БК эти изменения были еще более выражены (рис. 5). Считается, что в формировании БК важную роль играет СИБР, который регистрируется у 20–25% пациентов. Связано это с тем, что БК часто локализуется в илеоцекальной области, что создает благоприятные условия для контаминации тонкой кишки. У пациентов с БК признаки СИБР часто и необоснованно принимают за активизацию основного заболевания. Назначаются противовоспалительные препараты, в частности глюкокортикостероиды, в то время как больные нуждаются в адекватной антибактериальной терапии.
«У пациентов с болезнью Крона, – отметил О.В. Головенко, – синдром избыточного бактериального роста наблюдается гораздо чаще, чем у больных язвенным колитом, поскольку при болезни Крона замедляется транзит содержимого по тонкой кишке». Сужение просвета дистальной части тонкой кишки и перенесенное хирургическое вмешательство по удалению баугиниевой заслонки у больных БК увеличивают риск развития СИБР. Кроме того, существуют данные исследований, указывающие на увеличение распространенности СИБР у пациентов с ВЗК, перенесших резекцию участков кишки, как тонкой, так и толстой, поскольку хирургические вмешательства создают идеальные условия для развития СИБР.
В каких же случаях пациентам, страдающим БК, показаны антибиотики? Согласно рекомендациям Европейской ассоциации по изучению БК и ЯК, назначение антибиотиков считается обоснованным только при септических осложнениях, наличии симптомов, связанных с избыточным бактериальным ростом, и при поражении промежности. К сожалению, рандомизированных контролируемых исследований эффективности метронидазола и/или ципрофлоксацина в лечении перианальной БК до сих пор не проводилось, поэтому обоснованием антибиотикотерапии являются неконтролируемые исследования. Антибиотики эффективно купируют симптомы заболевания, но редко приводят к полному заживлению: к сожалению, после отмены препаратов обычно наступает обострение.
Сегодня активно продолжаются поиски альтернативы классической антибактериальной терапии метронидазолом и ципрофлоксацином. Одним из наиболее перспективных с этой точки зрения препаратов, несомненно, является Альфа Нормикс. Даже наличие повреждений слизистой оболочки кишечника или инфекции Shigella не вызывает увеличения абсорбции рифаксимина, препарат остается в кишечнике практически в неизмененном виде и в очень высокой концентрации. В 2000 г. L. Biancone было проведено слепое плацебоконтролируемое исследование, показавшее, что на фоне приема рифаксимина у пациентов с БК с эндоскопической ремиссией достоверно чаще наблюдается снижение уровня водорода в выдыхаемом воздухе (рис. 6).
Проводилось открытое исследование рифаксимина в терапии среднетяжелой формы БК, в котором приняли участие 402 пациента. В ходе исследования пациенты получали 800 мг рифаксимина 1 или 2 раза в день или плацебо в течение 12 недель. Выяснилось, что оптимальная суточная доза рифаксимина составляет 800 мг: пациенты, принимавшие препарат в этой дозировке, достигали ремиссии в 62% случаев, в то время как в группе плацебо аналогичный показатель составил всего 42%. Изучалась эффективность рифаксимина в терапии активного ЯК. По сравнению с группой пациентов, получавших плацебо, больные ЯК, принимавшие 800 мг рифаксимина в сутки в течение 10 дней, демонстрировали снижение индекса эндоскопической активности (p < 0,05), частоты стула (p < 0,02) и индекса ректального ькровотечения (p < 0,05).
О. В. Головенко привел также данные исследований, в ходе которых было показано, что рифаксимин способствует сохранению ремиссии при ЯК и снижению выраженности симптомов СРК, часто наблюдаемых при БК. Завершил свое выступление докладчик комментариями исследований о применении рифаксимина при резервуарите – идиопатическом воспалении в тонкокишечном резервуаре после колэктомии с наложением илеоанального резервуарного анастомоза. В патогенезе этого заболевания существенную роль играет избыточный бактериальный рост, поэтому применение рифаксимина в сочетании с ципрофлоксацином позволило снизить средний индекс активности воспаления с 11 до 4 (рис. 7). В настоящее время продолжаются исследования эффективности рифаксимина для базисной терапии БК.
Заключение
По мере накопления научных данных становится очевидно, что СИБР сопровождаются многие гастроэнтерологические заболевания, на первый взгляд не связанные с нарушением состава микробиоты кишечника. Появляется новая информация о роли бактерий-симбионтов в организме человека, о важности сохранения нормального качественного и количественного состава микробиоты ЖКТ. Этим объясняется актуальность разработки эффективных и безопасных терапевтических методик для коррекции дисбиотических нарушений. Одним из препаратов, представляющих особый интерес с этой точки зрения, является невсасывающийся антибиотик рифаксимин, выпускаемый под торговым наименованием Альфа Нормикс. Информация об использовании данного средства в различных клинических ситуациях, представленная в ходе симпозиума, безусловно, будет полезна для практикующих гастроэнтерологов.